基于TLR4信号通路探讨补肾利咽方治疗IgA肾病作用机制*
邹 迪,张守琳,张洪宝,王银萍
(长春中医药大学附属医院 长春 130021)
IgA 肾病(IgA nephropathy,IgAN)是肾活检免疫病理显示在肾小球系膜区以IgA 为主的免疫复合物沉积,以肾小球系膜增生为基本组织学改变,临床表现多种多样,主要表现为血尿,可伴有不同程度的蛋白尿、高血压和肾脏功能受损[1]。IgA 肾病是我国最常见的原发性肾小球疾病,也是导致尿毒症的首要病因,在我国肾活检检出率高达50.7%-58.2%,且近年来发病率逐渐上升[2-4],多发于青壮年[5]。IgAN病情进展快,肾活检确诊10-20 年后约15%-39%的患者进展至终末期肾病(End-stage renal disease,ESRD)[6-7],需要透析或者肾移植等肾脏替代治疗。
现代医学认为,对于以血尿为主的IgA 肾病,只能定期复查,且单纯血尿的患者20年后仍可发展为尿毒症;对于有蛋白尿的IgA 肾病,可应用血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂(ACEI/ARB),但效果有限;对于快速进展型IgA 肾病,应用糖皮质激素及免疫抑制剂有一定疗效,但安全性仍存在争议,可出现致死性感染或其他不良反应;IgA 肾病一旦肾小球滤过率(GFR)下降超过50%-60%或血肌酐(SCr)>250 μmol·L-1,只能等待肾脏替代治疗。反复扁桃体感染诱发的IgA 肾病患者,可选择抗炎或扁桃体切除的方法减少本病复发,但临床试验样本量较少,且无前瞻性RCT支持[8-9]。
尽管IgA 肾病的发病机制尚未完全清楚,但是发作性血尿之前常常有上呼吸道感染或肠道感染,说明粘膜免疫系统在IgAN中起重要作用,尤其是咽部感染所导致的自身免疫反应紊乱可能是重要的发病机制之一[10-11],很多中医学者也注重从咽论治IgAN,取得了较好的临床疗效[12-13]。但目前的研究多以临床研究为主,缺乏对从咽论治IgAN疗效作用机制的探讨。
国医大师任继学教授认为IgA 肾病的病机关键为肾与脾。肾虚脾亏是发病之本,毒聚咽喉是发病之关键。这与现代医学感染导致IgA 肾病加重的观点一致。任老将“喉肾相关”理论用于系统诊治IgA肾病,认为IgA 肾病的复发以及演变与咽喉关系密切,运用补肾健脾,解毒利咽法治疗IgA 肾病40 余年,可有效减轻患者血尿、蛋白尿。本实验采用经典的IgA 肾病大鼠模型,以黏膜感染、TLR4 信号传导系统激活诱发免疫反应、IgA1 糖基化异常为研究主线,进一步探讨补肾健脾、解毒利咽法调节天然黏膜免疫机制及干预IgA1 糖基化异常,从而阐明补肾健脾、解毒利咽法在本病发病及肾小球系膜区损伤中的分子调控机制。
1 材料
1.1 实验动物
选取SPF 级雄性SD 大鼠80 只作为研究对象,体质量180±20 g,常规饲养于长春中医药大学SPF 级动物房,室温(22±2)℃,自然昼夜节律光照,相对湿度(55%±5%)。大鼠普通饮食,自由饮水。
1.2 实验药物及制备
实验组:给予补肾利咽方中药汤剂(黄芪、生地黄、马勃、紫荆皮、金荞麦、木蝴蝶等)。由我院中医药研究中心提供;对照组:盐酸贝那普利片(洛汀新),北京诺华制药有限公司,批准文号:国药准字H20030514,规格:10 mg/片。
1.3 主要仪器及试剂
正置显微镜(徕卡显微系统有限公司,型号DM1000);组织破碎机(上海般诺生物科技有限公司,型号BIO-950);生物组织包埋机-冷冻机(泰维科技,型号TB-718L);全自动生化分析仪(东莞市健威医疗器械有限公司,型号BS-380);高速冷冻离心机(杭州奥盛,型号Icen-24R);PCR 仪(杭州柏恒,型号GE48527);荧光定量PCR 仪(Bio-Rad,型号CFXConnect 96);鼓风干燥箱(上海一恒,型号DHG-9240A);数显恒温水浴锅(中国金南,型号HHW600);超微量分光光度计(杭州奥盛,型号Nano-300);全自动尿沉渣分析仪(Sysmex,型号UF-1000i)。荧光素标记兔抗鼠IgA 抗体(北京博奥森生物技术有限公司,批号bs-10491R,规格100 μL);牛血清白蛋白、脂多糖、蓖麻油(美国sigma 公司,批号分别为A1933,SMB00610,259853);四氯化碳(北京化学试剂厂,批号C112040);DAB 浓缩型试剂盒(Solarbio,货号DA1010-2×3 mL);苏木素(Solarbio,货号G1140);中性 树 脂(Solarbio,货 号G8590);封 闭 山 羊 血 清(Solarbio,货号SL038-10 mL)。
2 方法
2.1 分组及造模
采用分层随机方法将80 只SD 大鼠分为空白组15 只,造模组65 只,每笼10 只分开喂养。参照陆慧渝[14]等的方法复制IgA肾病大鼠模型。
空白组:0.9%氯化钠注射液4 mL·kg-1,灌胃,隔日1 次,持续8 周;0.9%氯化钠注射液每只0.4 mL,皮下注射,每周1 次,持续9 周;第6 周0.9%氯化钠注射液每只0.2 mL,尾静脉注射。
造模组:将牛血清白蛋白结晶粉以蒸馏水配成100 g·L-1浓度的稀释液体,以4 mL·kg-1,灌胃,隔日1 次,持续8 周;将CCl4与蓖麻油,以1∶3 的比例混合均匀,每只0.4 mL,皮下注射,每周1次,持续9周;第6周将脂多糖与0.9%氯化钠注射液配成0.25 g·L-1的溶液,每只0.2 mL,尾静脉注射。造模周期为9周。
验证模型:第9 周末,空白组及模型组各随机抽取3 只大鼠处死,免疫荧光法观察IgA 在肾组织沉积情况,以验证模型是否成功:空白组肾小球未见IgA免疫荧光染色,模型组肾小球可见大量IgA 荧光信号,呈颗粒状沉积。将造模成功大鼠随机分为模型组、洛丁新对照组、补肾利咽方高、中、低剂量组,每组10 只。
2.2 给药
各组大鼠灌胃给药如下,每天1 次,连续6 周。①空白组:生理盐水4 mL·kg-1;②模型组:生理盐水4 mL·kg-1;③洛汀新组:4 mL·kg-1,洛汀新1.041 mg;④补肾利咽方低剂量组:4 mL·kg-1,含生药量10.4 g;⑤补肾利咽方中剂量组:4 mL·kg-1,含生药量20.81 g;⑥补肾利咽方高剂量组:4 mL·kg-1,含生药量41.62 g。
2.3 观测指标
2.3.1 一般状态
观察大鼠一般状态并记录,包括活动次数、毛色、光泽度、进食情况、二便颜色、尿量、死亡情况。
2.3.2 检测尿红细胞计数(RBC)及24 小时尿蛋白(UTP)
于实验前、造模后及给药后将大鼠单个置于代谢笼中24 h,观察尿色,记录尿量,所收集尿液标本行尿沉渣法检测尿RBC,行磺基柳酸法检测UTP。
2.3.3 检测肾功能
实验结束时,用1%戊巴比妥钠40 mg·kg-1麻醉大鼠,从腹主动脉采血,分离血清备检。应用全自动生化分析仪检测血清尿素氮(BUN)、血肌酐(SCr)。
2.3.4 免疫组化法检测各组肾组织Toll 样受体4(TLR4)、髓样分化因子(MyD88)、核因子-κB(NFκB)、单核细胞趋化蛋白-1(MCP-1)的表达
取肾组织处理后,按常规步骤脱水浸蜡包埋;切片、展片、烤片,并进行免疫组化染色。通过烤片、脱蜡、水化、抗原修复、阻断、封闭,滴加一抗,湿盒孵育,4℃孵育过夜。PBS溶液冲洗3 min×3次。随后二抗孵育,滴加二抗,湿盒孵育,37℃孵育30 min。PBS 溶液冲洗3 min×3 次。之后进行显色、苏木素染色、脱水,透明和封片,最后进行图像采集。
2.3.5 PCR 检测外周血β1,3 半乳糖转移酶(C1GALT 1)及Cosmc mRNA表达
实时荧光定量PCR检测C1GALT1及Cosmc mRNA的表达RNA提取;用分光度计测定样品总RNA浓度和纯度;逆转录;定量PCR扩增;Cosmc、C1GALT1基因和内参照GAPDH基因引物序列;PCR扩增程序:PCR反应程序;使用双deltaCT法来分析目的基因的相对表达量。
2.3.6 Western blot检测血清中TLR4、NF-κB、白介素-6(IL-6)含量
通过组织蛋白的提取,聚丙烯酰胺凝胶电泳,免疫印迹操作-转膜,一抗与靶蛋白的结合,酶标记二抗与一抗的结合,化学发光等实验方法,将扫描获得的图片,在Quantity One 软件(Bio-Rad)下进行分析。β-actin作为内参照,再将各组的目的蛋白相对值除以β-actin相对值,即各组目的蛋白的相对表达量。
2.4 统计学处理
计量资料均以均值±标准差(±s)表示,采用SPSS 22.0 软件进行统计学处理,组间差异采用单因素方差分析法,以P<0.05为差异有统计学意义。
3 结果
3.1 一般情况
造模过程中造模组共死亡5 只大鼠,空白组及造模组每组取3 只大鼠用于验证模型是否成功,共计死亡11 只大鼠。空白组大鼠状态始终良好。造模组大鼠4 周后出现活动减少、进食减少、毛色晦暗、体质量减轻、尿色变深,8 周症状加重,给药后洛丁新组及补肾利咽方组大鼠进食增多、活动增加、体质量增加。
3.2 补肾利咽方对IgA肾病大鼠尿液检查的影响
表1 显示,与空白组比较,模型组大鼠10 周、12 周、16 周尿红细胞、24 h 尿蛋白定量增多(P<0.05);与模型组比较,补肾利咽方组和洛汀新组从10周起尿RBC、UTP 均明显减少,随给药时间延长,尿RBC、UTP减少更为明显(P<0.05)。与洛丁新组比较,补肾利咽方组尿RBC、UTP减少(P<0.05),其中,补肾利咽方高、中剂量组效果最好(P<0.01)。
表1 各组大鼠各时相尿RBC(/HP)、UTP(mg·24 h-1)的比较(±s)
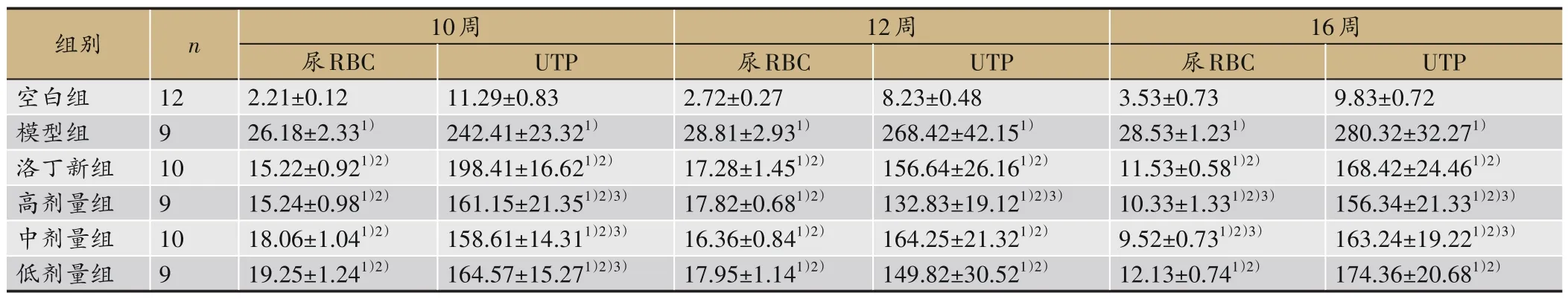
表1 各组大鼠各时相尿RBC(/HP)、UTP(mg·24 h-1)的比较(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与洛丁新组比较,3)P<0.01。
组别空白组模型组洛丁新组高剂量组中剂量组低剂量组n 10周12周16周UTP 9.83±0.72 280.32±32.271)168.42±24.461)2)156.34±21.331)2)3)163.24±19.221)2)3)174.36±20.681)2)12 9 10 9 10 9尿RBC 2.21±0.12 26.18±2.331)15.22±0.921)2)15.24±0.981)2)18.06±1.041)2)19.25±1.241)2)UTP 11.29±0.83 242.41±23.321)198.41±16.621)2)161.15±21.351)2)3)158.61±14.311)2)3)164.57±15.271)2)3)尿RBC 2.72±0.27 28.81±2.931)17.28±1.451)2)17.82±0.681)2)16.36±0.841)2)17.95±1.141)2)UTP 8.23±0.48 268.42±42.151)156.64±26.161)2)132.83±19.121)2)3)164.25±21.321)2)149.82±30.521)2)尿RBC 3.53±0.73 28.53±1.231)11.53±0.581)2)10.33±1.331)2)3)9.52±0.731)2)3)12.13±0.741)2)
3.3 补肾利咽方对IgA肾病大鼠血清肾功能的影响
表2显示,与空白组比较,模型组大鼠SCr、BUN略有上升;与模型组比较,洛丁新组及补肾利咽方组大鼠血SCr、BUN略下降,但无统计学意义(P>0.05)。
表2 各组大鼠给药后血清BUN、SCr比较(±s)
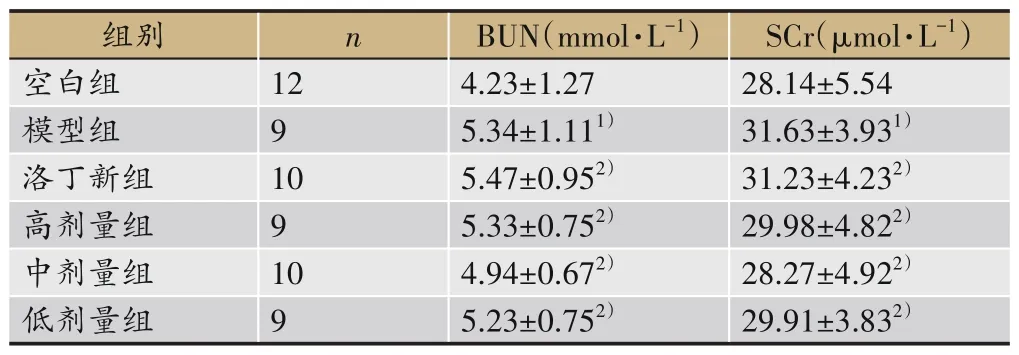
表2 各组大鼠给药后血清BUN、SCr比较(±s)
注:与空白组比较,1)P>0.05;与模型组比较,2)P>0.05。
组别空白组模型组洛丁新组高剂量组中剂量组低剂量组n SCr(μmol·L-1)28.14±5.54 31.63±3.931)31.23±4.232)29.98±4.822)28.27±4.922)29.91±3.832)12 9 10 9 10 9 BUN(mmol·L-1)4.23±1.27 5.34±1.111)5.47±0.952)5.33±0.752)4.94±0.672)5.23±0.752)
3.4 补肾利咽方对IgA肾病大鼠肾组织TLR4、MyD88、NF-κB、MCP-1的影响
表3 显示,与空白组比较,模型组大鼠肾组织TLR4、MyD88、NF-κB、MCP-1 升高(P<0.05);与模型组比较,洛丁新组及补肾利咽方组大鼠肾组织TLR4、MyD88、NF-κB、MCP-1下降(P<0.05)。
表3 各组大鼠给药后肾组织TLR4、MyD88、NF-κB、MCP-1(±s)
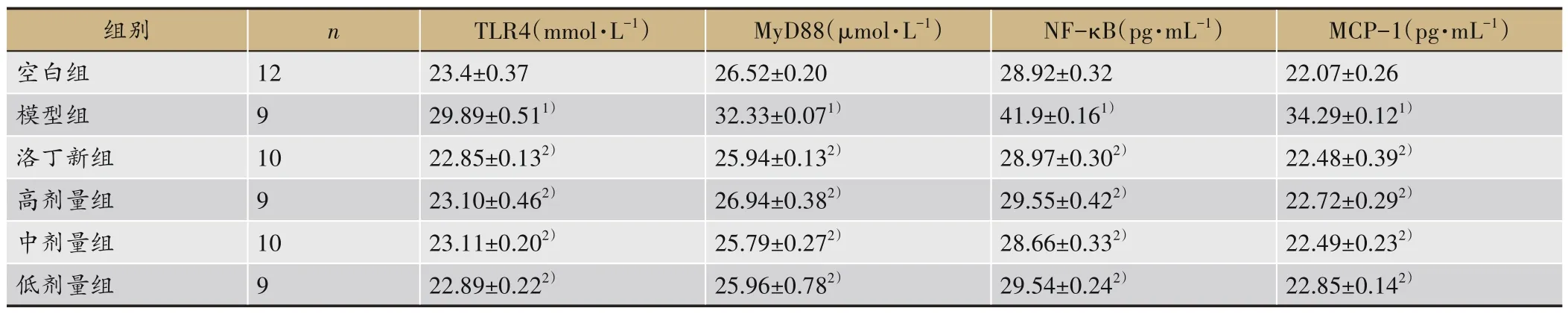
表3 各组大鼠给药后肾组织TLR4、MyD88、NF-κB、MCP-1(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05。
组别空白组模型组洛丁新组高剂量组中剂量组低剂量组n 12 9 10 9 10 9 TLR4(mmol·L-1)23.4±0.37 29.89±0.511)22.85±0.132)23.10±0.462)23.11±0.202)22.89±0.222)MyD88(μmol·L-1)26.52±0.20 32.33±0.071)25.94±0.132)26.94±0.382)25.79±0.272)25.96±0.782)NF-κB(pg·mL-1)28.92±0.32 41.9±0.161)28.97±0.302)29.55±0.422)28.66±0.332)29.54±0.242)MCP-1(pg·mL-1)22.07±0.26 34.29±0.121)22.48±0.392)22.72±0.292)22.49±0.232)22.85±0.142)
3.5 补肾利咽方对IgA 肾病大鼠外周血C1GALT1 及Cosmc mRNA表达的影响
表4 结果表明:与空白组比较,模型组大鼠C1GALT1、Cosmc mRNA 表达明显升高(P<0.05)。与模型组对比,洛丁新组及补肾利咽方组C1GALT1、Cosmc mRNA 的表达降低(P<0.05)。与洛丁新组比较,补肾利咽方组C1GALT1、Cosmc mRNA 降低,其中中剂量组、低剂量组降低明显(P<0.05)。
表4 各组大鼠给药后外周血C1GALT1及Cosmc mRNA表达((±s,pg·mL-1)
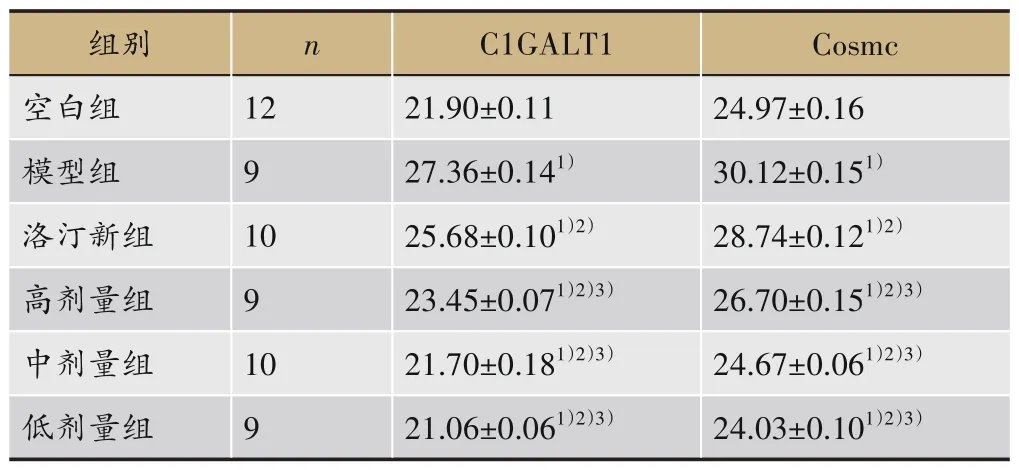
表4 各组大鼠给药后外周血C1GALT1及Cosmc mRNA表达((±s,pg·mL-1)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与洛丁新组比较,3)P<0.01。
Cosmc 24.97±0.16 30.12±0.151)28.74±0.121)2)26.70±0.151)2)3)24.67±0.061)2)3)24.03±0.101)2)3)组别空白组模型组洛汀新组高剂量组中剂量组低剂量组n 12 9 10 9 10 9 C1GALT1 21.90±0.11 27.36±0.141)25.68±0.101)2)23.45±0.071)2)3)21.70±0.181)2)3)21.06±0.061)2)3)
3.6 补肾利咽方对IgA 肾病大鼠血清TLR4、NF-κB、IL-6含量的影响
表5 表明:与空白组比较,模型组大鼠血清TLR4、NF-κB、IL-6 明显升高(P<0.05)。与模型组对比,洛丁新组及补肾利咽方组TLR4、NF-κB、IL-6 的表达明显减少(P<0.05)。与洛丁新组比较,补肾利咽方组TLR4、NF-κB、IL-6减少(P<0.05)。
表5 各组大鼠给药后血清TLR4、NF-κB、IL-6含量(±s,pg·mL-1)
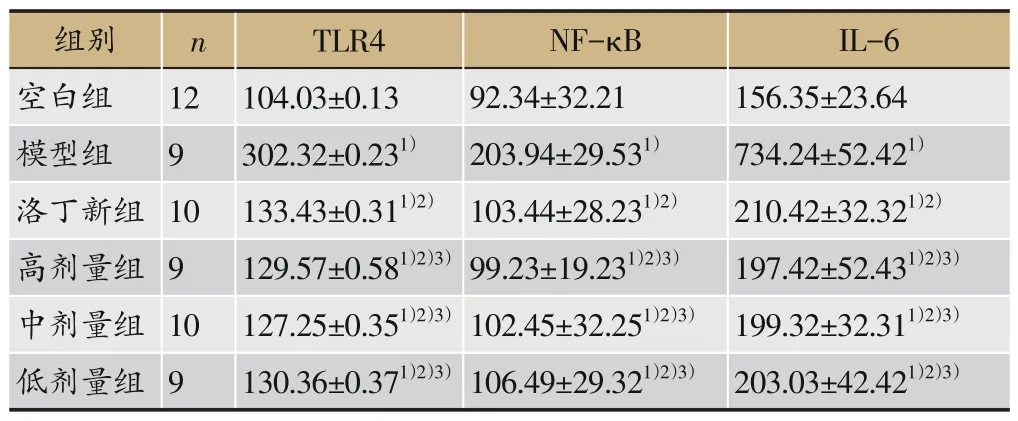
表5 各组大鼠给药后血清TLR4、NF-κB、IL-6含量(±s,pg·mL-1)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与洛丁新组比较,3)P<0.01。
IL-6 156.35±23.64 734.24±52.421)210.42±32.321)2)197.42±52.431)2)3)199.32±32.311)2)3)203.03±42.421)2)3)组别空白组模型组洛丁新组高剂量组中剂量组低剂量组n 12 9 10 9 10 9 TLR4 104.03±0.13 302.32±0.231)133.43±0.311)2)129.57±0.581)2)3)127.25±0.351)2)3)130.36±0.371)2)3)NF-κB 92.34±32.21 203.94±29.531)103.44±28.231)2)99.23±19.231)2)3)102.45±32.251)2)3)106.49±29.321)2)3)
4 讨论
沉积在肾小球系膜区的IgA以IgA1和异常糖基化的IgA1聚合体形成的免疫复合物为主,主要来源于黏膜分泌系统,黏膜(包括扁桃体)感染所致的免疫功能紊乱、IgA1 分子糖基化的异常是导致IgA 肾病发病的重要机制[15]。
越来越多研究证明,抗原(细菌、病毒或食物等)侵袭扁桃体后,黏膜组织产生抗体及免疫反应,从而引起IgA 的沉积[15-17]。黏膜感染可使TNF-α、IL-6 升高,诱发IgA1 分子糖基化异常,也可使扁桃体淋巴细胞产生人半乳糖缺乏IgA1 增多[18]。黏膜感染后,病原微生物相关分子模式被跨膜蛋白Toll 样受体家族(TLRs)识别,而激活并能诱导特异性免疫应答,介导信号转导引起炎症反应,引起IgAN。TLR4 可识别革兰阴性细菌脂多糖(LPS),黏膜感染时脂多糖可激活TLR4,通过MyD88 依赖途径及非MyD88 依赖途径引起细胞内信号转导,进而激活NF-κB 等引起炎症反应[19-21],从而引起系膜细胞损伤。而异常糖基化的IgA1 免疫复合物与IgAN 病情进展密切相关,其血清水平高预示不良预后[22-23]。IgA1 的糖基化修饰过程中,C1GalT1 在特异性分子伴侣Cosmc 的辅助下,将半乳糖(Gal)转移至IgA1 的乙酰半乳糖胺残基上,若C1GalT1 及Cosmc 异常,可导致异常糖基化的IgA1 增多[24]。在C1GalT1 等关键酶的调节过程中,黏膜感染、多种细胞因子等起到重要作用[25-27]。在肾小球系膜区,异常糖基化的IgA1 为主的免疫复合物沉积,释放细胞因子以及炎症驱化因子,如MCP-1 等,使系膜细胞增殖,细胞外基质过量合成,对肾脏造成损伤,同时进一步加重IgA1的异常糖基化,形成恶性循环。
国医大师任继学教授指出IgA 肾病的病机关键在肾虚脾亏,而咽喉是IgA 肾病发病之源。咽在喉后,主纳食,胃之系也;喉在咽前,主气出入,为肺之系也。胃、肾、肝三脉循喉。任脉至咽喉。咽喉与肾之间的关系非常密切。因此,外邪侵淫,由咽喉及肺,瘀毒内生,由经络而侵及肾脏;若肾气不足,卫外不固,邪毒外侵,容易侵及咽喉,形成咽喉→肺→肾的恶性循环。因此,IgA肾病的发病及进展与咽喉关系密切。
任老认为,生地黄滋阴养肾,清热凉血,黄芪补气健脾,两药共用补肾阴,健脾气,共为君药;金荞麦为治疗咽喉肿痛之要药,可清热解毒、健脾利湿;马勃利咽、清热、止血,共为臣药,解毒利咽清其源。紫荆皮活血通经、解毒消肿;木蝴蝶能清肺利咽,可治疗喉痹、喑哑;共为佐使药。再配合补肾、利咽、化湿、通络药物,全方补肾健脾,解毒利咽。用于治疗IgA 肾病,一方面补肾健脾以补益先天、后天之本,治本增强机体抗邪能力;另一方面解毒利咽,治标从而截断致病之源。
本研究应用补肾利咽方治疗IgA 肾病模型大鼠,与模型组比较,补肾利咽方组尿RBC、UTP 均明显减少,随给药时间延长,尿RBC、UTP 减少更为明显(P<0.05),说明补肾利咽方可明显减少IgA 肾病模型大鼠的血尿、蛋白尿。补肾利咽方对肾功能无明显影响,可能原因为各组大鼠肾功能都基本正常,所有未见明显统计学差异。与模型组比较,补肾利咽方组大鼠肾组织TLR4、MyD88、NF-κB、MCP-1 下降(P<0.05),外周血C1GALT1、Cosmc mRNA 的表达降低(P<0.05),血清TLR4、NF-κB、IL-6的表达明显减少(P<0.05),说明补肾利咽方可改善黏膜感染诱发的TLR4 信号转导系统介导的免疫反应,调整IgA1糖基化过程中的关键酶C1GalT1 及分子伴侣Cosmc,减少异常糖基化的IgA1,从而减少其在肾小球系膜区沉积,减轻肾损伤,为IgA肾病的治疗提供实验研究证据。

