生脉方化学成分及分析方法研究进展*
钱紫萱,孙雪杨,张辰明,刘龙婵,李林楠**,张皓月,杨 莉,3,王峥涛,3**
(1.上海中医药大学中药研究所/中药标准化教育部重点实验室/国家中医药管理局中药新资源与质量评价重点实验室/上海市复方中药重点实验室 上海 201203;2.上海中医药大学中药学院 上海 201203;3.上海中药标准化研究中心 上海 201203)
经典名方生脉方由人参、麦冬和五味子三味中药配伍组成,是中药益气养阴生津的代表方。该方最早见于金代张元素的《医学启源》,“麦门冬,气寒,味微苦甘,治肺中伏火,脉气欲绝,加五味子、人参二味,为生脉散,补肺中元气不足”。方名“生脉”体现了其可“除沉疴、定回生”,“补肺中元气不足”,用于治疗气阴两亏,心悸气短,暑热汗多等[1]。根据组成不同,生脉方有人参方、党参方之别,而人参方区分白参方(生晒参)与红参方。近代又相继研制出生脉饮、生脉颗粒、生脉袋泡茶、生脉胶囊、生脉注射液等剂型。这些制剂的制备工艺差别很大,有传统煎煮,如生脉散(汤剂);有直接打粉,如生脉袋泡茶;有乙醇渗漉,如生脉饮(口服液)、生脉胶囊、注射剂(生脉注射液、注射用益气复脉(冻干))等。上述制剂虽处方相同,但工艺流程不同,质量标准也参差不齐,大多数仅规定检查了人参或五味子一种药味的1 或2 个成分,导致最终产品中有效成分含量存在差异,难以保证临床用药的有效性和安全性(表1)。

表1 生脉方制剂的组方、制备工艺、定性鉴别和含量测定
本文通过以“生脉”、“复方化学成分、含量、测定”、“质量控制、指纹图谱”等为关键词检索中国知网(CNKI)、PubMed、Web of Science(WOS)等国内外主流数据库2010-2022 年的相关文献(截止时间2022 年6 月),总结生脉方作为复方制剂的化学成分、质量标准及其分析方法,希望给经典名方的研究、开发和应用提供参考依据。
1 化学成分
生脉方由人参、五味子、麦冬三味药组成。对复方的化学成分研究显示,生脉方中包含多种皂苷、木脂素、黄酮类化合物,其中许多成分具有显著药理活性。王厚恩等[2]曾对生脉方化学成分进行了详细总结,归纳了55 种人参皂苷、41种木脂素、7种麦冬皂苷、14种高异黄酮和7种其他类型化合物及其结构。本文在此基础上进一步总结了2019-2022 年间新发现的化学成分[3],并补充完善了其中皂苷类成分的化学结构[4]。
1.1 皂苷类成分
1.1.1 人参皂苷
皂苷类化合物是生脉方中含量最高的成分,主要来自人参,少部分来自麦冬。其中人参皂苷主要包括达玛烷型三萜皂苷,是生脉方的主要活性成分。目前生脉方中的人参皂苷类型包括原人参三醇型(Protopanaxatriol type,PPT)、原 人 参 二 醇 型(Protopanaxadiol type,PPD)皂苷、齐墩果酸型人参皂苷(Olenolic acid)、C-17 侧链型皂苷(C-17 side chain)及其他皂苷[5-6]。近年新发现的人参皂苷类成分以PPT型皂苷为主,其化学结构总结如下(图1,表2)。
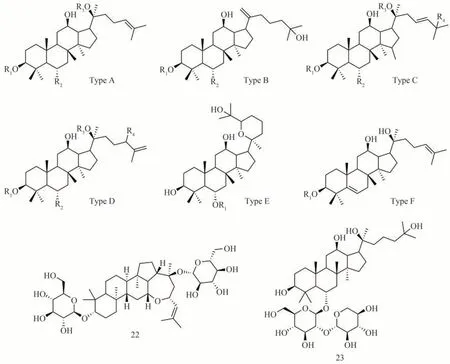
图1 生脉方中的人参皂苷化合物结构
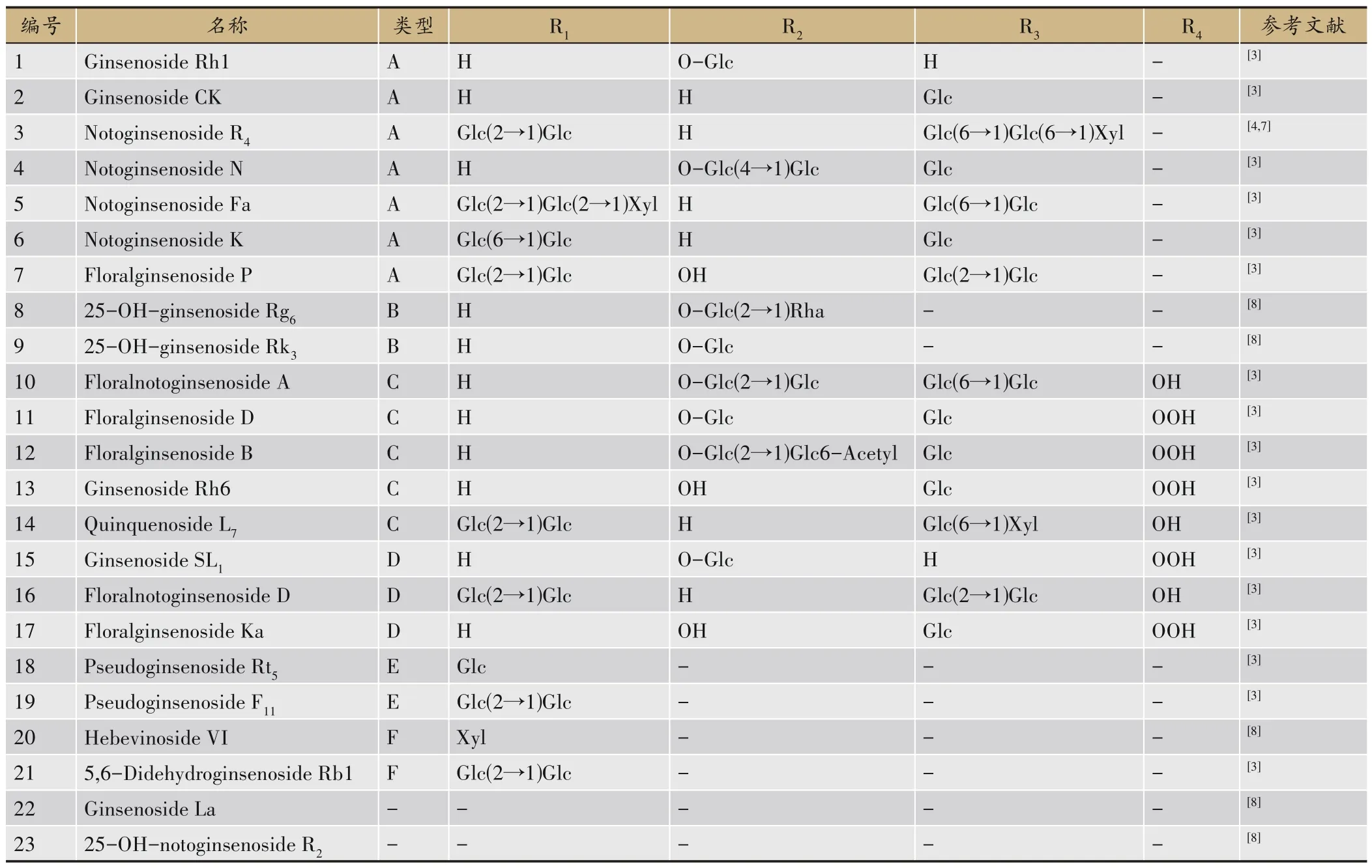
表2 生脉方中的人参皂苷类化合物
1.1.2 麦冬皂苷
目前生脉方中共鉴定到13 种来源于麦冬的皂苷成分(图2,表3),大部分属于甾体皂苷,王厚恩等[2]总结了其中7种。其结构类型主要为螺甾烷醇型[9],皂苷元大多数为鲁斯可皂苷元。近年又鉴定得到多种麦冬皂苷成分,其结构总结如下(表3)。
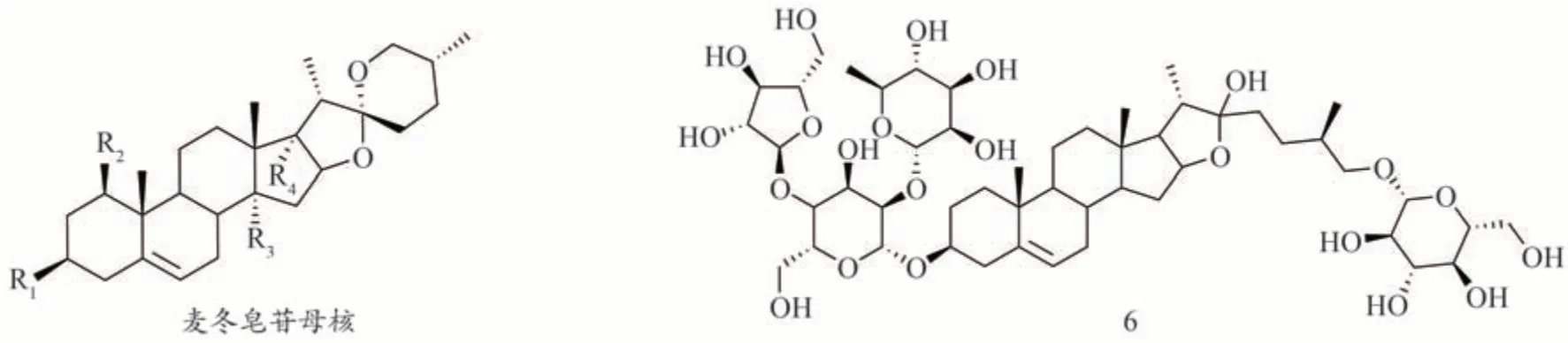
图2 生脉方中麦冬皂苷类成分的结构
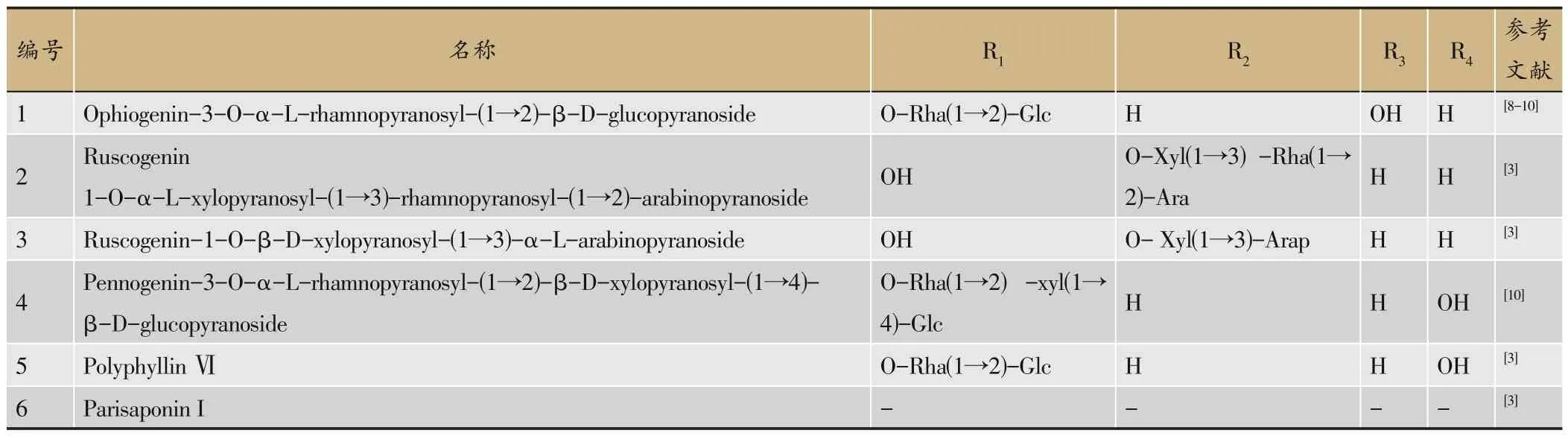
表3 生脉方中的麦冬皂苷类化合物
1.2 其他化学成分
除皂苷类成分外,生脉方中鉴定得到类型丰富的木脂素化合物和高异黄酮化合物。木脂素类成分主要来源于五味子,代表性成分包括五味子醇甲(Schizandrol A)、五味子醇乙(Schizandrol B)、五味子甲素(Schisandrin A)等[11]。高异黄酮类成分在植物中较为少见,主要分布在百合科沿阶草属Ophiopogon中[12],生脉方中鉴定得到的黄酮类化合物均来自麦冬。生脉方中的其他结构类型的化学成分的研究也有相关文献报道,包括L-borneol-7-O-[β-D-apiofuranosyl(1→6)]-β-D-glucopyranoside[4,10]、Isoheptanol 2-(S)-Oβ-D-xylopyranosyl-(1→6)-O-β-D-glucopyranoside[3]、5-Hydroxymethylfurfural (5-HMF)[10]、 4-allyl-1, 2-benzenediol1-O-α-L-rhamnpyranosyl(1→6)-O-β-Dglucopyranoside[4]、citronellol[4]等。此外,刘瑞等[13]检测了生脉注射液中的琥珀酸、苹果酸、柠檬酸等有机酸成分;聂黎行等[14]对生脉注射液中的氨基酸进行检测,确定含有门冬氨酸、苏氨酸等16种氨基酸成分。
2 复方化学成分变化
中药复方与单味药的作用存在显著差异。经过配伍或煎煮后,中药复方的化学成分可能发生改变。研究复方配伍煎煮过程中的化学成分之间的相互作用与单味药材化学成分的变化关系是阐明复方配伍化学效应的必要研究内容。
2.1 煎煮和提取过程中化学成分的转化
大量学者对生脉散复方化学成分进行了深入研究[15-18]。结果显示,生脉散经水煎煮后生成5-羟甲基糠醛(5-HMF),人参、麦冬、五味子在煎煮前均不含5-HMF,仅五味子单煎后能产生少量的5-HMF,而生脉散全方和麦冬五味子共煎液中5-HMF 的含量显著增高[16]。后续研究表明,5-HMF 的形成可能与五味子的酸性有关,其含量随麦冬用量的增加而升高[15]。研究显示5-HMF作为中药注射剂安全性评价的一部分,其本身及其降解产物都可能导致不良反应的发生,对其进行动态监测具有现实意义[19]。
中药复方多味药材在共同煎煮的过程中化学成分可能相互影响,发生变化。共煎过程中人参皂苷受五味子的酸性成分影响,达玛烷型人参皂苷的C-20位糖苷键水解发生水解转化;人参皂苷Rg、Rh1、Rh2等含量明显增加,由微量成分转化为主要成分[17]。复方中除五味子可对人参皂苷成分产生影响外,皂苷类化合物也可影响五味子的主要成分五味子醇甲的煎出。岳磊等[18]测定生脉散中全方及各配伍组五味子醇甲的含量,发现人参、麦冬、人参总皂苷、人参皂苷Rg1与五味子合煎均能提高五味子醇甲的含量。王庆慧[20]在生脉饮中五味子对麦冬化学成分的影响研究中发现,Methyl ophiopogonanone A 在麦冬、五味子复方中的含量降低,而Methyl ophiopogonanone B 在麦冬、五味子复方中的含量升高。
2.2 体内代谢转化
生脉方中鉴定得到了多种化合物,揭示了生脉方药效的物质基础。而化合物只有在进入体内后才能发挥药效,另外部分化学成分需要经人体代谢以代谢物的形式发挥药效作用。生脉方各成分在体内的代谢转化方式不同。Wang 等[9]从口服生脉散的大鼠血浆中鉴定得到多种化学成分的代谢产物,通过对比生脉散提取物和血浆成分的结果发现,血浆中出现了11 种新成分,是源于原型化合物的体内代谢物,除一种成分来自PPD 型人参皂苷,其他化合物均由木脂素schizandrol A 代谢而来,包括7, 8-dihydroxy-2-demethyl-schizandrin 和 7, 8-dihydroxy-3-demethylschizandrin 及其异构体、7,8-dihydroxy-schizandrin、7,8-dihydroxy-3-demethyl-schizandrin、7, 8-dihydroxy-2-demethyl-schizandrin、以及schizandrol A 的去甲基化代谢物。Zhan等[21]较为全面地研究了大鼠静脉注射生脉注射液后体内PPD 型和PPT 型人参皂苷、麦冬皂苷D 的代谢情况。PPT 型人参皂苷快速通过胆汁、尿液和粪便消除;而PPD 人参皂苷从在胆汁、尿液中呈缓慢消除;麦冬皂苷D 则以次级代谢产物的形式消除。
中药配伍后往往能产生一种或几种原单味药所不具备的效能。研究复方化学成分以及成分转化的规律能从本质上揭示中药复方药理作用的物质基础[22]。但目前针对生脉方复方化学成分变化和变化规律的研究较为缺乏,上述变化对生脉方药效的影响仍需更深入的研究。
3 生脉方成方制剂的分析方法
以经典名方为代表的中药成方制剂的质量控制已成为中药研究的重点和难点。目前已有较多研究报道关于人参、麦冬、五味子中化学成分的理化分析方法,如采用薄层色谱法(TLC)、气相色谱法(GC)、高效液相色谱法(HPLC)等对人参皂苷、麦冬皂苷、五味子木脂素进行定性、定量分析。但生脉方制剂过程中各有效成分易发生反应相互作用,仅以单一指标成分的含量作为评价指标,无法全面表征成方制剂的质量。因此建立有效检测多指标成分的分析方法,全面进行制剂质量评价,已成为生脉方质量控制的研究热点。目前最为常用的检测方法是液质联用分析(LCMS)和气质联用分析(GC-MS)等。此外,一些快速测定生脉方制剂中化合物的方法,如红外光谱法(IR)、紫外-可见分光光度法(UV-Vis)、毛细管电泳法(CE)等也有应用。本文系统总结了近年来关于生脉方及其制剂的分析方法,以期为其质量控制、成分分析以及合理应用提供基础(表4-7)。
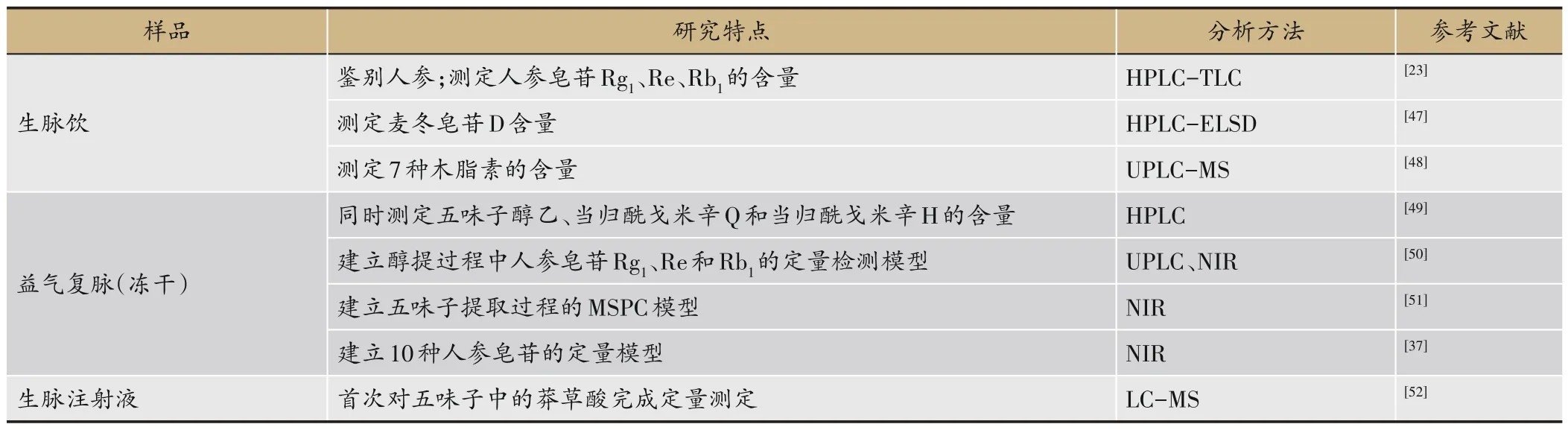
表4 生脉制剂中单一药味的分析方法研究进展

表5 生脉口服制剂中多成分的分析方法研究进展

表6 生脉注射制剂中多成分的LC-MS分析方法研究进展
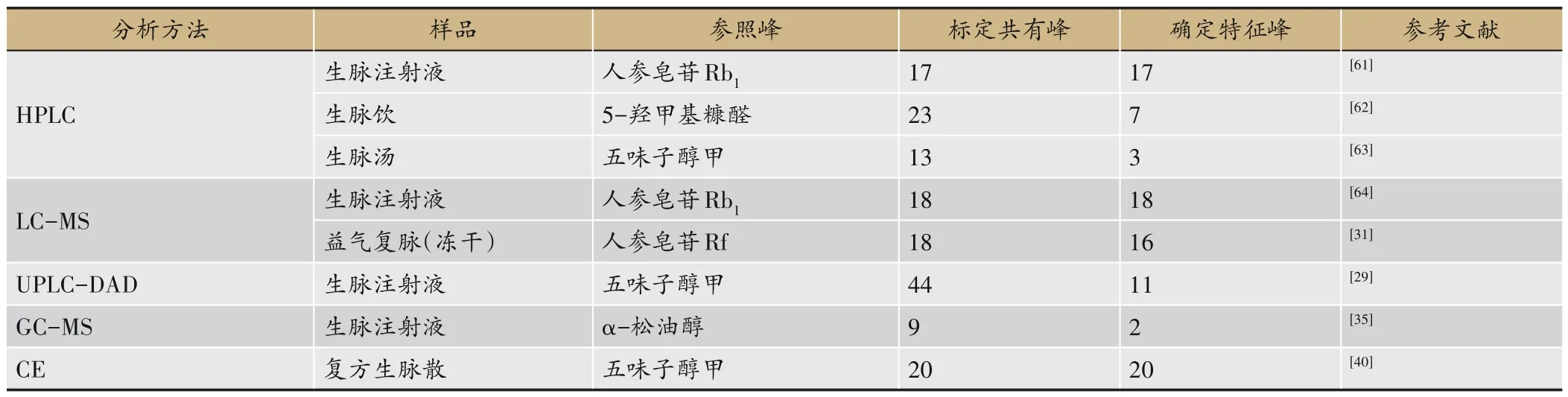
表7 生脉制剂的指纹图谱分析方法研究进展
3.1 薄层色谱法
《中国药典》(2020 年版,一部)采用TLC 法对生脉饮中的红参、麦冬、五味子进行定性鉴别;对生脉胶囊,同样采用了TLC 法定性鉴别红参、麦冬、五味子3 味药材。文惠玲等[23]用TLC 鉴别了生脉饮超微提取物中的人参二醇和人参三醇,并对比了高压差法和渗漉法,发现高压差法提取得到种类更丰富,含量更高的人参皂苷。高效薄层色谱法(HPTLC)能显著提高薄层板的分离能力[24],故Xie等[25]采用HPTLC对11个厂家的生脉胶囊和颗粒的样品进行分析,发现在加工过程中人参皂苷Rb1、Re和Rg1等药效成分发生明显降解。
3.2 高效液相色谱法和液质联用法
HPLC 广泛应用于中药的特征图谱、指纹图谱分析及主要成分的含量测定。《中国药典》(2020 年版,一部)规定生脉饮的HPLC 定量测定以五味子醇甲作为对照品,对其他有效成分未做要求;规定用HPLC 法对生脉胶囊进行含量测定时,仅对制剂中的人参皂苷Rg1和Re做含量要求。目前药典方法对生脉制剂的质量缺乏全面整体的控制。
色谱法与其他技术联用被广泛用于表征生脉方中的特征性成分,以及同时测定多种成分的含量。蒸发光散射检测器(ELSD)作为通用检测器,其信号响应只与待测物的质量有关,与待测物的光学特性无关,对无紫外吸收或仅有紫外末端吸收的物质如糖类[26]、皂苷类[27]、甾类等均有较好响应。苗圃等[28]建立了HPLC-ELSD 联用的方法,检测了生脉注射液中果糖、葡萄糖、蔗糖和麦芽糖等成分。与传统HPLC 法对比,超高效液相色谱(UPLC)在分离效果和检测时间等指标均有显著提升。柴瑞平等[29]采用UPLC-DAD 法建立了生脉注射液中多成分的定量方法,结合中药色谱指纹图谱相似度评价系统标定了44 个共有峰,在35 min内检测到11种活性成分的含量。
近年来,LC-MS 凭借其分离选择性好、灵敏度高、能给出复杂样品中化合物成分结构信息等优势,而被广泛用作生脉制剂中多种成分群的鉴别。Wu 等[8]采用UPLC-MS 法,在14 min 内获得生脉散的质谱信息,鉴定了92 个化合物,主要为皂苷和木脂素类成分,并在生脉散中首次发现25-羟基人参皂苷类成分。Li 等[4]对生脉注射液进行分析,初步鉴定了62 个化合物,同时定量分析了其中21种成分的含量。
利用四级杆串联飞行时间质谱(Q-TOF-MS)可满足质量分辨率高、定性准确的分析要求。王若柳等[30]采用LC-IT-MS 检测到参麦注射液中的74 个化合物,再按照LC-QTOF-MS 提供的信息,推测鉴定出其中的64 个化合物,其中大部分化合物来源于红参,而来源于麦冬的化合物较少。褚延斌等[31]首次建立了益气复脉(冻干)的UPLC-Q-TOF-MSE指纹图谱,利用QTOF-MSE得到化合物的相对分子质量、质谱碎片离子信息后,结合参考文献及对照品信息,指认了16 个共有色谱峰,为制剂的整体质量评价提供科学依据。
基于诊断片段的扩展策略(DFIBES),可以将复杂的色谱峰快速分类到已知的化学家族中,从而简化结构鉴定的复杂程序。考虑到某个化合物家族如人参皂苷和木脂素,通常会产生相同的碎片离子,Zheng等[7]提出了一种改良的DFIBES 方法,能够有效处理质谱获得的信息,并对生脉注射液中的30 多种皂苷类和20 种木脂素类化合物加以鉴定。针对生脉制剂成分复杂,分离难度大,对照品紧缺和检测成本高等诸多问题,一测多评法(QAMS)与HPLC 联用可实现多成分的质量控制,降低检测成本。梁悦等[32]使用QAMS 并以人参皂苷Rb1为内标,同时测定多个成分的含量,建立HPLC 特征图谱,对生脉注射液中的各药材同时进行定性、定量控制。李佳寅等[33]采用HPLC联合QAMS法对生脉注射液中的人参皂苷和木脂素类成分开展多指标定量分析,选择人参皂苷Rb1作为对照品,节约了检测成本。
3.3 气相色谱法
目前气相色谱法用于生脉方的研究较少,对于五味子挥发性成分的鉴别具有较高的应用价值,文献多采用水蒸气蒸馏法提取[34]。为了避免水蒸气在GC 分析过程中对色谱柱的影响,吴建国等[35]采用固相萃取法与GC-MS 相结合的方法建立五味子挥发性成分的9个特征峰的指纹图,并指认了其中最大的2个峰分别为α-松油醇和4-萜品醇。聂黎行等[14]以生脉注射液中的单体成分群为切入点,对糖类、氨基酸类、皂苷类、有机酸类化学成分进行了表征,通过GC-MS 法确定了糖类的主要组成成分,通过高效离子交换色谱-柱后衍生化技术确定了结合及游离氨基酸的种类,并利用分子排阻色谱结合ELSD 对大分子物质的检测做了初探。
3.4 红外光谱法
红外指纹图谱是由化合物中化学键振动转动而产生的特征信息,具有特征性和指纹性,在中药材鉴别分析中有着重要的运用。赵杨等[36]通过傅里叶红外光谱色谱结合液质联用技术分析了生脉饮中的皂苷类成分。韩晓萍等[37]采用近红外光谱法快速测定注射用益气复脉(冻干)中人参皂苷的总量,建立了10种人参皂苷含量的定量模型,预测值与测定值的相关系数高达0.953,可用于大批量样品的快速测定。
3.5 紫外-可见分光光度法
基于UV-Vis 的分析方法是待测物分子对光的选择性吸收而建立的全波长扫描技术,更能全面反映样品中不饱和化学键的特征规律信息,在实际应用中有着样品前处理简单、分析时间短、检测成本低等特点。孙宁[38]采用香草醛比色法对生脉饮中的人参总皂苷含量进行测定,再利用高氯酸法对生脉饮中的总皂苷含量进行测定,确定了测量结果后建立换算系数法,从而计算得到麦冬总皂苷的含量。梁悦等[39]通过红外光谱仪辅助紫外指纹图谱对生脉注射液进行质量控制,发现不同批次样品间质量差异较大,较单一成分定量测定更能全面反映整体情况,但是该实验收集到的样本量较少,有待进一步研究。
3.6 毛细管电泳法
CE法是以高压电场为驱动力,以毛细管为分离通道的一种分离技术,以其高效、快速、成本低等优点被广泛应用。当生脉散提取液用HPLC 分析时,一些色谱峰较难分离。此外,在样品预处理如固相萃取和液-液萃取时,也会损失一些有效成分。季一兵等[40]采用序贯式均匀设计的方法优化CE 分离条件,确认了中药复方生脉散中20个主要的共有指纹峰。Fan 等[41]使用了胶束电动力学毛细管色谱模式来建立生脉散的指纹图谱。采用正交设计和顺序统一设计来筛选重要参数和优化分离条件。方法验证包括注射精度、样品稳定性测试和稳健性测试。此外,基于回归分析的建模方法被应用于与所提出的优化方法的比较,该方法为中药材的指纹开发提供了新的思路。
3.7 其他分析方法
凝胶渗透色谱(GPC)是通过多孔性的凝胶分离大分子的方法。由于生脉制剂中除了皂苷类和木脂素类等主要活性成分,还存在如蛋白质、糖、鞣质等大分子,作为中药注射制剂时存在一定的安全隐患[42],建立GPC 分离方法可有效除去某些大分子对制剂临床使用的不利影响。彭菲等[43]进一步优化开发了GPCELSD 法并对注射用益气复脉(冻干)中可能存在的糖苷类大分子进行检查。
Q-标志物(Q-marker)是为中药制品的质量评估和生产过程控制而设计的,具有传递性和可追溯性[44]。Zhao 等[45]建立了UPLC-DAD 和HPLC-ELSD 联用技术来分析生脉注射液中Q-marker 的含量。该研究首先利用UPLC-QTOF-MSE 定性鉴别出了生脉注射液中的87种化学成分。通过追踪主要化学成分并结合“蜘蛛网”模式的全面评估,筛选出了6 种化学物质作为Q-markers。Zheng 等[46]首次尝试通过结合化学和生物活性的一致性来评估生脉方整体质量一致性。通过指纹图谱-药效关系分析发现了代表生脉方药效的成分,并作为进一步控制生脉方批次间有效一致性的标志物。
综上所述,生脉方成方制剂的分析方法目前已取得一定进展,但由于中药复方化学成分的复杂性以及存在配伍转化、体内外代谢变化等情况,结合临床疗效研究,更加全面、准确的解析其功效物质基础,并建立科学、合理、先进的质量评价体系仍然是今后一段时期亟待解决的问题。
4 总结和展望
生脉方作为经典名方沿用至今,随着目前对其化学成分分析和药理研究的不断深入,生脉方的主要活性成分及其作用机制等已得到初步的阐明。但现阶段对生脉方中活性成分的研究仍然以皂苷类和木脂素类化合物为主,对于高异黄酮成分的研究相对缺乏。此外,在量-效关系,以及潜在毒性等方面的研究较少。从质量评价的角度,单用薄层色谱法或气相色谱法对于质量控制效果不佳,为了整体分析生脉成方制剂,分析方法以高效液相色谱法与质谱联用为主,可同时满足定性和定量需求。
生脉方及其成方制剂充分体现了中药多成分多靶点的特点,对其进行系统性的归纳总结可为经典名方的后期开发利用及质量评价提供理论依据。从目前研究的剂型来看,生脉注射剂的相关研究最多,质量控制也相对严格,其次是生脉饮。虽然制剂种类繁多,但是少有研究关注到不同剂型间差异,而目前仅聚焦于单味药物的研究难以反映不同剂型间的差异。如根据组成药物的不同,生脉方成方制剂有人参方和党参方之别,但是关于此二者的化学成分对比、药理活性对比、指纹图谱对比等研究较少。另外,仅靠单一成分分析和指纹图谱研究,也很难反映不同剂型间的差异。若是能以多种共有成分作为参照,在此基础上建立不同剂型的指纹图谱,能够直观准确地比较生脉系列不同剂型间成分的含量区别。后续对于生脉方的研究逐渐科学和完善,有利于在国家推进中医药传承创新背景下,加快对含有经典名方的新药及大健康产品的持续开发和应用。

