感染坏死性胰腺炎一例诊治分析
卢汉原,陈家诚,陈良,罗相相,陈骋,许达峰,武金才,周开伦
1.海南医学院附属海南医院/海南省人民医院 胆胰外科,海南 海口 570311;2.海南省肿瘤医院 肝胆胰外科二区,海南 海口 570311
感染坏死性胰腺炎(infected necrotizing pancreatitis,INP)的定义是“在急性胰腺炎发病后的前14 d,通过细针穿刺抽吸到的标本进行革兰氏染色或培养出阳性菌,或者对比增强计算机断层扫描(contrast-enhanced computed tomography,CECT)的胰腺和胰腺周围坏死中存在有气体”[1]。INP的病死率极高,其外科干预时机及策略的选择目前仍具有争议[2]。本文报道1例INP诊治经过,并结合文献探讨诊治策略,供临床参考。
1 病例资料
患者男性,35岁,因“间断性上腹部疼痛17 d”于2022 年4 月22 日收入海南省人民医院。患者于2022年4月5日晨起时无明显诱因突发上腹部疼痛,呈持续性,伴有腹胀、恶心、呕吐,呕吐物为胃内容物,呈非喷射性,无腹泻、反酸、畏寒发热、胸闷胸痛等不适。于儋州当地医院行腹部CT检查提示:胰腺水肿胰周渗出,考虑“急性胰腺炎”,予止痛、抗感染等治疗,疗效欠佳;2022年4月6日转院至海口一家三甲医院进一步治疗,诊断为“重症急性胰腺炎”,予禁食、胃肠减压、镇静镇痛、液体复苏、抗感染及血透治疗,疗效仍欠佳,遂转入海南省人民医院进一步治疗。
入院时查体:清醒状态,腹部稍膨隆,触软,全腹有压痛、反跳痛,全腹部未见胃肠型及蠕动波,肝脾肋下未触及,左侧肋下见胰腺引流管1 根,移动性浊音阴性,肠鸣音4 次/min。入院前已经连续3 d无尿状态。入院后指标检验检查:最高时白细胞数26.5×109/L,占92.7%;C反应蛋白70.83 mg/L;白介素-6 30.03 ng/L;血清淀粉酶111.00 U/L,脂肪酶302.20 U/L;引流液淀粉酶99.70 U/L,脂肪酶279.40 U/L。腹部彩超检查:胰腺上方低弱回声(范围14.9 cm×9.8 cm×13.2 cm)积液;双侧结肠旁沟低弱回声区(左侧范围23.7 cm×4.9 cm,右侧范围19.8 cm×4.3 cm)积液;胆囊体积增大并腔内胆泥淤积。腹部CT检查(图1):胰腺稍肿大,强化欠均,周围见大量渗出,以胰胃间隙为主,累及双侧结肠旁沟、左侧肾后间隙,向下延伸至左侧盆腔。

图1 患者入院时腹部CT检查
入院后予以加强引流,复查腹部彩超及CT提示胰腺渗出较院外治疗时增多,为通畅引流胰腺渗出,遂于胰周、右肾前胰头钩突下方经超声引导下穿刺置管(20 F双套管)引流,置管后胰腺渗出情况及置管位置如图2所示。

图2 患者行超声引导下腹腔穿刺置管引流后胰腺渗出情况及置管位置
在海南省人民医院予以置管+冲洗后引流效果欠佳,经过重症医学科、肝胆胰外科、消化内科、营养科、影像科、感染科会诊,考虑再增加置管引流和冲洗效果预计仍欠佳。按照指南行升阶梯治疗,消化内镜方面,一是上消化道破口设备局限,二是坏死病灶范围较广,可能需要反复多次全麻和手术操作,对患者的总体打击可能更大;腹腔镜方面,主要考虑患者胰腺坏死感染后导致腹腔粘连严重,操作空间狭小,难度大;硬镜清创方面,一是视野的局限,二是预计需要3~5个入路,而且对于术中出现的活动性出血处理比较棘手;而开腹清创手术虽然对患者的创伤打击程度及病死率较前三者要高,但其对坏死感染清创效果更佳,针对术中出血的处理也有着其优势。
经过多学科治疗(MDT)讨论后决定行开腹清创引流,于入院后第10 天在全麻下行剖腹探查+胰腺周围坏死病灶清创+腹腔脓肿双腔管引流+肠粘连松解术,术中可见腹腔多个部位内大量脓液,伴少许淡红腹水,大网膜包裹呈块状隆起,小肠粘连。打开胃结肠韧带可见小网膜囊腔内大量血块及粉红色和白色的混合坏死组织,胰腺质硬,局部坏死。左侧结肠旁沟粘连明显,打开侧腹膜亦可见大量血块及坏死组织(不打开横结肠下区的空回肠腔)。余未见明显异常。予以大量温盐水反复冲洗+少量双氧水冲洗腹腔,于空肠远端留置12 F胃管作空肠营养管并引出左侧腹壁,置入约60 cm,小肠戳口处作包埋及隧道。再次冲洗腹腔后,检查术野无活动性出血,于左结肠旁沟处留置3根20 F双腔引流管,其中一根经肾前、胰尾前隧道贯穿至左膈下最低处。小网膜囊和胰头、钩突区留置3根20 F双腔引流管,盆腔留置1根18 F单腔引流管。
术后经积极冲洗引流、适时更换双腔引流管,抗生素降阶梯治疗和加强营养等治疗后,患者情况较前好转,术后第7天由重症监护室转回普通病房并下床活动,正常进食,自行排便,逐步予以拔除引流管。出院前复查腹部CT(图3)所示:胰腺周围渗出基本消失,双侧结肠旁沟及盆腔未见明显积液。患者于2022 年7 月12日带有腹腔和腹膜后引流管各1条出院,出院时患者腹痛、发热消失,腹平软,下床正常活动,进普食,正常大小便,引流管仍可见少许脓白色絮状物引出,嘱患者继续行引流管冲洗引流。

图3 患者出院前腹部CT检查
经患者院外积极地进行引流管冲洗引流,引流液干净,未见脓状白色絮状物。复查腹部CT胰腺周围及盆腔未见积液,于2022年8月9日予以拔除引流管处理。拔管后患者恢复良好,未诉腹部不适,正常生活。
2 讨论
一般认为胰腺坏死性感染的聚集形成是急性胰腺炎的晚期事件(>4周)[1]。而临床实践中发现,将近25%的患者在早期(<4周)就出现坏死性感染,并伴随休克、器官功能衰竭等形成第一波死亡高峰期,患者死亡原因可能是胰腺炎的炎症风暴导致的原发性器官功能衰竭或者局部坏死性感染导致的继发性器官功能衰竭[2]。针对INP外科干预时机的决策及不同干预类型之间的比较与选择是治疗过程的重点,也是降低重症急性胰腺炎病死率的关键。外科干预时机及干预类型的不同,也就决定了在不同病情条件下,需要制定个体化的治疗方案。
2.1 干预时机
在第一波死亡高峰期间通过对重要器官组织的高级生命支持、血液净化、肠内营养和高级别有效的抗生素治疗,使坏死性感染的有创性操作(需要全身麻醉的内镜、微创或开腹清创手术)尽量推迟到4周后[2-4]。但是针对临床实践中少数4周内即出现休克、器官功能衰竭等,INP的干预时机仍然是尚未定论的焦点。Trikudanathan等[3]开展的一项研究纳入193例坏死性胰腺炎患者,其中76例接受4周内的早期干预[内镜和(或)经皮导管引流+清创],117例接受4周后标准干预,结果发现4周内的早期干预,虽然并发症没有增加,器官衰竭的改善也与标准组相似,但患者的病死率(13%vs4%,P=0.02)和后续需要的抢救性开腹清创术实施率(7%vs1%,P=0.03)均有所增加。Boxhoorn等[5]针对感染坏死性胰腺炎的研究表明,在综合并发症(死亡率、发病率、内脏穿孔、小肠皮肤瘘、胰皮肤瘘、切口积液或伤口感染)方面,立即干预组(<21 d)没有显示出比延迟干预组(21~35 d)更优,而且延迟干预组接受的干预次数(引流和坏死清除)更少(4.4次vs2.6次)。
所以,INP一经诊断,有创性内镜、微创腹腔镜、硬镜下坏死组织清创尽量于4 周后进行,需要深度麻醉支持的开腹清创则慎重选择。针对临床状态较差、无有效管理策略的患者,可尽早行创伤较小的局麻下置管引流,必要时18~20 F口径的双套管引流和(或)冲洗。经过各种生命支持渡过第一波死亡高峰期,等待坏死性包裹形成后,再针对后期的坏死性感染进行升阶梯的有创干预。结合国内外指南和共识,我们形成基于本中心多学科干预INP的标准操作规程,见图4。
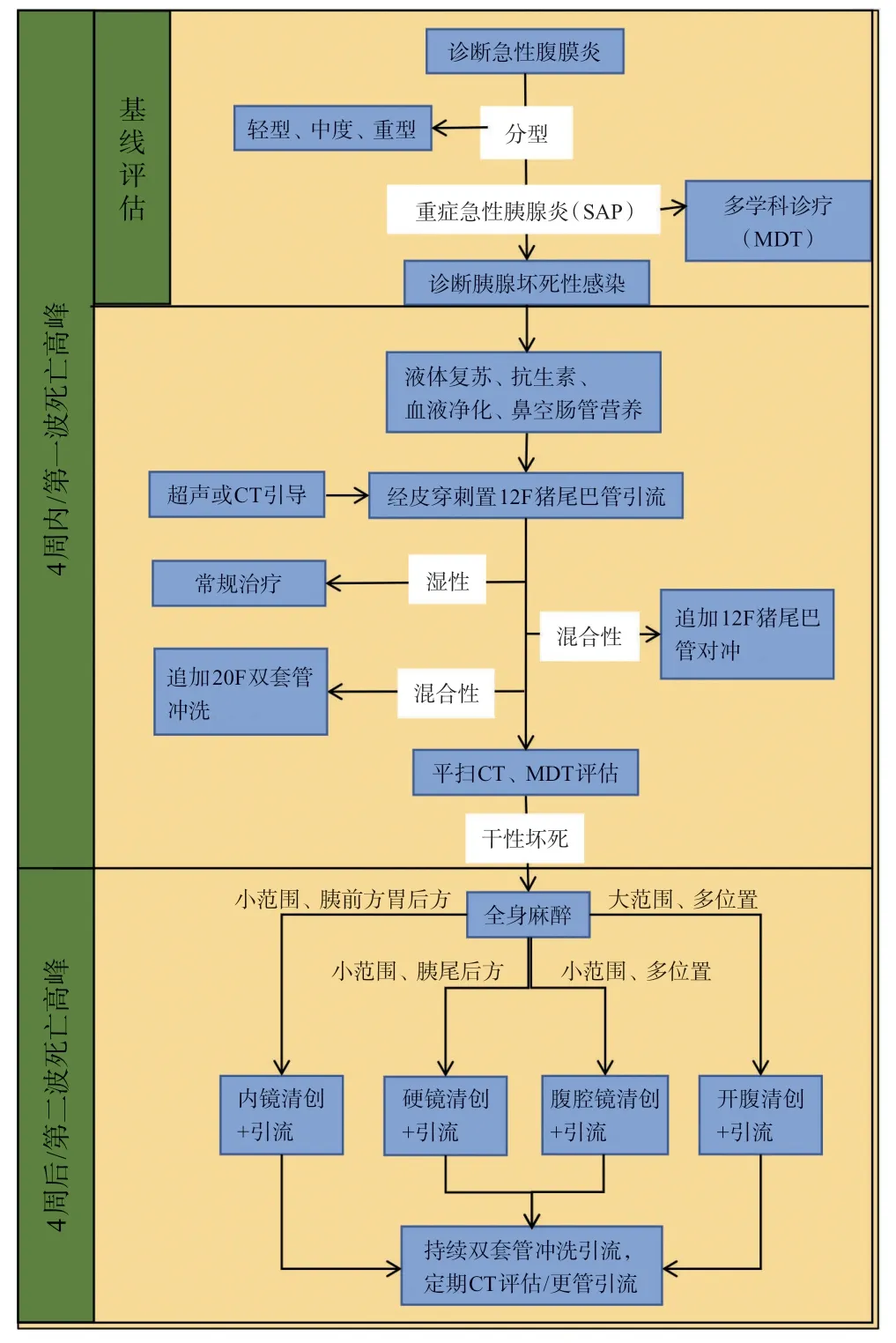
图4 本中心INP的标准操作规程
2.2 开腹清创与内镜或微创入路(腹腔镜或硬镜)清创比较
2002年有研究报道INP的病死率高达50%[6],随着对疾病认识的不断加深(阶梯式外科干预),鼻空肠营养、抗生素药物的进步,血液净化设备和技术的提高,以及肠道菌群移植、中医中药在INP中的应用,包括内镜在内的各种外科清创引流手段的成熟,INP的病死率和总并发症发生率已经分别降至11.2%和64.4%[7]。多项国内外研究均提示内镜或微创入路的INP的升阶梯清创术比开腹清创术在病死率、总体并发症发生率、住院时间、住院成本等方面显示出明显的优势[8-13]。
依据本中心既往经验,结合南京医科大学第一附属医院胰腺中心经验,对于液态为主的INP,单纯的经腹或经内镜引流或者配合大口径双套管冲洗引流即可。而对于少数具有大范围干性块状组织的INP,即使是大口径的双套管,亦是很难有效充分清创和引流。由于内镜或微创清创手术时间长,镜下出血处理困难,有时需重复多次麻醉和手术等原因[9,11],我们针对少数胰周坏死性感染直接跨阶梯治疗,提前采用开腹清创处理。
2.3 内镜清创与微创入路(腹腔镜或硬镜)清创比较
一项针对2014—2017年间66例INP患者的单中心随机对照研究[14]和一项汇总分析[8]表明,内镜递增法(经管引流或坏死清除术)与微创手术(腹腔镜、视频辅助腹腔镜)相比,患者死亡率差异无统计学意义,但前者在重大并发症、住院成本、生活质量方面具有优势。这和2013年荷兰van Brunschot等[15]研究结果类似。但是深入了解这几项研究我们发现,其内镜下的引流清创对于体积较大的病灶有时会需要多次施行,对于两侧结肠旁沟的病灶有时需要事先的经腹置管引流,也就是说从研究设计上可能存在适应证偏倚;另外,内镜下清创引流,对于胃壁或十二指肠壁破口行支架引流或置管引流,尤其是十二指肠,研究中并没有详细交待胆汁、胰液可否从破口外渗到腹腔中,也没有交待后续的破口闭合过程的随访资料等。
结合本中心既往经验及目前国内绝大多数中心的内镜及其配套设备条件,不建议对不紧贴胃或十二指肠壁的病灶进行清创;即使清创,不建议经十二指肠腹侧面破口进行内镜下病灶清创+引流。内镜、腹腔镜或硬镜辅助清创如何选择,需要针对术者及其MDT团队所掌握的技术、疾病的危重程度、该中心的设备和人员于发病当时的可及性等综合考量,经过至少掌握2种干预手段的MDT团队决策出最优方案。无论是开腹、内镜抑或经腹硬镜或腹腔镜干预,手术入路是一个值得探讨的问题。
2.4 手术入路
对于开腹手术切口入路的选择,童智慧等[16]建议尽量不选择腹正中切口,因为会把后腹膜的感染源引到结肠下区腹膜腔。针对小网膜囊或胰头部的坏死性感染,则经胃背侧面上方或十二指肠侧面或背面。切口入路不同各有利弊,有时不应仅从切口的长短去衡量创伤的大小,应总体从麻醉的深度和用药量对于机体的打击、手术时间、因入路选择导致的术中出血的控制、因清创的彻底性导致重复多次手术这些方面来把握整体的“微创性”[17-18]。
2.5 个体化制定治疗策略
依据胰腺坏死性感染病灶的位置(中央型、两侧型或混合型)、累及的范围(少量、中等量和大量)、患者病程所处的时期(4周内、4周以上)、患者的一般身体条件等分层因素,由MDT团队制定个体化方案,应该是INP治疗的最佳选择[13]。即使同样是干性的胰腺坏死性感染灶,也是需要区分目标病灶累及的区域、范围和体积等:如果小范围的干性坏死性感染,经口内镜清创、经腹腔镜或经皮硬镜也是不错的选择,且对患者整体的打击会比开腹清创小;对于大范围的干性坏死,则可直接跨阶梯到大开腹清创,这是一种减少手术和麻醉打击时间、次数的备选方案[10-11]。