室温固相反应助力制备氮硫共掺杂碳限域的FeCoS2复合物用于高性能钠离子电池负极
马文龙 刘桑鑫 周 钺 吴 平 曹 鑫 朱晓舒 魏少华 周益明*,
(1南京师范大学化学与材料科学学院,江苏省新型动力电池重点实验室,南京 210023)
(2南京晓庄学院环境科学学院,南京 211171)
(3南京师范大学分析测试中心,南京 210023)
0 引 言
踏着“双碳”战略的步伐,新能源与电化学储能已迅速成为最引人注目的国家战略性新兴产业。随着新能源市场的不断扩张以及对可持续能源需求的不断增加,虽然锂离子电池在便携式消费电子产品、电动汽车、太阳能和风能的储能系统等领域取得广泛应用,但全球锂资源的短缺、极不均匀的分布、快速消耗及锂离子电池的低安全性问题,大大制约了锂离子电池的进一步推广应用。发展高安全、低成本、长寿命、环境友好、可适当替代或补充锂离子电池的电化学储能系统已迫在眉睫[1]。由于钠资源在地球上储量丰富、分布广泛、成本低廉,综合性能优异的钠离子电池受到人们高度关注,被广泛认为是目前锂离子电池最有前途的替代者或补充者,不仅在大规模电化学储能中具有极大的应用潜力,而且在电动汽车、便携式消费电子产品等应用上同样未来可期。然而,与高循环稳定性、高倍率性能的钠离子电池正极材料相比,负极材料的开发相对缓慢,这限制了钠离子电池的商业化应用。因此,开发合适的钠离子电池负极材料成为近年来的研究热点。
在众多钠离子电池负极材料中,钴基硫族化合物具有较高的理论比容量,但是存在导电性差,合成步骤冗长、合成过程复杂、体积效应显著、颗粒尺寸分布宽以及与碳复合不均匀等问题[2-4]。针对以上问题,我们课题组曾采用简便的方法合成了与碳均匀复合的单金属硫化物(CoS)纳米颗粒,即以室温固相自组装反应制备Co(Ⅱ)的双席夫碱配合物前驱体,随后在硫粉存在下进行中温煅烧,并且明显改善了材料的电化学储钠性能[5]。然而,该法所得的复合物质地较坚硬,制备电极片过程中不易研磨变细,进而影响电池的一致性和重现性;同时,钴资源的稀缺也导致材料的成本高和不可持续性的问题。
为实现钠离子电池负极材料的减排、降本、增效,优化合成工艺,采取与碳材料复合,同时利用资源丰富、成本低廉、对环境友好的元素(如铁、锰等元素)掺杂取代稀缺贵重的钴是值得尝试的。由于铁元素等掺杂到过渡金属硫族化合物中,产生了更多的缺陷,这使得掺杂后的材料具有更多电化学活性位点,同时也增大了电极与电解质溶液的接触面积,改善了固体材料表面的液体润湿性能,从而保证快速的界面电荷转移[6-9]。
本工作沿用室温固相反应助力中温热处理合成策略[5],采用邻香草醛、邻苯二胺作为碳源和氮源,四水合乙酸钴作为钴源,无水醋酸亚铁为铁源,硫粉为硫源,室温下将5种固体研磨混合均匀,便可获得一种前驱体,该前驱体是通过室温下发生的固相自组装反应生成的Co(Ⅱ)和Fe(Ⅱ)的双席夫碱配合物[10]与硫粉的混合物。再经过随后的中温热处理,同时发生硫化和碳化反应,便生成超细的FeCoS2纳米粒子,其均匀分布于N、S 共掺杂的碳基质(记为NSC)中,形成一体化复合物,记为FeCoS2⊂NSC。在前驱体中,双席夫碱与Co(Ⅱ)和Fe(Ⅱ)离子以配位键结合,组成分布呈现原子水平上的均匀性,这有助于原位生成的FeCoS2纳米晶均匀地分布于NSC 中;N、S 元素掺杂到碳骨架中,不仅可以提高材料的导电性,还为复合物提供更多的储钠活性位点,从而赋予该复合物良好的电化学储钠性能。
1 实验部分
1.1 复合物的合成
称取0.25 g(1 mmol)Co(Ac)2·4H2O(国药集团化学试剂有限公司,分析纯)、0.174 g(1 mmol)Fe(Ac)2(Aladdin,分析纯)、0.22 g(2 mmol)邻苯二胺(国药集团化学试剂有限公司,化学纯)、0.61 g(4 mmol)邻香草醛(Aladdin,分析纯)和0.64 g(20 mmol)硫粉(Aladdin,分析纯),并将上述固体物质全部加入玛瑙研钵中,室温下充分混合研磨1 h,便生成红棕色粉末前驱体。然后将该前驱体转移到瓷舟中,并将瓷舟缓慢推入石英管式炉中进行煅烧。在加热升温前,先将管式炉通1 h的高纯N2(气体流速为50 mL·min-1),以驱除炉内的O2。之后,在保持通N2下,将管式炉以5 ℃·min-1的升温速率从室温升至700 ℃,并在700 ℃下维持煅烧1 h。煅烧结束后,在继续保持通N2下将管式炉自然冷却至室温,即可获得最终产物,记为FeCoS2⊂NSC-7001。
作为对照,保持其他条件与制备FeCoS2⊂NSC-7001 时的相同,只是热处理温度分别改变为500 和600 ℃,以优化煅烧温度,所得产物分别记为FeCoS2⊂NSC-5001和FeCoS2⊂NSC-6001。
类似地,保持其他条件与制备FeCoS2⊂NSC-7001 时的相同,只是在不加入Fe(Ac)2但Co(Ac)2·4H2O 的用量加倍的情形下,合成CoS⊂NSC-7001;在不加入Co(Ac)2·4H2O 但Fe(Ac)2的用量加倍的情形下,合成FeS⊂NSC-7001;在Co(Ac)2·4H2O、Fe(Ac)2都不加入的情形下,合成NSC-7001。
值得一提的是,与质地相对坚硬的CoS⊂NSC-7001、FeS⊂NSC-7001 相比,FeCoS2⊂NSC-7001 和NSC-7001 质地显得更柔软,易于研磨并制成电极片。
1.2 复合物的物理表征
采用不同的表征技术对所合成的复合物进行表征。通过粉末X 射线衍射(XRD)获得复合物的晶体结构和相组成的信息,所用仪器为X 射线粉末衍射仪(D/max 2500/PC,Rigaku),测试条件:辐射源为CuKα,工作电压为45 kV,工作电流为100 mA,X 射线波长λ=0.154 06 nm,2θ扫描范围为5°~85°,扫速为5(°)·min-1。复合物的形貌和详细的结构信息通过透射电子显微镜(TEM,Hitachi H-7650,加速电压为120 kV)和带有高角度环形暗场扫描透射电子显微镜(HAADF-STEM)及能量色散X 射线光谱仪(EDS,NO-RAN System 7,Thermo Fisher Scientific)的高倍透射电子显微镜(HRTEM,JEOL JEM-2100F,加速电压为200 kV)获得。为了进一步确定复合物中碳的存在,通过拉曼共聚焦显微镜(Raman,LabRam HR Evolution)获得拉曼光谱信息,其激发波长为532 nm。为了确定复合物中的碳含量,在热分析仪(NETZSCH STA 449 F3)上对复合物样品进行热重分析(TGA),测试条件:空气流速为100 mL·min-1,升温速率为10 ℃·min-1,温度区间为室温到800 ℃。复合物表面的电子结构和化学成分是通过X射线光电子能谱(XPS,ESCALAB 250Xi+,Thermo Scientific,激发源为AlKα)分析,采用C1s峰(284.8 eV)对结合能进行校正。
1.3 电极的制备及电池组装
电极的制备:以70∶20∶10的质量比分别称取活性物质(FeCoS2⊂NSC、FeS⊂NSC、CoS⊂NSC、NSC)、导电剂(Super P)和黏结剂(羧甲基纤维素钠,Na-CMC),将其置于玛瑙研钵中混合均匀并充分研磨30 min。随后将其转移至10 mL 的小烧杯中,加入适量的二次蒸馏水作分散剂,再用玻璃棒搅拌30 min,得到黑色均匀的黏稠浆料。将浆料转移至铜箔集流体上,再用玛瑙杵涂匀。随后将涂有浆料的铜箔置于真空干燥箱中,在120 ℃下干燥12 h,待冷却至室温后,用切片机将铜箔裁成直径为12 mm的圆形极片。最后将裁好的极片在压片机(条件为12 MPa,20 ℃)下压片30 s,即制备得到工作电极。称量极片质量(其中活性物质的质量为0.8~1.5 mg),随后放入手套箱的真空仓中抽真空4 h后转入手套箱中待用。
电池的组装:所有钠离子电池均为2032型扣式半电池,在充满氩气的手套箱(IL-2GB,美国创新科技)中组装,手套箱中O2及H2O 的体积分数均在10-6以下。组装好的电池从手套箱中取出后,室温下静置24 h,测试其电化学性能。在组装电池过程中,以上述制备的电极片为工作电极,金属钠片作为对电极和参比电极,玻璃纤维膜GF/D(Whatman)作为隔膜,电解液为1 mol·L-1NaClO4的碳酸乙烯酯(EC)/碳酸丙烯酯(PC)(体积比1∶1)的溶液,另添加体积分数5%的氟代碳酸乙烯酯(FEC)作为添加剂。
1.4 电化学性能测试
将组装好的电池进行电化学性能测试:在LANHE 电池测试系统(LANHE CT 2001A,武汉市蓝电电子股份有限公司)上进行恒流充放电循环性能和倍率性能测试,电压范围为0.01~3.0 V;循环伏安(CV)测试是在电化学工作站(CHI660E,上海辰华仪器有限公司)上进行,电位扫描区间为0.01~3.0 V,电位扫速为0.2 mV·s-1。所有电化学测试均在室温(25 ℃)下进行。
2 结果与讨论
2.1 复合物的物理表征分析
为确定所合成复合物的结构和物相组成,对其进行XRD 表征,图1 为测得的XRD 图。由图1a 可知,随着煅烧温度的升高,所制备的复合物中FeCoS2结晶性变得更好。其中,30.7°、35.2°、46.3°和54.6°处的衍射峰分别对应FeCoS2(PDF No.75-0607)的(100)、(101)、(102)和(110)晶面[7]。图1b 和1c 分别是FeS⊂NSC-7001 和CoS⊂NSC-7001 的XRD 图。从图1b 可以看出,在45.0°和55.4°处有2 个宽峰,对应FeS(PDF No.76-0965)的(211)和(020)晶面[11-12];图1c显示在30.6°、35.3°、46.9°和54.4°处有4 个衍射峰,分别对应CoS(PDF No.65-3418)的(100)、(101)、(102)和(110)晶面。FeCoS2的峰位置与CoS 相近,与FeS相去甚远,说明Fe(Ⅱ)离子均匀掺杂到了CoS晶格中,取代了CoS 晶格中的Co(Ⅱ)离子,从而形成完全固溶体FeCoS2。
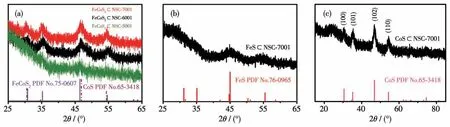
图1 复合物的XRD图Fig.1 XRD patterns for the composites
复合物的形貌和详细的结构信息通过TEM 获得。图2 是3 个不同温度下合成的FeCoS2⊂NSC-5001、FeCoS2⊂NSC-6001、FeCoS2⊂NSC-7001 复合物以及700 ℃下合成的NSC-7001 的低倍TEM 照片。从图2中可以看到,颜色较深的是FeCoS2超细颗粒,颜色较浅的是碳材料,3 个温度下都可以观察到超细的FeCoS2纳米颗粒均匀分散在NSC 中。其中,FeCoS2⊂NSC-5001 中FeCoS2的颗粒质感较差,仔细观察图中颗粒仍然存在,这可归因于硫化温度低,不利于晶态物质的形成[13],此结果与前述的XRD 结果是一致的,500 ℃下合成的复合物结晶度最差,而FeCoS2⊂NSC-7001 中FeCoS2的颗粒尺寸、分布均匀性、结晶性均明显好于其他2个复合物。此外,NSC-7001的低倍TEM照片(图2g、2h)显示,双席夫碱在硫粉存在下热解,所生成的NSC 是形状不规则的碳连续体,这为电化学活性物质FeCoS2的限域提供了可能。

图2 复合物的低倍TEM照片Fig.2 Low-resolution TEM images for the composites
为了更进一步了解FeCoS2⊂NSC-7001纳米复合物的形貌和微观结构,我们对其进行了高倍TEM 表征。从图3a 中可知,产物呈三维不规则块状的形貌;由图3b 可见,有许多大小均一的FeCoS2纳米颗粒均匀分布于NSC 中,颗粒平均尺寸约为3.4 nm。这可能源于前驱体中配合物的Co(Ⅱ)和Fe(Ⅱ)是以微观尺度上均匀存在的,当配合物热解时,有机配体发生碳化反应形成碳介质,可有效阻止配合物中Co(Ⅱ)和Fe(Ⅱ)发生碳热还原产生的单质Co 和Fe的团聚,从而使得单质Co 和Fe 在经原位硫化后所得的FeCoS2被相对均匀地限域在NSC 中。从图3c 可以看出,FeCoS2⊂NSC-7001 纳米复合物呈现清晰的晶格条纹,晶格间距为0.196、0.255 和0.291 nm,分别对应FeCoS2的(102)、(101)和(100)晶面,这些结果与XRD 结果非常吻合。EDS 元素组成显示(图3d),Fe和Co元素原子比为0.83∶1,接近1∶1,证实了合成的产物为FeCoS2纳米粒子,且其均匀地分散在NSC中。此外,EDS元素分布图(图3e)显示,FeCoS2⊂NSC-7001纳米复合物中Fe、Co、S、C和N元素均匀分布。
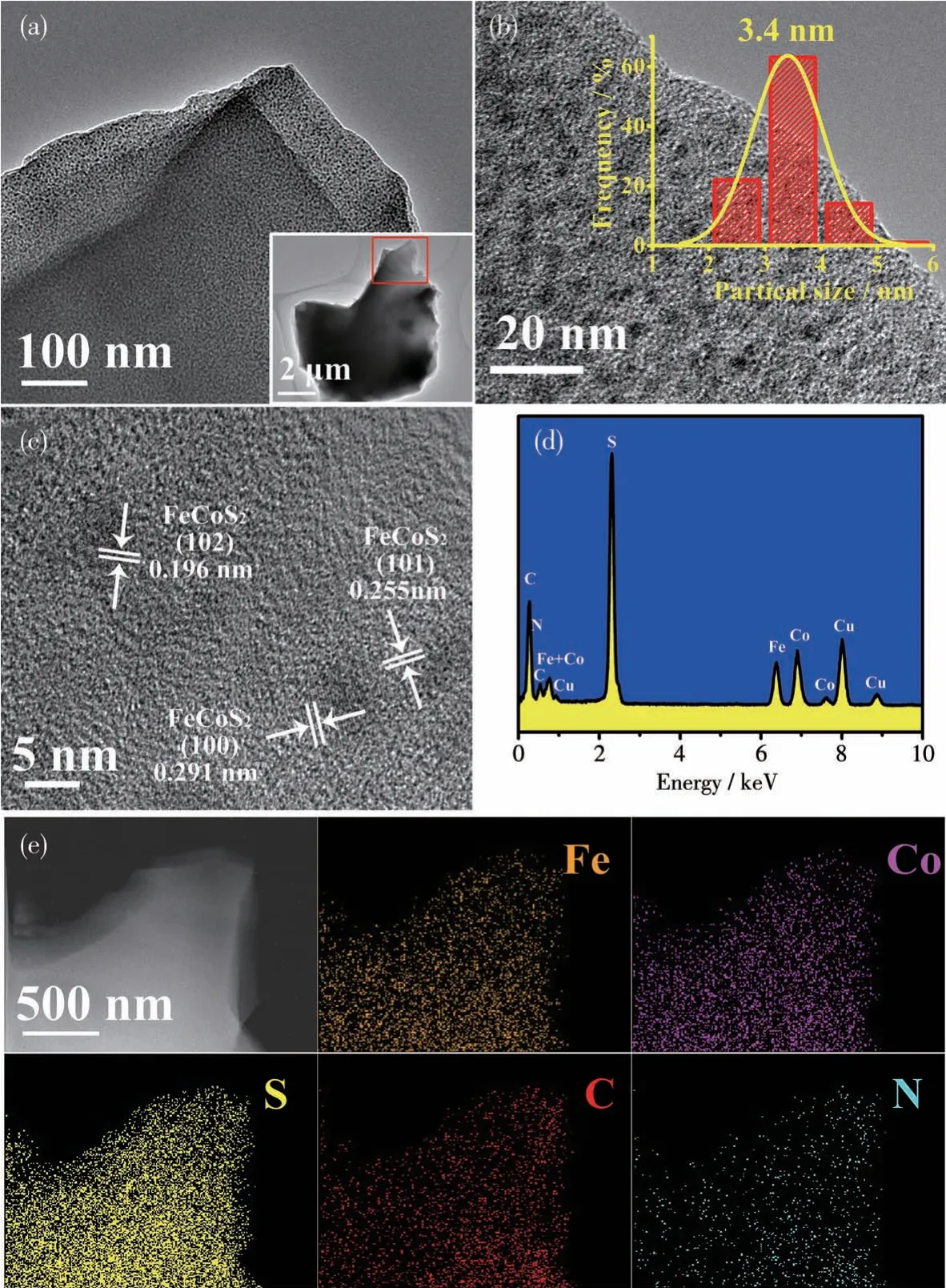
图3 FeCoS2⊂NSC-7001复合物的(a、b)低倍TEM照片、(c)高倍TEM照片、(d)EDS谱图和(e)HAADF-STEM 图及EDS元素分布图Fig.3 (a,b)Low-resolution TEM images,(c)high-resolution TEM image,(d)EDS spectrum,and(e)HAADF-STEM image and EDS elemental mappings of the FeCoS2⊂NSC-7001 composite
为了进一步证实碳的存在,以及复合物中存在的是FeCoS2,而不是CoS 和FeS 的混合物,对FeCoS2⊂NSC-7001、NSC-7001、FeS ⊂NSC-7001 和CoS⊂NSC-7001 复合物进行了拉曼光谱测试,结果如图4a 所示。由图可见,4 种复合物在1 342 和1 568 cm-1处均出现2 个明显的拉曼峰,分别归属于碳材料的D 峰和G 峰[14],说明这些复合物中均有碳介质存在。此外,上述4 种复合物的D 峰和G 峰的强度比(ID/IG)依次为1.38、1.22、1.17、1.07,FeCoS2⊂NSC-7001 的值最大(1.38),表明该复合物较其他复合物在结构上存在更多的缺陷[15],这有利于提供更多的储钠活性位点,因而更加有助于储钠,从而表现出更好的电化学储钠性能。这可能是在席夫碱配合物中,配体席夫碱的N 原子与中心金属离子Co(Ⅱ)和Fe(Ⅱ)间存在配位键[10],因此,当席夫碱配合物在700 ℃热处理时,相较于单一中心金属离子Co(Ⅱ)或Fe(Ⅱ)的配合物,双中心金属离子Co(Ⅱ)和Fe(Ⅱ)的配合物中席夫碱配体的N原子能更多地原位掺杂进碳骨架中,从而实现更多杂原子掺杂,产生更多的缺陷。值得注意的是,FeS⊂NSC-7001 在217和281 cm-1处的峰归属于FeS的特征峰,这与文献报道一致[16-18];CoS⊂NSC-7001 在470、507、604 和674 cm-1处的峰归因于CoS 的特征峰[19];而FeCoS2⊂NSC-7001 中没有CoS 和FeS 的相关特征峰,它只存在一个位于663 cm-1处的峰,说明合成的FeCoS2⊂NSC-7001 不是CoS 和FeS 的混合物,而是Fe(Ⅱ)离子掺杂进了CoS 的晶格中,取代了Co(Ⅱ)离子,从而形成了新物质FeCoS2。
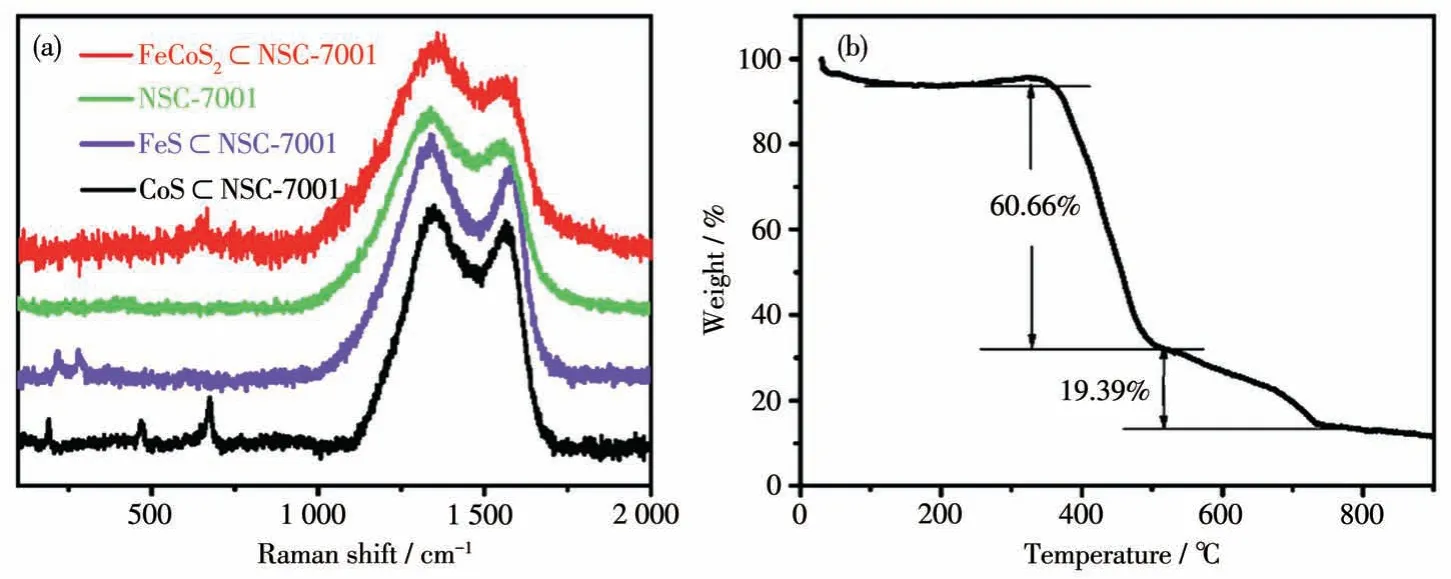
图4 (a)FeCoS2⊂NSC-7001、NSC-7001、FeS⊂NSC-7001和CoS⊂NSC-7001复合物的拉曼光谱;(b)FeCoS2⊂NSC-7001复合物的TG曲线Fig.4 (a)Raman spectra of the FeCoS2⊂NSC-7001,NSC-7001,FeS⊂NSC-7001,and CoS⊂NSC-7001 composites;(b)TG curve for the FeCoS2⊂NSC-7001 composite
为确定FeCoS2⊂NSC-7001纳米复合物中各组分的质量分数,我们对其进行了TG 测试,图4b为在空气氛中测得的TG 曲线。在250~340 ℃范围内出现一个稍微增重的过程,它可归属于CoS[20-21]和FeS[22-23]在空气气氛下被氧化为CoSO4和FeSO4的过程;在340~800 ℃范围内,除了碳介质被燃烧导致失重外,CoSO4和FeSO4也会因分解成Co3O4、Fe3O4、SO2而导致失重。因此,我们按照钴和铁的原子比(1∶1)可计算出该复合物中FeCoS2的含量(质量分数)为45.3%,碳含量(质量分数)为54.7%。
为了进一步确定所制备的复合物表面的元素组成及电子结构,我们对其进行了XPS 表征。图5a为FeCoS2⊂NSC-7001 的XPS 全谱图,该图清楚显示元素Fe、Co、S、C、N 和O 的信号峰,说明FeCoS2⊂NSC-7001 复合物中存在元素Fe、Co、S、C、N 和O。Co2p谱图(图5b)显示,在781.8 和797.8 eV 处分别出现了Co—S 键的Co2p3/2和Co2p1/2峰,2 个峰之间的结合能间隔为16.0 eV,且每个峰都有1 个卫星峰[15,24-26],这与文献[24]报道的CoS 以及CoS ⊂NSC-7001[5]的Co2p谱图是一致的。Fe2p谱图(图5c)中有5个峰,724.3和710.9 eV 处的峰为Fe—S键的Fe2+离子的特征峰,而726.4 和713.9 eV 处的峰与Fe3+离子特征峰吻合,这可能是FeS 的高活性表面部分被氧化所致,这种现象在其他FeS 体系中非常普遍[27-28]。这些结果与FeS⊂NSC-7001 的Fe2p谱图(图S1b,Supporting information)是一致的。S2p谱图(图5c)中,在163.6 和164.8 eV 处的2 个峰分别对应C—S键(其中的S 为噻吩S 原子)的S2p3/2和S2p1/2[2,24,29],表明硫已成功地掺杂到碳骨架中[29-30]。在168.5 eV 处的峰可能归因于氧化为CxSOy基团中的S,它可能是由含硫物种在空气中的部分氧化引起的[7,31]。这些结果与FeS⊂NSC-7001(图S1c)和CoS⊂NSC-7001[5]的S2p谱图是一致的。然而,更为值得注意的是,S2p谱图(图5c)中出现了M—S 键的S2p3/2(161.5 eV)和S2p1/2(162.7 eV)峰[24,29],恰好位于Co—S 键(161.7 和162.9 eV)[5]和Fe—S键(图S1c,161.4和162.4 eV)的结合能之间,说明FeCoS2⊂NSC-7001 复合物中既存在Fe—S 键,也存在Co—S 键[32-33]。图5d 中的C1s谱图可解析为3 个峰,分别对应C—C(284.5 eV)、C—N/C—S(285.7 eV)和C=O(288.5 eV)化学键的结合能[22,24,29,34],这些结果与FeS⊂NSC-7001(图S1d)和CoS⊂NSC-7001[5]的C1s谱图一致。类似地,与FeS⊂NSC-7001(图S1e)和CoS⊂NSC-7001[5]的N1s谱图一致,N1s谱图(图5e)显示存在3种类型的N原子,分别为吡啶氮(398.1 eV)、吡咯氮(399.0 eV)和石墨化氮(400.4 eV)[29,35]。石墨化氮的存在为氮原子掺杂到碳骨架中提供了有力的证据[29]。
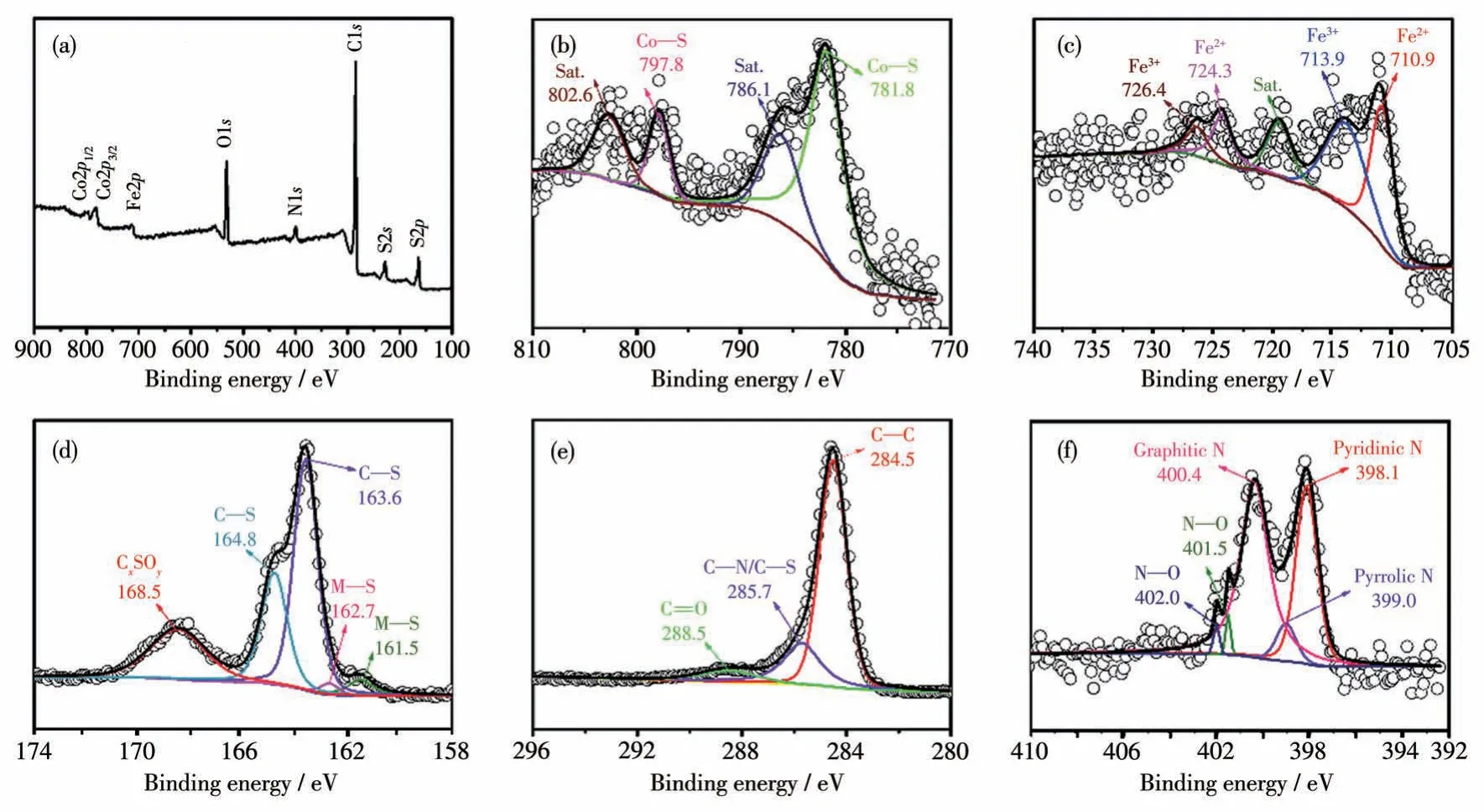
图5 FeCoS2⊂NSC-7001复合物的XPS谱图Fig.5 XPS spectra of the FeCoS2⊂NSC-7001 composite
总之,XPS 的表征分析证实了FeCoS2⊂NSC-7001 纳米复合物中各元素及M—S 键的存在,同时还说明了碳骨架中成功掺入了N 和S 原子[24-25]。这些杂原子的存在不仅可以显著提高碳基质材料的电导率,而且这些原子所在位置为缺陷存在处,大大影响了碳网络中相邻碳原子的电子特性,促使其通过电子给体效应充当FeCoS2纳米粒子生长的活性位点[29],从而有利于FeCoS2纳米粒子的限域生长。
2.2 复合物的电化学储钠性能分析
为了探索所合成的复合物的电化学储钠性能,我们将其组装成2032 型扣式半电池并进行电化学测试,结果如图6 所示。图6a、6b 分别为FeS⊂NSC-7001 和FeCoS2⊂NSC-7001 在0.01~3 V(vs Na+/Na)范围内以0.2 mV·s-1的扫描速率测得的CV 曲线。对FeS⊂NSC-7001 而言(图6a),首次循环中可以观察到0.67 V 出现一个小的尖锐还原峰,它可归因于电解质溶液的分解形成的固体电解质界面(SEI)膜,以及Na+嵌入到FeS 中发生的转化反应(FeS+xNa++xe-→NaxFeS,NaxFeS+(2-x)Na++(2-x)e-→Fe+Na2S)。同时,在0.5 V 以下区间出现持续还原峰,它对应SEI膜的形成以及NSC 的嵌钠过程,这非常类似于N、Se共掺杂碳(NSeC)的电化学还原行为[36]。从第2个CV循环开始,1.25 V 以下区间出现相对稳定的持续还原峰,对应Na+嵌入到FeS中发生的转化反应。在电位正扫过程中,从首圈开始就在1.30 V 处出现一个较宽的氧化峰,对应NSC 的脱钠过程,以及Na+从FeS 中脱嵌发生的转化反应(Fe+Na2S →NaxFeS+(2-x)Na++(2-x)e-,NaxFeS →FeS+xNa++xe-)。
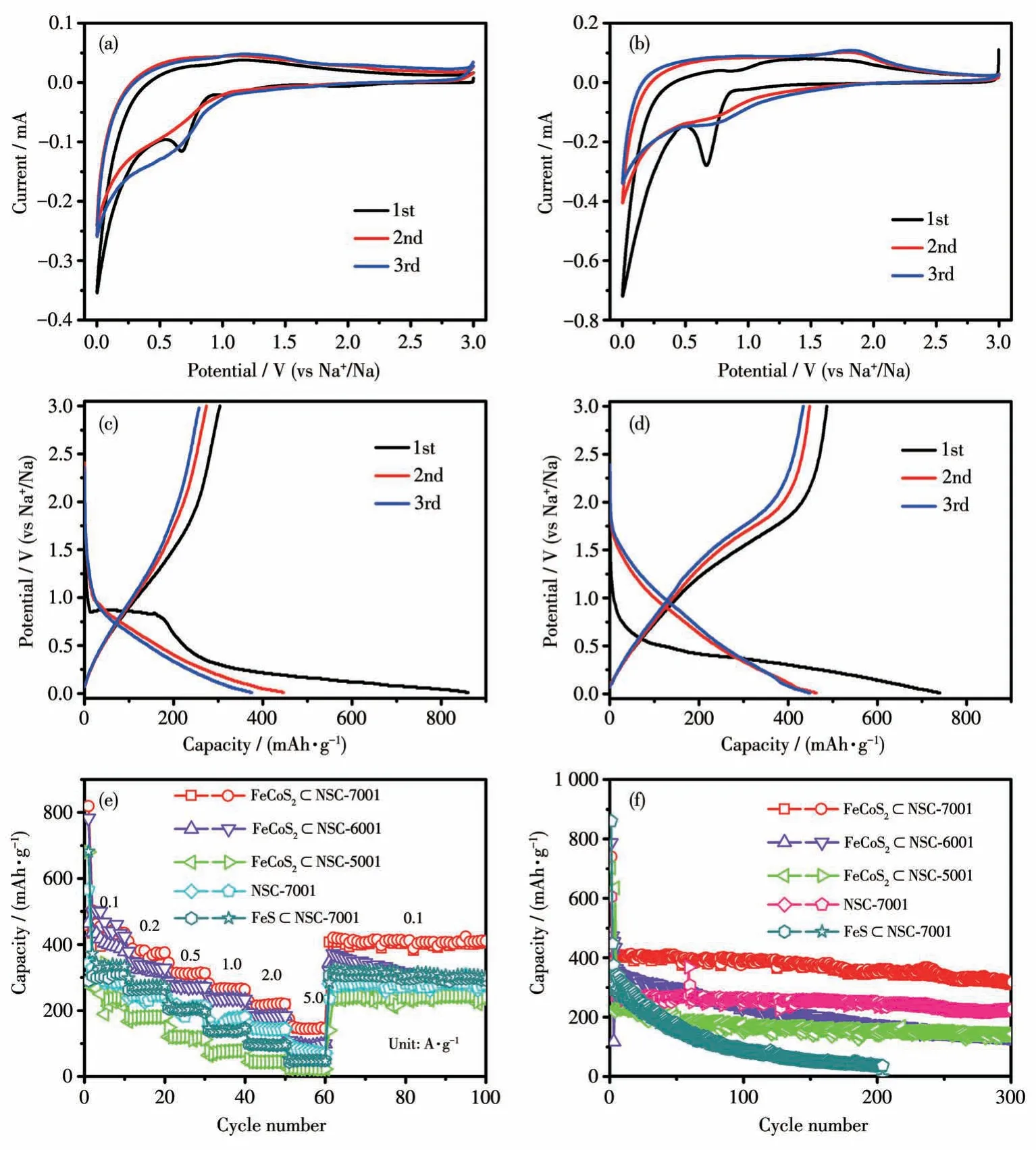
图6 (a)FeS⊂NSC-7001和(b)FeCoS2⊂NSC-7001的前3圈的CV曲线(电位范围为0.01~3 V,扫速为0.2 mV·s-1);(c)FeS⊂NSC-7001和(d)FeCoS2⊂NSC-7001的前3圈充放电曲线(电压范围为0.01~3 V,电流密度为0.1 A·g-1);FeCoS2⊂NSC-5001、FeCoS2⊂NSC-6001、FeCoS2⊂NSC-7001、FeS⊂NSC-7001和NSC-7001的(e)倍率性能曲线和(f)在0.1 A·g-1电流密度下的循环性能曲线Fig.6 CV curves for the initial three cycles within a potential range of 0.01-3.00 V at a scan rate of 0.2 mV·s-1 for(a)FeS⊂NSC-7001 and(b)FeCoS2⊂NSC-7001;Galvanostatic charge-discharge profiles for the initial three cycles for(c)FeS⊂NSC-7001 and(d)FeCoS2⊂NSC-7001 at a current density of 0.1 A·g-1;(e)Rate capability at varied current densities and(f)cycling performances of FeCoS2⊂NSC-5001,FeCoS2⊂NSC-6001,FeCoS2⊂NSC-7001,FeS⊂NSC-7001,and NSC-7001 at a current density of 0.1 A·g-1
对FeCoS2⊂NSC-7001 而言(图6b),首个循环在0.68 V 处出现一个大的尖锐还原峰,它可归因于电极表面SEI 膜的形成,以及Na+嵌入到FeCoS2中发生的转化反应(FeCoS2+yNa++ye-→ NayFeCoS2,NayFeCoS2+(4-y)Na++(4-y)e-→Fe+Co+2Na2S)。同时,在0.51 V以下区间出现持续还原峰,它对应电极表面SEI 膜的形成以及NSC 的嵌钠过程。从第2 个CV循环开始,在1.25 V以下区间出现相对稳定的持续还原峰,对应Na+嵌入到FeCoS2中发生的转化反应。在电位正扫过程中,首次循环在1.40 V 处出现一个较宽的氧化峰,从第2 个CV 循环开始,该氧化峰移动到1.82 V 处,呈现相对稳定的氧化过程,2 个峰均对应Na+从FeCoS2中脱嵌发生的转化反应(Fe+Co+2Na2S →NayFeCoS2+(4-y)Na++(4-y)e-,NayFeCoS2→FeCoS2+yNa++ye-)。此外,CV 曲线从第2 个循环开始几乎是重叠的,预示着FeCoS2⊂NSC-7001 的电化学储钠性能具有良好的可逆性和稳定性。
图6c 和6d 分别为FeS⊂NSC-7001 和FeCoS2⊂NSC-7001 复合物电极的前3 圈恒电流充放电曲线。由图可见,在电流密度0.1 A·g-1下首个充放电循环中,FeCoS2⊂NSC-7001 复合物的放电平台电位比FeS⊂NSC-7001 更低,随后的2 个充放电循环中,FeCoS2⊂NSC-7001复合物的充放电曲线的重叠性比FeS⊂NSC-7001 更好,这与上述CV 曲线结果相一致,同样预示着FeCoS2⊂NSC-7001 复合物具有良好的可逆性和稳定性。此外,FeCoS2⊂NSC-7001 复合物的首次放电/充电比容量分别为739.9/486.4 mAh·g-1,首次库仑效率为65.7%,首次不可逆容量的损失源于电极表面不可逆地形成了SEI膜[25]。
将组装好的电池在不同电流密度下进行充放电循环,以评估所制备复合物的倍率性能,图6e 为在0.1~5 A·g-1电流密度下所测得的倍率性能曲线。从图中可以看出,FeCoS2⊂NSC-7001 制备的电极在不同的电流密度下的平均充电比容量分别为415.7 mAh·g-1(0.1 A·g-1)、367.8 mAh·g-1(0.2 A·g-1)、311.1 mAh·g-1(0.5 A·g-1)、262.3 mAh·g-1(1 A·g-1)、216.0 mAh·g-1(2 A·g-1)、146.0 mAh·g-1(5 A·g-1),且当充放电电流密度再次回到0.1 A·g-1时,充电比容量可恢复至407.5 mAh·g-1,显示出出色的倍率性能。与0.1 A·g-1电流密度下的充电比容量相比,FeCoS2⊂NSC-7001 在5 A·g-1充放电电流密度下的平均充电比容量保持率为35.1%。然而,作为对比的FeCoS2⊂NSC-5001、FeCoS2⊂NSC-6001、FeS ⊂NSC-7001 和NSC-7001电极的充电比容量要低得多,尤其是在大电流密度(如5 A·g-1)下,FeCoS2⊂NSC-5001 和FeS⊂NSC-7001材料的充电比容量已经极低。
图6f 为电极的恒电流充放电循环性能曲线。由图可知,在0.1 A·g-1的充放电电流密度下,FeCoS2⊂NSC-7001 电极具有良好的高容量循环稳定性,即使经过300 次充放电循环,仍能保持310.4 mAh·g-1的可逆充电比容量,实现了69.3%容量保持率(相对于第2 次循环的充电比容量)。然而,FeCoS2⊂NSC-600、FeS⊂NSC-7001 的容量衰减迅速,FeCoS2⊂NSC-5001、CoS⊂NSC-7001 和NSC-7001 的稳定性虽然较好,但是充电比容量仍显著低于FeCoS2⊂NSC-7001。
FeCoS2⊂NSC-7001 复合物呈现出色的循环稳定性和倍率性能,其原因可能是N、S 共掺杂碳的存在不仅增加了复合物的电子导电性,而且缓解了Na+脱出/嵌入过程中的体积变化。此外,该复合物中存在更多的缺陷,提供了更多的可逆脱出/嵌入Na+的活性位点。
3 结 论
本文报道了一种简便、绿色的合成方法,即通过室温固相自组装反应制备Co(Ⅱ)和Fe(Ⅱ)的席夫碱配合物前驱体,二者在随后的热处理过程中同时发生硫化和热解碳化反应,从而制备了NSC 均匀限域的FeCoS2纳米晶复合物。该法的最大优势在于通过简单的固相反应,实现了FeCoS2生成的同时,还与原位碳化所得的碳材料复合,简便制得FeCoS2纳米晶与NSC 的复合物。这样制备的复合物质地柔软,易于制作电极片;可有效抑制充放电循环过程中活性物质的团聚,缓解Na+脱出/嵌入过程中的体积变化;材料整体电子导电性得到提高,且为Na+的可逆脱出/嵌入增加了更多的活性位点,因此,复合物呈现出出色的电化学储钠性能。这种简便的室温固相反应助力随后热处理的合成策略,为规模化、绿色化制备实用的杂多原子掺杂碳限域的多金属硫化物纳米晶复合物开辟了新路径。
Supporting information is available at http://www.wjhxxb.cn

