新鲜周期体外受精-胚胎移植后子代单胎活产儿中小于胎龄儿的发生率及危险因素分析*
张琼 高睿 陈明丽 刘秀美 秦朗
(1.四川大学华西第二医院妇产科生殖医学中心·出生缺陷与相关妇儿疾病教育部重点实验室,四川 成都 610041;2.资阳市妇幼保健院·四川大学华西第二医院资阳妇女儿童医院,四川 资阳 641300)
辅助生育技术是不孕症患者重要的助孕手段,具体包括体外受精(In vitro fertilization,IVF)、卵细胞浆内精子注射(Intracytoplasmic sperm injection,ICSI)、胚胎植入前遗传学筛查(Pre-implantation genetic test,PGT)等,近年来,全世界范围内越来越多的家庭因辅助生育技术获益[1]。自辅助生育技术诞生以来,其短期和远期安全性一直是学界关注的重点。既往研究显示,IVF/ICSI-胚胎移植(Embryo transfer,ET)是妊娠期糖尿病、妊娠期高血压、早产、出生低体重儿等妊娠并发症和不良妊娠结局的危险因素,但IVF/ICSI-ET增加妊娠并发症和不良妊娠结局风险的原因尚存在广泛争议[2-5]。小于胎龄儿(small for gestational age infant,SGA)指出生体重低于同性别、同胎龄新生儿平均出生体质量第10百分位的新生儿,根据严重程度可分为轻中度SGA和重度SGA[6]。研究发现SGA和正常新生儿相比患病率、死亡率均显著升高,达正常新生儿4倍以上,远期出现各种疾病的风险也更高,因此SGA是威胁新生儿健康的重要因素之一[7]。既往研究显示,IVF/ICSI-ET是SGA的危险因素[2],可能与不孕患者的一般特征、控制性卵巢刺激(Controlled ovarian stimulation, COS)、IVF/ICSI的操作等有关[8-9]。此外,不同程度SGA的发病机制可能不尽相同[10]。然而上述研究均基于小样本的研究,其发病率数据代表性不佳,且尚未对不同程度SGA的危险因素进行具体分析。因此,本研究旨在通过大样本回顾性研究探讨新鲜周期IVF/ICSI-ET助孕后子代单胎活产儿中不同程度SGA的发生率及危险因素,以其为SGA的早期识别和预防提供参考依据。
1 资料与方法
1.1 研究对象 收集2014年4月-2020年12月在四川大学华西第二医院接受新鲜周期IVF/ICSI-ET助孕治疗并随访至活产的3695例患者病例资料, 以及新生儿出生体重、胎龄等新生儿资料。纳入标准为:①单胎妊娠。②接受常规的COS方案(卵泡期长方案、黄体期长方案、拮抗剂固定方案或拮抗剂灵活方案)。③移植胚胎为卵裂期D3胚胎或囊胚。排除标准为:①新生儿出生体重、胎龄等基本信息不详。②新生儿严重出生缺陷。③患者病史信息及IVF/ICSI-ET治疗信息缺失。经筛选后,共纳入2262例患者。参考2015年发布的《中国不同胎龄新生儿出生体重曲线研制》[11],依据子代出生体重在同性别、同胎龄新生儿中的百分位数,排除子代为大于胎龄儿(Large for gestational infant, LGA)(大于90百分位)的患者147例后,将剩余患者分为3组:正常组(第10~第90百分位)、轻中度SGA组(第3~第10百分位)、重度SGA组(小于第3百分位)。最终各组分别纳入患者1891例、114例和110例。
1.2 控制性卵巢刺激、体外受精与胚胎移植
1.2.1 常规COS方案 ①卵泡期长方案:月经周期第2~3天,经阴道超声了解窦卵泡计数(Antral follicle count,AFC)情况,无直径>10 mm的卵泡时肌注长效促性腺激素释放激素激动剂(Gonadotrophin releasing hormone agonist,GnRH-a)3.75 mg进行垂体降调节,28天后查外周血性激素水及经阴道超声,如外周血雌二醇(Estradiol,E2)≤30 pg/mL、黄体生成素(Luteinizing hormone,LH)≤5 IU/L、单个卵泡直径≤5 mm且内膜厚度≤5 mm,肌注促性腺激素(Gonadotrophin,Gn)150 IU/d~225 IU/d,并根据患者卵巢反应进行调整直至扳机日。②黄体期长方案:从月经周期第21 d,患者肌注GnRH-a 1.5~1.87 mg进行垂体降调节,降调标准同卵泡期长方案,若Gn刺激10 d后仍无≥10 mm卵泡出现则取消周期。③拮抗剂固定方案:月经周期第2~3 d起,每天肌注Gn,启动剂量为150 IU~225 IU,月经周期第6 d开始每天肌注0.25 mg GnRH拮抗剂至扳机日。④拮抗剂灵活方案:月经周期第2~3 d起每天肌注Gn,方法同拮抗剂固定方案。经阴道超声动态监测卵泡发育情况,当优势卵泡直径≥14 mm或血清E2>400 pg/ml时,每日肌注GnRH拮抗剂0.25 mg至扳机日。
1.2.2 扳机 根据卵泡大小和数目采用个体化扳机方案。当至少有2个卵泡≥18 mm或至少有3个卵泡≥17 mm时,给予人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)8 000~10 000 IU扳机。对于存在卵巢过度刺激综合征(ovarian hyperstimulation syndrome, OHSS)风险的患者,采用hCG 4000~5000 IU进行扳机。
1.2.3 取卵及胚胎移植 扳机后36~38 h行经阴道超声引导下穿刺取卵术,常规进行IVF或ICSI受精,于取卵后第3 d移植卵裂期胚胎或第5 d移植囊胚,剩余可利用胚胎全部冷冻保存。
1.3 信息收集 收集各组患者的病史资料及IVF/ICSI-ET相关信息。患者病史资料包括年龄、配偶年龄、BMI、不孕类型(原发不孕/继发不孕)、不孕年限、活产史、自然流产史、人工流产史、本次是否早产。助孕治疗信息包括COS方案(卵泡期长方案、黄体期长方案、拮抗剂固定方案、拮抗剂灵活方案)、扳机日激素水平(E2、P)、扳机日内膜厚度、获卵数、体外受精方案(IVF/ICSI)、移植胚胎类型(卵裂期胚胎/囊胚)和移植胚胎数目。
2 结果
2.1 SGA发生率 本研究纳入的2262例新鲜周期IVF/ICSI-ET助孕后分娩的单胎活产儿中,SGA的发生率为9.90%(224/2262)。其中轻中度SGA发生率为5.04%(114/2262),占全部SGA的50.89%(114/224);重度SGA发生率为4.86%(110/2262),占全部SGA的49.11%(110/224)。
2.2 不同程度SGA危险因素的单因素分析 和正常组相比,轻中度SGA组BMI更低 [20.9 (19.1~22.2)vs21.5 (20.0~23.3),P=0.002],有活产史者更少 [4.4%vs10.2%,P=0.045]、有自然流产史者更多[20.2%vs11.9%,P=0.009];重度SGA组年龄更低 [30 (28~32)vs31 (28~33),P=0.041]、配偶年龄更低[31 (29~35)vs32 (30~36),P=0.011]、有活产史者更少 [0.9%vs10.2%,P=0.001]、有自然流产史者更多 [26.4%vs11.9%,P<0.001]。见表1。和正常组相比,轻中度SGA组扳机日E2和P水平更高 [2373.6 (1629.2~3213.3)vs1889.6 (1177.0~2688.2) 和0.82 (0.61~1.03)vs0.71 (0.52~0.93),P<0.001和P=0.001]、重度SGA组早产率更高 [13.6%vs7.2%,P=0.014]。见表2。

表1 不同SGA组与正常组基本信息比较[M(P25,P75),n(×10-2)]
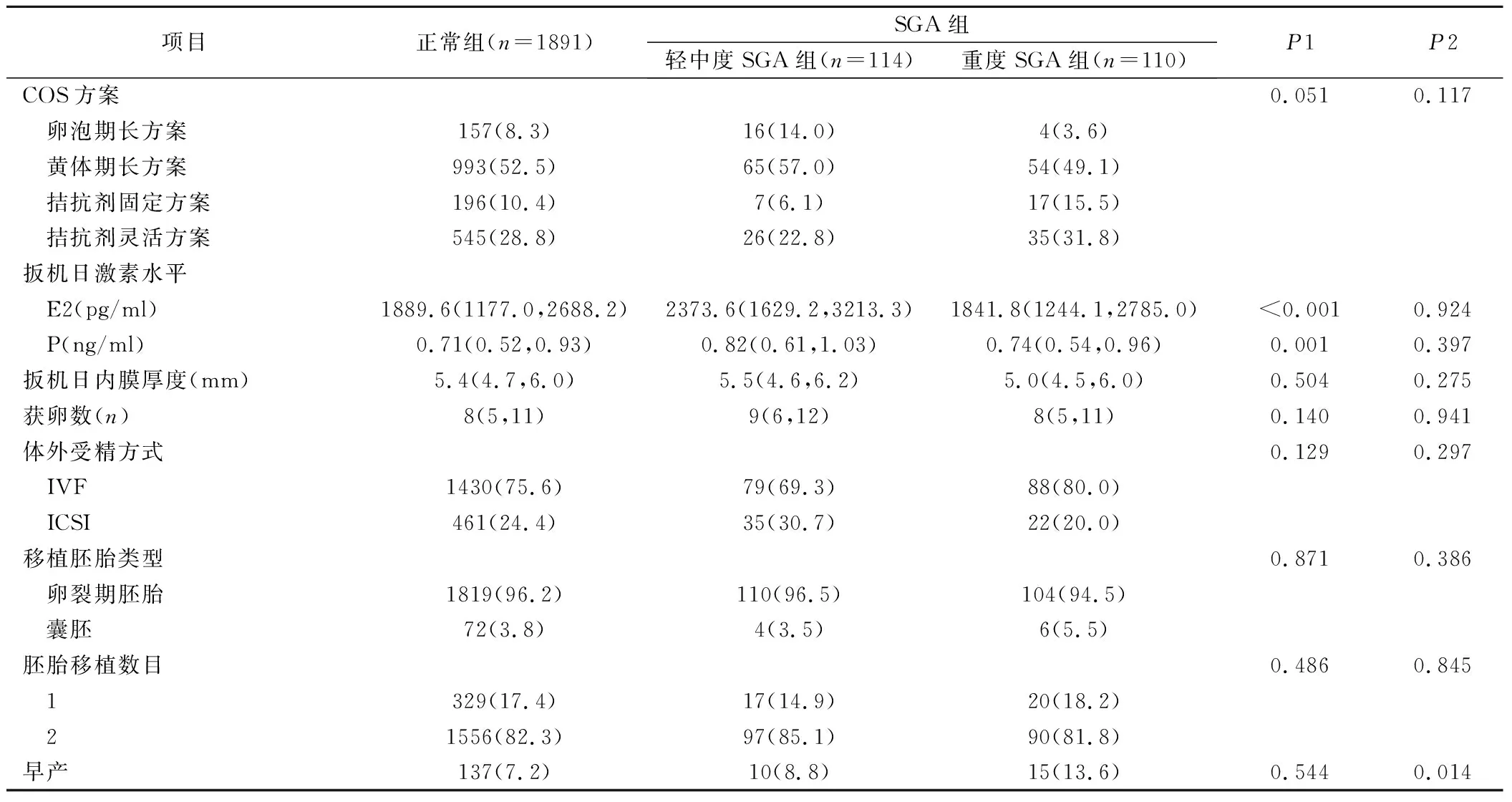
表2 不同SGA组与正常组助孕治疗信息比较[n(×10-2),M(P25,P75)]
2.3 不同程度SGA危险因素的多因素分析 多因素Logistic回归分析结果显示,在校正年龄、配偶年龄、扳机日E2和P水平后,BMI<18.5 kg/m2[校正后OR=4.54,95%CI=1.78~11.55]、有自然流产史 [校正后OR=1.91,95%CI=1.18~3.10]是轻中度SGA的危险因素,活产史是轻中度SGA的保护因素[校正后OR=0.39,95%CI=0.16~0.98]。在校正年龄、配偶年龄、BMI、扳机日E2和P水平后,早产 [校正后OR=2.22,95%CI=1.23~3.98]、自然流产史 [校正后OR=2.80,95%CI=1.78~4.42]是重度SGA的危险因素,活产史是重度SGA的保护因素[校正后OR=0.08,95%CI=0.01~0.60]。见表3。

表3 不同程度SGA危险因素的多因素分析[n(×10-2)]
3 讨论
SGA是一种常见的不良妊娠结局,不仅对新生儿的短期健康存在影响、增加新生儿的患病率与死亡率,还可能引起各种远期并发症,影响新生儿未来的长期健康水平,给家庭和社会带来沉重负担。自1978年全世界首例试管婴儿诞生以来,辅助生育技术已成为治疗不孕症的重要手段,越来越多的不孕夫妇通过辅助生育技术受孕。然而,研究发现辅助生育技术与多种妊娠并发症和不良妊娠结局相关[3,4,12]。Slavov等[2]2021年发表的队列研究结果显示,和自然妊娠相比,IVF助孕后SGA的发生率明显升高(P<0.05);胡绪林等[13]2020年发表的研究显示,辅助生育技术是重度SGA的危险因素。辅助生育技术助孕后SGA发生率增加的原因尚不清楚,一项研究发现容受期子宫内膜厚度≤7.5 mm可能是新鲜周期IVF/ICSI-ET后SGA的独立危险因素,但该研究纳入样本量较小,且校正因素较少,并未探究新鲜周期IVF/ICSI-ET过程中其他危险因素与SGA的关系[8]。还有研究分析了新鲜周期IVF/ICSI-ET后分娩单胎活产儿中子代低出生体重的发生风险,结果显示BMI<18.5kg/m2、早产、女性新生儿和是子代低体重出生的独立危险因素,但这些因素是否与SGA有关尚不清楚[12]。寻找新鲜周期IVF/ICSI-ET后SGA危险因素对于早期识别SGA乃至预防SGA的发生具有重要意义。
此外,既往研究表明轻中度SGA可能存在生理性因素,而重度SGA多与病理性因素有关[14]。这提示不同程度SGA可能存在不同的危险因素,因此将不同程度SGA分开讨论可能更具理论意义。本研究结果显示,新鲜周期IVF/ICSI-ET助孕后分娩的单胎活产儿中,SGA的发生率为9.90%,高于既往研究报道的SGA在人群中的整体发生率[15-16],提示新鲜周期IVF/ICSI-ET助孕治疗增加了子代SGA的风险。此外,本研究发现BMI<18.5 kg/m2和自然流产史是新鲜周期IVF/ICSI-ET助孕后分娩的单胎活产儿中轻中度SGA的危险因素,自然流产史和早产是重度SGA的危险因素;而活产史是SGA的保护因素。值得关注的是,父母年龄、不孕类型、COS方案、扳机日E2和P水平、获卵数、移植胚胎类型和移植胚胎数目等IVF/ICSI-ET助孕治疗相关指标并非SGA的危险因素。结合既往文献,BMI与SGA的关系已得到证实,甚至有研究报道孕前BMI<18.5 kg/m2者SGA发生率可达50%以上[17],另一项大样本病例对照研究结果也显示,随着孕前BMI的增加,SGA的发生率呈现下降趋势[18]。2017年发表的一篇高质量系统评价与Meta分析结果现实,BMI低于标准及孕期增重不达标与SGA密切相关[19]。上述研究与本研究结论一致,证实了本研究结果的可靠性。此外,既往研究也证实反复自然流产患者再次妊娠后SGA率高于健康孕妇[20],推测可能与自然流产对子宫内膜功能的损伤有关,也可能由于自然流产与SGA存在某些共同的危险因素,但还需未来的研究进一步证实。本研究为临床工作中接受新鲜周期IVF/ICSI-ET助孕患者早期预防SGA提供了参考依据,即对于BMI<18.5 kg/m2、有自然流产史、早产的患者需格外关注子代SGA的风险,在孕期加强监测,必要时协同新生儿科医生共同制定治疗方案。
本研究仍存在一定局限性。一方面,本研究未发现IVF/ICSI-ET助孕治疗相关指标(COS方案、扳机日E2和P水平、获卵数、助孕方式、移植胚胎类型、移植胚胎个数)与SGA存在明显的相关性,说明新鲜周期IVF/ICSI-ET助孕治疗对SGA的影响可能是间接的,主要与接受新鲜周期IVF/ICSI-ET助孕的患者的疾病特点有关。但由于本研究纳入的新鲜周期IVF/ICSI-ET助孕相关指标并不完善,本文对患者的基础性激素水平、促性腺激素用量等因素与SGA的关系尚未进行深入探究。另一方面,本研究的样本量相对较小,患者的妊娠期相关指标,如妊娠期高血压疾病、妊娠期糖尿病等并未被纳入研究,这些因素对SGA的影响可能对本研究结果产生一定影响。总之,未来尚需就此问题进行更为深入的研究。
4 结论
接受新鲜周期IVF/ICSI-ET助孕的患者中,BMI<18.5 kg/m2、有自然流产史、早产者子代发生SGA的风险增加,临床工作中应予以关注。

