基于网络药理学方法探讨黄芪治疗骨骼肌减少症的作用机制*
张 涛,叶 斌,严隽陶,马书杰
1 上海中医药大学附属岳阳中西医结合医院,上海 200437;2 上海市第三康复医院,上海 200436; 3 上海市第二康复医院,上海 201900
骨骼肌减少症又称肌少症、肌肉减少症,是一种以肌肉质量和肌肉功能丧失为特征的年龄相关性疾病,其病因可分为继发性及原发性。继发性骨骼肌减少多由肌肉失用、营养不良、内分泌失调等因素引起,而原发性骨骼肌减少症属增龄性疾病。研究显示正常人骨骼肌质量从40 岁后便开始下降,到80 岁时质量大约下降40%[1],与年龄增长导致神经功能下降、生长激素分泌改变、炎症通路激活、胰岛素抵抗等引起的肌肉蛋白合成与蛋白水解失衡有关[2-3]。作为一种常见于老年人的慢性病,骨骼肌减少症会增加患病老年人群的跌倒、骨折以及住院风险[4-6]。由于目前尚无专门针对骨骼肌减少症的西医治疗方法,中医药在治疗骨骼肌减少症中的作用逐渐凸显。
骨骼肌减少症属中医学“痿证”“虚劳”等范畴。气血亏虚,脾胃运化无力,水谷精微不能濡养肌肉是该病病因。黄芪味甘,性微温,入脾、肺经,具有补气升阳、固表止汗、脱毒生肌、利水消肿等功效,在治疗骨骼肌减少症中发挥重要作用[7]。已有临床试验证实,黄芪可增加老年人肌肉质量、力量及活动能力[8]。现代药理研究发现,黄芪在抗氧化、增强免疫以及抗衰老方面具有良好效果[9-10],其主要生物活性成分黄芪多糖对骨骼肌成肌细胞具有增殖作用[11]。
由于黄芪活性成分多、作用靶点复杂,因此仅通过临床试验和基础研究并不能阐明黄芪治疗骨骼肌减少症的关键靶点及其作用机制。故本研究运用网络药理学方法,通过构建“药物-活性成分-靶点-疾病”的拓扑网络结构,分析黄芪治疗骨骼肌减少症的有效靶点、作用信号通路和生物学功能,探究黄芪治疗骨骼肌减少症的作用机制。
1 研究方法
1.1 黄芪有效活性成分筛选及作用靶点预测使用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http://tcmspw.com/tcmsp.php)筛选黄芪的活性成分,以药物的口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug like,DL)≥0.18为筛选条件,将筛选出的活性成分与其潜在作用靶点进行配对,并通过Uniprot 数据库将靶点蛋白转换为基因名称,删除重复项及无法转换的靶点,得到黄芪主要活性成分作用靶点。
1.2 骨骼肌减少症靶点预测以“Sarcopenia”为搜索词,在美国国立生物中心(The National Center for Biotechnology Information,NCBI)GEO 数 据 库(https://www.ncbi.nlm.nih.gov/geo)搜索已公布的人类骨骼肌减少症的基因芯片数据集。本研究使用GSE1428 数据集[12],该数据集基于GPL96 平台[HG-U133A]Affymetrix Human Genome U133A Array,包括10位年轻受试者(19~25岁)和12位年龄较大受试者(70~80岁)的股外侧肌的整体基因表达谱。
将GSE1428 数据集中的数据分组后使用GEO自带的GEO 2R 分析工具进行分析,利用R 语言limma[13]工具包输出同时满足|log2 fold change(log2FC)|>1 且P<0.05 的差异表达基因,然后根据相应平台文件对应的R语言hgu133a.db包将探针名转化为基因名。以“Sarcopenia”为搜索词,在人类基因数据库(the human gene database,GeneCards,https://www.genecards.org)中检索骨骼肌减少症的相关靶点,与GEO 数据库获取的基因进行合并,删除重复项。
1.3 构建共同靶点的蛋白互作网络采用STRING在线数据库(https://string-db.org),将疾病与药物交集靶点进行蛋白-蛋白互作网络(proteinprotein interactions,PPI)分析。使用Cytoscape中“Network analyzer”插件对PPI 网络进行拓扑学分析,得到节点的度值(Degree),根据度值大小确定核心靶点。
1.4 “药物-活性成分-靶点-疾病调控”网络构建使用Cytoscape 3.7.2软件构建“药物-活性成分-靶点-疾病”调控网络。应用“Network analyzer”插件分析网络拓扑参数,得出上述网络中节点的度值,根据度值大小确定重要活性成分及靶点。
1.5 活性成分与靶点蛋白的分子对接验证从PDB 数据库下载关键靶点蛋白3D 结构,从TCMSP平台下载主要活性成分MOL2文件,然后使用PyMOL软件对关键靶点蛋白进行去水、加氢等操作,通过AutoDockTools 1.5.6 及AutoDock Vina 软 件 进行分子对接,记录结合能。
1.6 基因本体论(gene ontology,GO)、京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)富集分析利用DAVID 数据库(https://david.ncifcrf.gov)对核心靶点进行GO分析,探寻黄芪治疗骨骼肌减少症的生物功能;通过KEGG 通路富集分析,探究黄芪治疗骨骼肌减少症的主要信号通路,以P<0.05为筛选标准。
2 结果
2.1 黄芪有效活性成分筛选及作用靶点预测从TCMSP共检索获得黄芪活性成分87个,按照OB≥30%与DL≥0.18 进行筛选后,最终获得黄芪有效活性成分17个。见表1。

表1 黄芪有效活性成分
2.2 骨骼肌减少症的潜在作用靶点预测通过R 语言3.6.2 软件将GSE1428 数据集进行归一化处理,利用limma 包对骨骼肌减少症和正常肌肉组织数据进行差异表达分析,最终得到1001 个差异基因;从GeneCards 中共检索出骨骼肌减少症作用靶点192 个;剔除重复靶点共获得骨骼肌减少症相关基因靶点1057个。
2.3 黄芪治疗骨骼肌减少症潜在作用靶点预测从TCMSP 数据库中查找黄芪有效活性成分对应的靶点蛋白并剔除重复、无效靶点,得到黄芪有效活性成分的作用靶点155个。GEO差异基因分析及GeneCards 数据库中获得骨骼肌减少症的相关靶点1057个,使用在线Venny平台获得黄芪与骨骼肌减少症的药物-疾病交集靶点共36个。见图1。
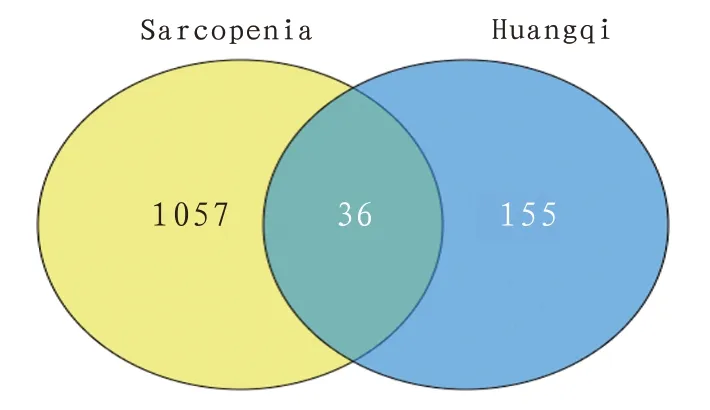
图1 药物-疾病交集靶点韦恩图
2.4 药物-活性成分-靶点-疾病调控网络构建网络中节点大小与颜色深浅代表该节点度值的大小,度值越大节点越大、颜色越深。该网络中度值排名前5位的化合物分别是HQ2[槲皮素(quercetin)]、HQ14[华良姜素(jaranol)]、HQ12[联苯双酯(bifendate)]、HQ8[7-O-甲基莫诺苷(7-O-methylisomucronulatol)]、HQ6[异鼠李素(isorhamnetin)]。见图2。
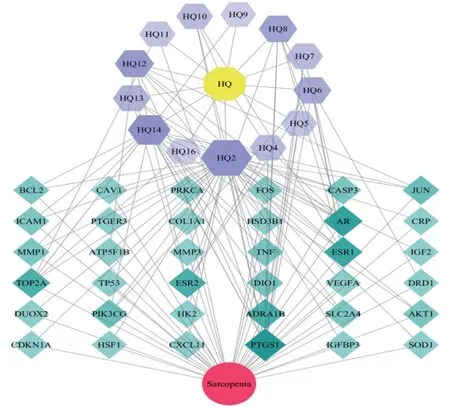
图2 药物-活性成分-靶点-疾病网络
2.5 PPl网络构建及网络拓扑分析通过STRING数据库将36 个交集靶点以最低要求互动得分(minimum required interaction score)0.7 为筛选参数,共得到198对蛋白互作关系,涉及35个蛋白靶点。采用Cytoscape 软件构建“活性成分-靶点”PPI 网络,通过“Network Analyzer”工具分析网络中节点度值,根据度值排序确定核心靶点。度值≥10 的蛋白基因靶点在PPI 网络中起关键作用,可以认为是黄芪有效成分调控骨骼肌减少症的关键基因。见表2、图3。
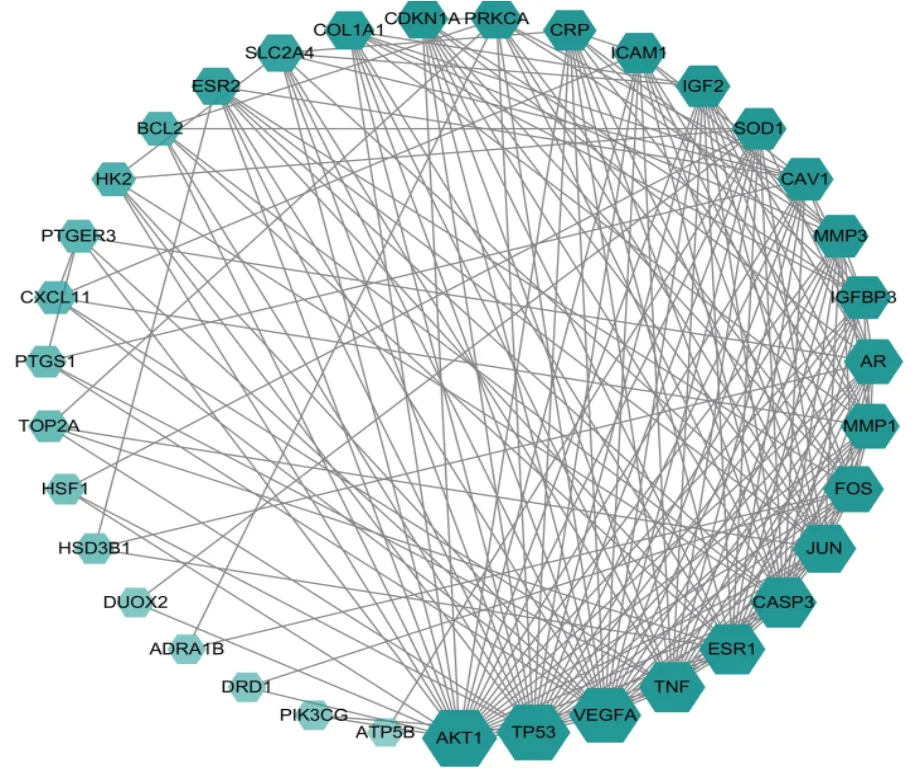
图3 药物-疾病靶点基因PPI网络

表2 药物-疾病核心靶点基因
2.6 活性成分与靶点蛋白的分子对接验证选择度值排名前5 的活性成分与靶点基因进行分子对接验证。使用AutoDock 软件进行结合能力预测,其中构象越稳定则结合能越低,通常结合能<0 kcal/mol 提示分子间具有结合活性,结合能<-5.0 kcal/mol提示分子间具有较强的结合活性[14]。将5种活性成分与5个靶蛋白对接后发现槲皮素、华良姜素、异鼠李素、7-O-methylisomucronulatol及联苯双酯与Akt1、TP53、VEGFA、TNF及ESR1均有较好的结合能力。使用PyMOL 软件对靶点蛋白与成分对接的最佳构象进行可视化分析,直观展示其构象关系,以MOL000098为例。见表3、图4。
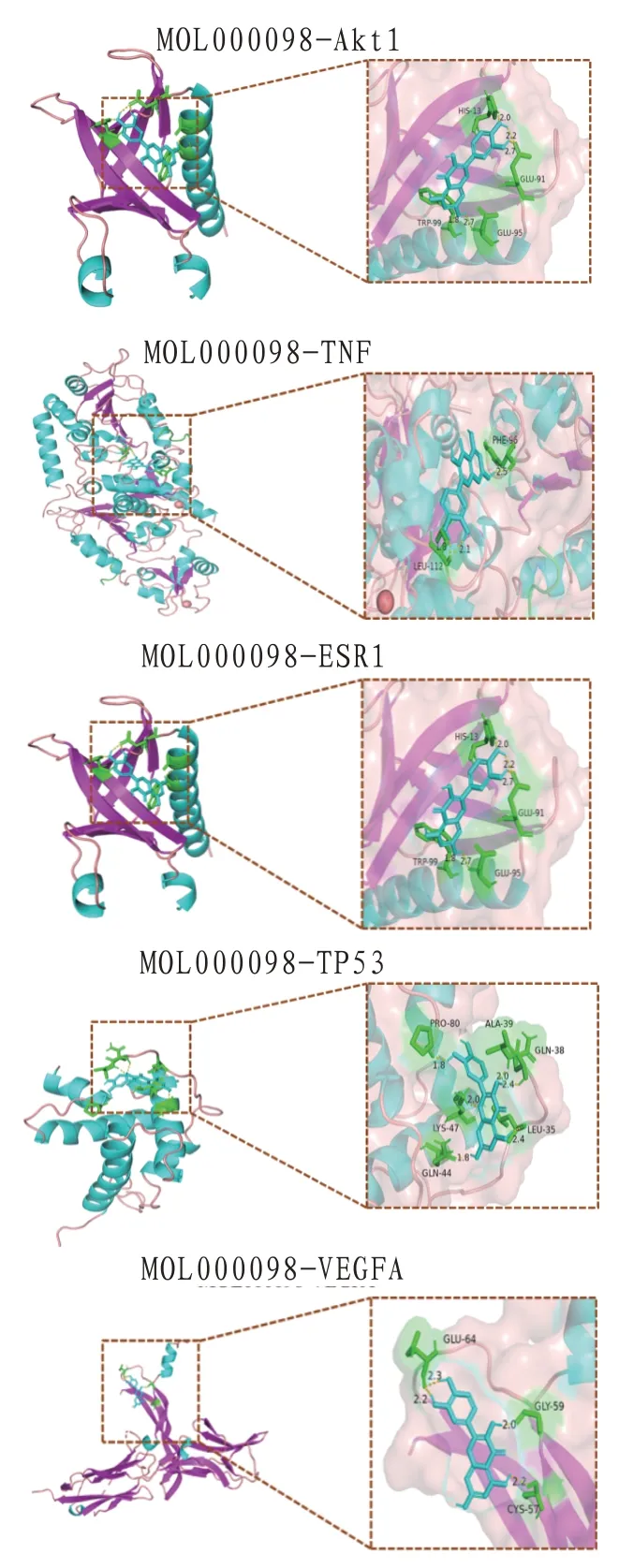
图4 MOL000098与关键基因分子对接模式图
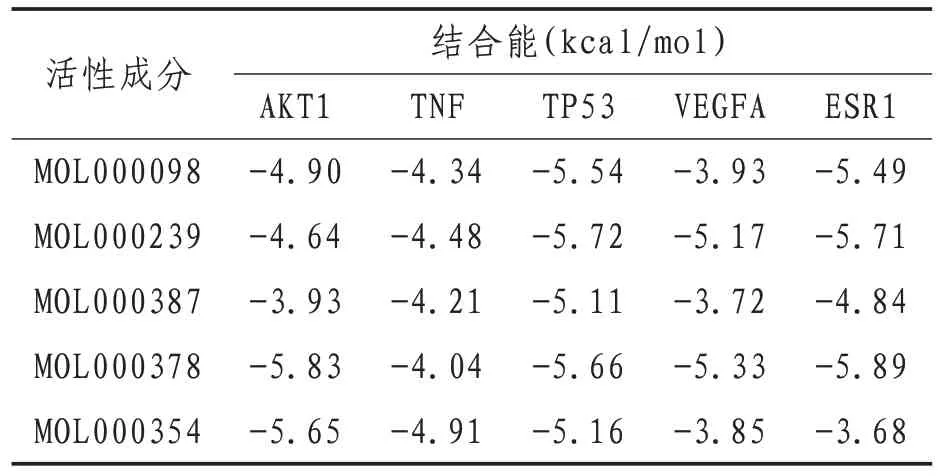
表3 活性成分与关键基因分子对接结果
2.7 GO富集分析将36个交集靶点基因上传到David 在线数据库进行GO 富集分析,得到具有统计学意义(P<0.05)的GO富集条目共164条,其中生物学进程(biological process,BP)条目125条,细胞组分(cellular component,CC)条目11 条,分子功能(molecular function,MF)条目28 条。结果显示靶点基因主要参与的BP 包括炎症反应(inflammatory response)、凋亡过程的正调控(positive regulation of apoptotic process)、细胞对缺氧的反应(cellular response to hypoxia)、内皮细胞增殖的正向调控(positive regulation of endothelial cell proliferation)、细胞衰老(cell aging)等;靶点基因主要参与的CC 包括细胞核(nucleus)、细胞质膜(plasma membrane)、细胞溶质(cytosol)、核浆(nucleoplasm)、细 胞 外 区 域(extracellular region)等;参与的MF 主要包括蛋白质结合(protein binding)、蛋白质均二聚活性(protein homodimerization activity)、转运活性(transporter activity)、过氧化物酶体增殖物激活受体结合(peroxisome proliferator activated receptor binding)、肌动蛋白结合(actin binding)、生长因子活性(growth factor activity)、蛋白磷酸酶抑制剂活性(protein phosphatase inhibitor activity)等。图5 展示了每个模块P值最小的前20 个条目,P值越小其颜色越偏向红色,反之颜色偏向蓝色;点的大小表示富集的基因数。
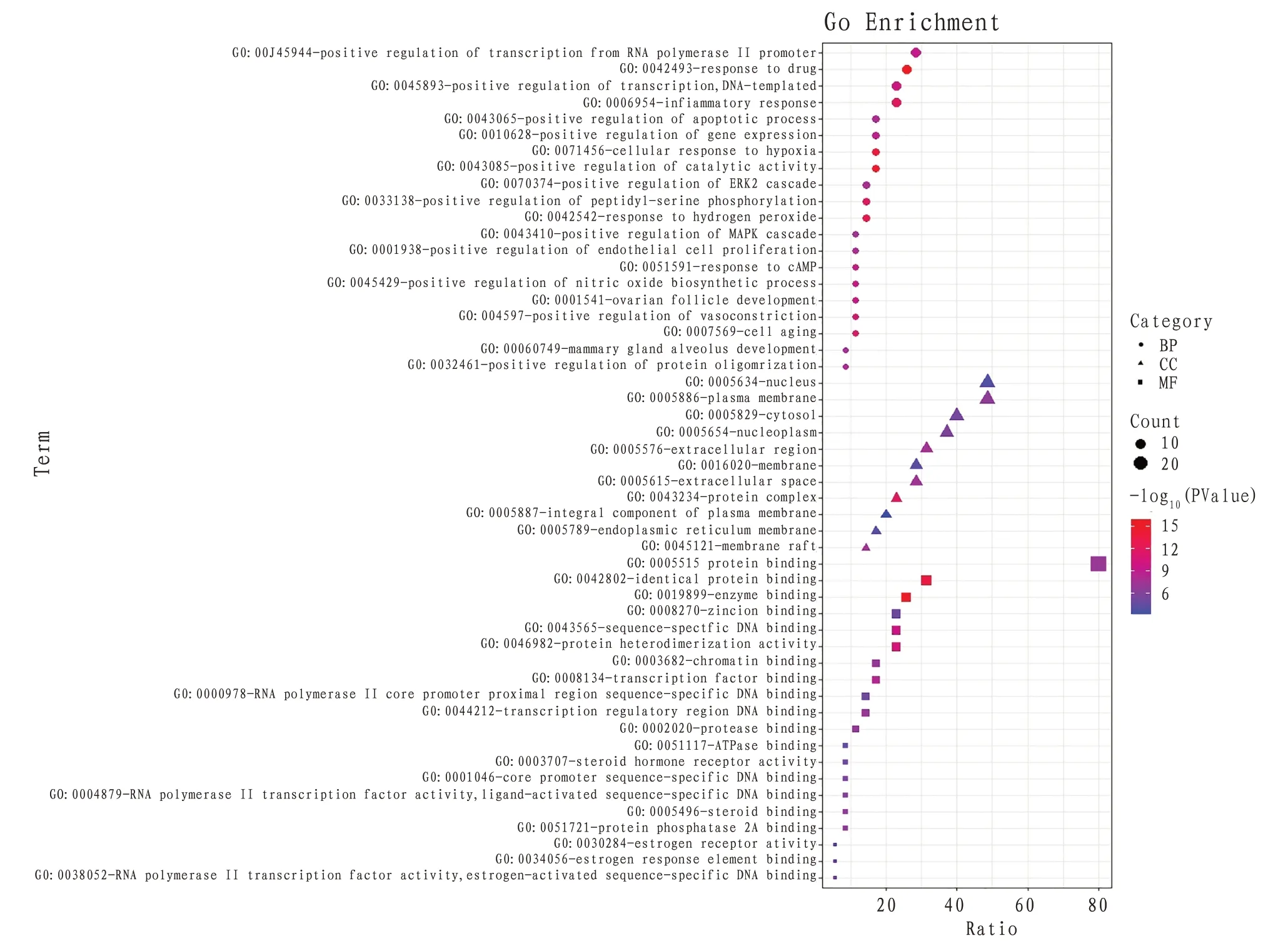
图5 GO富集分析气泡图(前20条)
2.8 KEGG 富集分析KEGG 分析显示靶点基因共富集了72 条相关通路,主要涉及癌症、肿瘤坏死因子、低氧诱导因子1、细胞凋亡、Toll 样受体等信号通路,这些通路与免疫炎症反应、骨代谢、血管生成和免疫调节相关。P值排序最小的20个条目见图6;黄芪治疗骨骼肌减少症的相关信号通路及对应靶点基因关系见图7。
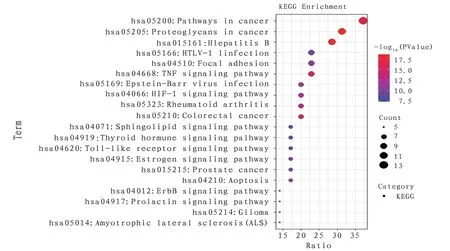
图6 KEGG富集分析气泡图(前20条)
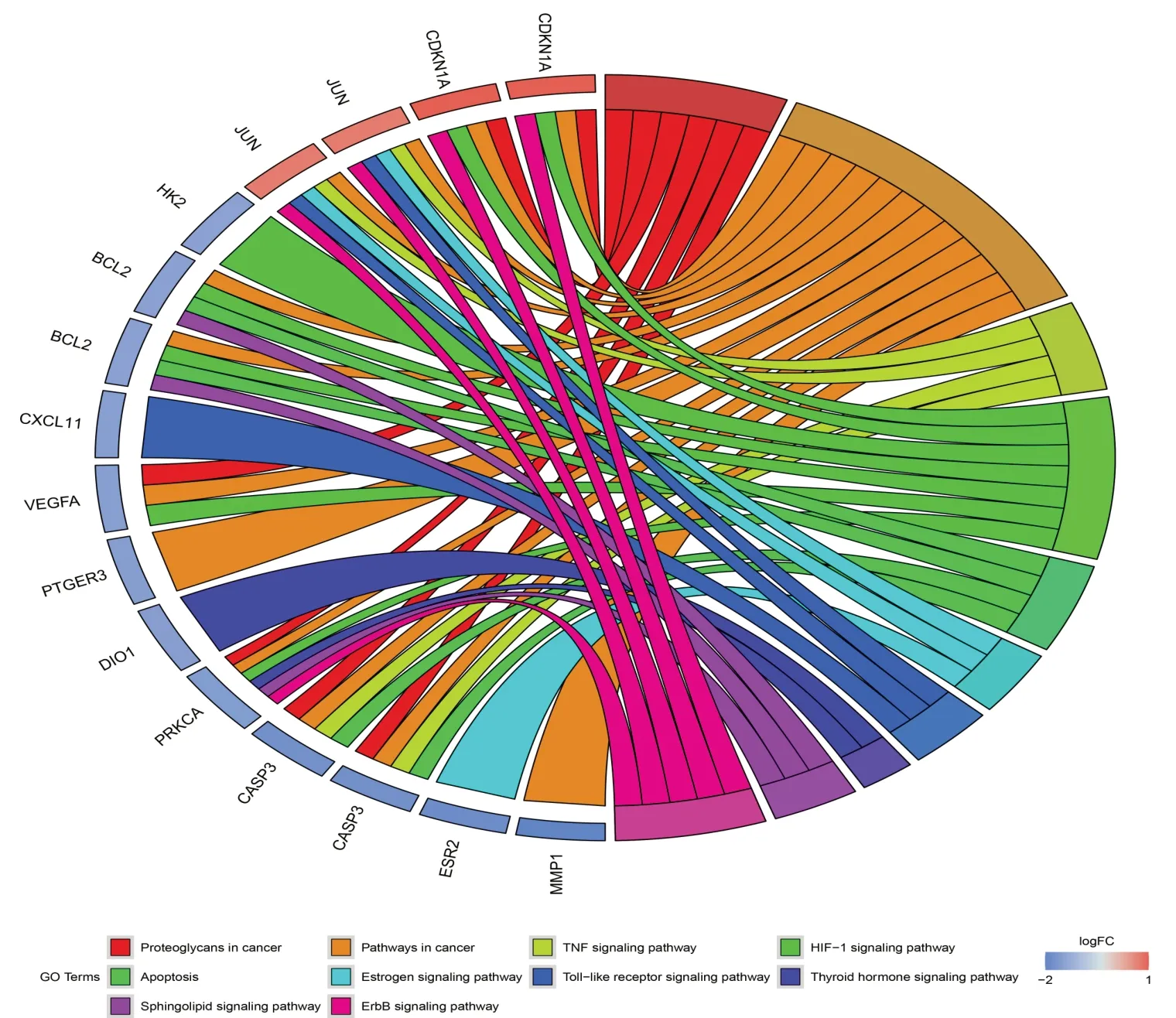
图7 药物-疾病相关信号通路及对应靶点基因关系
3 讨论
本研究通过构建及分析药物-活性成分-靶点-疾病调控网络发现,黄芪治疗骨骼肌减少症的有效活性成分包括槲皮素、华良姜素、联苯双酯、异鼠李素、三萜皂苷、山柰酚、毛蕊异黄酮等13种,这些化合物大多具有抗免疫炎症、抗氧化应激以及改善代谢紊乱作用。槲皮素是一种黄酮类化合物,具有抗氧化及抗炎作用。研究表明槲皮素可调控炎症介质TNF-α,减弱其对蛋白质的降解作用,延缓年龄相关骨骼肌减少症[15]。尽管目前有关联苯双酯治疗骨骼肌减少症的基础研究较少,但有大量研究证实联苯双酯可以降低TNF-α表达,具有调节免疫炎症和抗氧化作用[16]。三萜皂苷被证明可通过抑制NF-κB 通路减少促炎介质如一氧化碳、TNF-α、白细胞介素1β等[17];异鼠李素与三萜皂苷作用相似[18],可抑制活性氧介导的缺氧诱导因子1α积累[19];毛蕊异黄酮具有抗自噬、抗凋亡和抗炎作用,可上调B细胞淋巴瘤因子2样蛋白表达,同时抑制TNF-α表达[20]。
本研究确定了药物-疾病的交集靶点包括AKT1、P53、VEGFA、TNF、ESR1 等,GO 分析结果显示这些靶点基因主要涉及炎症反应、细胞的增殖与凋亡、氧化应激、细胞衰老等生物学过程,并影响蛋白质结合、蛋白质均二聚活性、转运活性、过氧化物酶体增殖物激活受体结合、肌动蛋白结合、生长因子活性、蛋白磷酸酶抑制剂活性等分子功能。尽管凋亡会引起肌细胞的氧化损伤和肌纤维萎缩,但这一生物学过程在降解受损炎性细胞、缓解组织损伤、恢复组织完整性等方面发挥积极作用[21]。研究显示Akt1的激活通过调控p53正向凋亡调控因子影响下游凋亡信号传导,导致肌细胞凋亡和骨骼肌减少症的发生[22]。除在癌症中发挥作用外,p53 在细胞代谢、胰岛素抵抗、免疫炎症、骨骼肌分化和内环境稳定中也具有重要调控作用[23-24],并且几乎所有导致骨骼肌减少症的通路均与p53基因的活性相关,但说法不一。Fox等发现成年小鼠的骨骼肌纤维中p53 表达可引起肌萎缩,提示p53 可能是诱导年龄相关骨骼肌减少的关键基因[25]。另有研究表明p53 有助于维持骨骼肌线粒体功能,可能在预防骨骼肌萎缩中发挥作用[26]。以上表明黄芪可能通过双向良性调节来延缓骨骼肌减少症的发生。
微循环在肌肉可塑性、修复和再生中发挥重要作用。VEGFA 作为维持血管形态和完整性的重要基因,可促进内皮细胞增生、迁移,并使血管通透性增加[27]。研究发现,VEGF 表达的降低可引起老年人毛细血管稀疏和血管生成减弱,阻断VEGF会影响骨骼肌微血管生成,改变局部微循环,阻碍肌肉的修复与再生[28]。此外,VEGF 还可与Flk-1和Flt-1 受体结合直接刺激肌卫星细胞迁移并抑制肌卫星细胞凋亡,起维持骨骼肌稳态和促进骨骼肌再生的作用[29]。促炎细胞因子TNF-α 与骨骼肌减少症的相关机制研究主要围绕泛素-蛋白酶体系统,它可通过增加atrogin-1 和MuRF1 表达,激活泛素-蛋白酶体介导的肌纤维溶解[30]。TNFα还通过调控血管内皮细胞黏附因子引起蛋白代谢失衡[31],或通过激活κB 激酶抑制剂诱发胰岛素抵抗[32]等机制加速骨骼肌萎缩。同时,骨骼肌减少症的发展还与衰老引起的性腺功能减退及性激素分泌减少有关[33]。本研究证实黄芪活性成分可通过调控ESR、AR等性激素受体发挥治疗作用。
黄芪调控的另一个关键疾病靶点基因为CDKN1A,CDKN1A受抗癌药物、DNA损伤、p53和p73、氧化应激、细胞因子和生长因子等多种因素和途径调控[34]。研究证实,CDKN1A 蛋白在老年动物肌细胞中表达增加,可降低肌卫星细胞增殖率[35]。作为JAK/STAT 信号通路成员,JUN 在骨骼肌减少症中呈高表达,其作用机制可能与负调控骨骼肌细胞增殖有关[36]。作为细胞外基质降解的重要蛋白,MMP1、MMP3 在差异分析中呈低表达。研究发现,增龄引起的细胞外基质降解减慢和胶原过度沉积也是骨骼肌减少症发生的重要机制,而通过上调MMP 表达,可恢复细胞外基质的正常降解速率,改善骨骼肌质量和功能[37]。
KEGG 富集分析结果显示靶点基因富集最多的信号通路为癌症通路,此通路是HIF-1、VEGF、凋亡、p53、JAK-STAT、MAPK、TGF-β等信号通路的交汇通路,可调控骨骼肌增殖、氧化应激及免疫炎症、分化、转化、细胞凋亡等多种生物过程,在骨骼肌减少症的发生与发展中具有重要作用。HIF-1信号通路活性的调控机制受活性氧和氮氧化物等多种因素影响,在骨骼肌细胞凋亡和自噬过程中同样发挥重要作用[38]。通过激活调节葡萄糖转运和糖酵解基因,HIF-1 还可提高肌细胞对缺氧的适应性,并增强VEGF及其受体表达,以应对氧供应减少[39]。研究表明,在暴露于严重的低压低氧前10 min抑制HIF-1转录因子,可减轻骨骼肌损伤[40]。
综上所述,本研究结果证实黄芪通过“多靶点”“多途径”调控细胞衰老和凋亡过程,改善局部微循环,降低细胞外基质降解速度,减轻慢性炎症及氧化应激损伤来延缓骨骼肌萎缩,这可为今后黄芪治疗骨骼肌减少症的基础研究及临床治疗提供新思路。

