不同乳酸菌接种发酵对泡白菜理化特征及风味的影响
史梅莓,伍亚龙,吕鹏军,汪冬冬,张其圣,*
1(四川省食品发酵工业研究设计院有限公司,四川 成都,611130)2(四川益动源生物科技有限公司, 四川 眉山,620000)3(四川东坡中国泡菜产业技术研究院,四川 眉山,620000)
泡菜是我国典型的传统发酵食品,因其地区、原料、制作方式等的不同,形成了各具特色的产品,如四川洗澡泡菜、涪陵榨菜、东北酸菜、朝鲜族泡菜等,品种繁多,风味各异,深受消费者喜爱[1]。白菜是我国的第二大蔬菜作物,国内市场消费鲜食占85%以上,加工产品多以泡白菜、东北酸菜、辣白菜为主[2],是泡菜主要原料之一。泡菜主要由乳酸菌发酵而成,乳杆菌属、明串珠菌属、魏斯氏菌属被认为是其发酵过程中的优势菌群[3-6]。随着工业化生产规模的不断扩大,人工接种发酵被认为是缩短发酵周期、稳定发酵蔬菜产品品质的有效手段[7-9]。
目前,国内外在接种发酵泡菜方面也有较多研究,接种发酵会加快泡菜pH值的下降,提高糖利用率和酸产量,不同乳酸菌发酵剂发酵泡菜的代谢产物有明显差异[10]。李凤姿等[11]研究4种乳杆菌对酸菜的接种效果,其中植物乳杆菌更适宜酸菜体系中pH的下降和乳酸的快速积累;张梦梅等[12]研究发现低温乳酸菌接种发酵泡白菜的有机酸和游离氨基酸含量更为丰富;LEE等[13]利用肠膜明串珠菌、清酒乳杆菌混合发酵辣白菜,结果发现高比例的肠膜明串珠菌进行发酵时表现出异型发酵特性,可产生甘露醇、乙酸、乳酸,乳酸菌类型和接种比例对泡菜发酵代谢产物的种类和浓度有较大影响。而在工业生产上,目前国内大多数仍然采用自然发酵或不发酵来加工白菜,使得白菜发酵风味不足、品质不稳定、产品同质化严重等。因此,为适应工业化发展需求,需利用人工接种进行白菜发酵。白菜收获季节多集中在秋冬季,因此本研究设定15 ℃为发酵温度,植物乳杆菌、肠膜明串珠菌、柠檬明串珠菌、食窦魏斯氏菌、清酒乳杆菌、短乳杆菌等是泡菜中常见的不同发酵阶段的优势菌,选择上述菌作为发酵菌株,研究不同乳酸菌接种发酵对泡白菜风味品质的影响,以期为后续白菜类泡菜发酵剂的开发奠定基础。
1 材料与方法
1.1 材料与试剂
白菜(Brassicarapavar.glabraRegel)、食盐,购于成都当地某农贸市场;植物乳杆菌(Lactobacillusplantarum) PC295、肠膜明串珠菌(Leuconostocmesenteroides) PC137、柠檬明串珠菌(Leuconostoccitreum) PC222、食窦魏斯氏菌(Weissellacibaria) PC311、清酒乳杆菌(Lactobacillussakei) PC229、短乳杆菌(Lactobacillusbrevis)PC330,四川省食品发酵工业研究设计院有限公司菌种保藏实验室;NaCl、NaOH、邻苯二甲酸氢钾,成都市科隆化学品有限公司;3,5-二硝基水杨酸、无水对氨基苯磺酸、亚铁氰化钾,成都市科龙化工试剂厂;N-1-萘乙二胺盐酸盐,天津市化学试剂研究所有限公司;有机酸(乳酸、乙酸、苹果酸、柠檬酸)标准品、17种氨基酸标准品,美国Sigma公司;MRS肉汤培养基,广东环凯微生物科技有限公司;结晶紫中性红胆盐琼脂、孟加拉红培养基,北京奥博星生物技术有限责任公司。
1.2 仪器与设备
GCMS-TQ8040气相色谱质谱联用仪、LC-2030 高效液相色谱分析仪,日本岛津仪器公司;VF-WAXms(60 m×0.25 mm,0.25 μm)色谱柱,美国安捷伦公司;ESJ200-4A电子天平,沈阳龙腾电子有限公司;XH-B旋涡混合器,江苏天翎仪器有限公司;LDZF-75L-II立式压力蒸汽灭菌器,上海申安医疗器械厂;BSP-150生化培养箱,上海博讯实业有限公司医疗设备厂;SW-CJ-1FD洁净工作台,苏州安泰空气技术有限公司;PHSJ-3F型pH计,上海仪电科学仪器股份有限公司;LC-MS-M1磁力搅拌器,上海力辰邦西仪器科技有限公司;TG-16高速离心机,四川蜀科仪器有限公司;DW-86L338 J超低温保存箱,青岛海尔生物医疗股份有限公司。
1.3 实验方法
1.3.1 发酵剂制备
6株乳酸菌分别接种于MRS液体培养基,37 ℃静置培养18 h(菌体浓度约为108~109CFU/mL),6 000 r/min离心5 min后弃去上清液,用同体积的无菌生理盐水(8.5 g/L NaCl)洗涤2次后重悬备用。
1.3.2 泡菜的制作及取样
泡白菜的制备:将洗净的白菜沥干,切成2 cm×2 cm小方块,装入2 L玻璃坛中;然后向坛中加入烧开后已冷却的食盐水,再分别加入重悬后的菌液,菜和水的质量比为2∶1,食盐添加量为菜和水总质量的3.5%,接种量为2%。坛沿加水密封,置于15 ℃恒温培养箱中发酵。分别为LP组(植物乳杆菌PC295)、Leu.m组(肠膜明串珠菌PC137)、Leu.c组(柠檬明串珠菌PC222)、WC组(食窦魏斯氏菌PC311)、Ls组(清酒乳杆菌PC229)、Lb组(短乳杆菌PC330)共6个实验组,以不加菌剂为对照组(CK),每组2坛。取发酵0、1、3、5、7、9、11 d的白菜样品进行测定。
1.3.3 理化指标的测定
pH的测定按照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》;总酸的测定按照GB 12456—2021《食品安全国家标准 食品中总酸的测定》中的pH计电位滴定法,pH值8.2为滴定终点,总酸含量以乳酸计;还原糖含量参考NY/T 2742—2015《水果及制品可溶性糖的测定3,5-二硝基水杨酸比色法》进行测定。
1.3.4 微生物计数
按照GB 4789.35—2016《食品安全国家标准 食品微生物学检验乳酸菌检验》进行乳酸菌数量的测定;按照GB 4789.15—2016《食品安全国家标准 食品微生物学检验霉菌和酵母计数》进行酵母菌数量的测定;按照GB 4789.3—2016《食品安全国家标准 食品微生物学检验大肠菌群计数》进行大肠菌群数量的测定。
1.3.5 有机酸的测定
称取2 g搅碎后的样品,加入2 mL超纯水,30 min超声波处理后经10 000 r/min离心1 min,取上清液过0.22 μm水系滤膜后用于高效液相色谱分析。色谱条件:色谱柱Carbomix H-NP10:8%(10 μm,7.8 mm×300 mm),流动相A为10 mmol/L H2SO4,柱温55 ℃,流速0.6 mL/min,进样量10 μL,检测器UV 210 nm。
1.3.6 游离氨基酸的测定
参考汪冬冬等[14]的方法,取100 μL氨基酸标准品或经离心后的样品上清液置于5 mL试管中,加入200 μL衍生试剂(1 600 μL乙腈、200 μL三乙胺和20 μL异硫氰酸苯酯),涡旋混合20 s后放置60 min;然后加入2 mL水和1 mL正己烷,涡旋混合1 min后除去上层溶液,再次加入1 mL正己烷后涡旋混合1 min,静置10 min后取下层溶液过0.22 μm水系滤膜用于高效液相色谱分析。色谱柱:月旭Ultimate Amino Acid(5 μm,4.6 mm×250 mm),流动相A:V(0.1 mol/L醋酸钠, pH 6.50)∶V(乙腈)=93∶7,流动相B:V(水)∶V(乙腈)=20∶80,柱温40 ℃,流速1.0 mL/min,进样量10 μL,检测器UV 210 nm。
1.3.7 挥发性风味物质分析
样品处理和检测条件[14]:取切碎后的泡白菜样品2 g和5 μL内标(4-甲基-2-戊醇甲醇溶液,质量浓度为0.4 μg/mL)加入15 mL顶空进样瓶中,混匀密封置于40 ℃恒温槽中水浴加热平衡30 min,将老化后的固相微萃取(solid-phase microextraction,SPME)萃取头(规格为2 cm,50/30 μm)插入到顶空进样瓶中吸附30 min,于250 ℃解析5 min,每个样品独立测定2次。GC条件:不分流进样模式;进样温度40 ℃;进样口温度250 ℃;总流量50 mL/min;载气He;载气流量1.2 mL/min。柱温:40 ℃(0 min),以16 ℃/min到75 ℃ (保持0 min),以2 ℃/min到94 ℃(保持1 min),以2 ℃/min到110 ℃(保持1 min),以3 ℃/min到122 ℃(保持1 min),以2 ℃ /min到130 ℃(保持1 min),以2 ℃/min到136 ℃(保持1 min),以2 ℃/min到143 ℃(保持1 min),以6 ℃/min到200 ℃(保持5 min)。MS条件:电子离子源(EI),电子能量70 eV,离子源温度230 ℃;接口温度250 ℃;检测器电压0.1 kV;Scan采集方式,扫描质量范围m/z35.00~350.00。
定性和定量分析:色谱峰对应的质谱与NIST17、FFNSC1.3谱库检索对比,保留匹配度>80%的鉴定结果,得到各挥发性风味物质。采用4-甲基-2-戊醇甲醇溶液为内标进行半定量分析,响应值都设为1,计算出各组分的质量浓度。
1.4 数据处理
采用Excel 2019进行数据统计分析,Origin 2018软件进行绘制结果图,SIMCA14.1软件进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 pH与总酸的变化
如图1所示,各组pH在0~3 d呈快速下降趋势,然后缓慢下降逐渐趋于稳定,总酸逐渐增加。到发酵结束时,各组pH和总酸差异较大,其中LP、Lb两组pH值低于CK组,分别为3.30、3.61和0.44,且总酸最高(0.38 g/100 g);WC、Ls两组总酸增加最为缓慢,分别为0.16、0.17 g/100 g。Leu.m组在第5天后总酸不再增加,出现略下降趋势,这是由于乳酸的不断积累,pH逐渐降低,第5天时pH值降至3.96,而该菌株对酸的耐受能力较差,生长受到抑制,也有研究报道乳酸菌等微生物因其抗逆性,在高酸环境下会消耗乳酸以克服乳酸胁迫[15],所以发酵后期总酸不再增加。泡菜类发酵蔬菜在自然发酵过程中,以明串珠菌属为优势菌属启动发酵,随着发酵的进行,乳杆菌属、魏斯氏菌属等逐渐在发酵中期占主导,乳酸不断积累,微生物多样性下降,发酵后期以耐酸性较强的乳杆菌属为优势菌属[3, 16]。由此可知,不同种类的乳酸菌,其发酵白菜的产酸量和发酵速度不同。
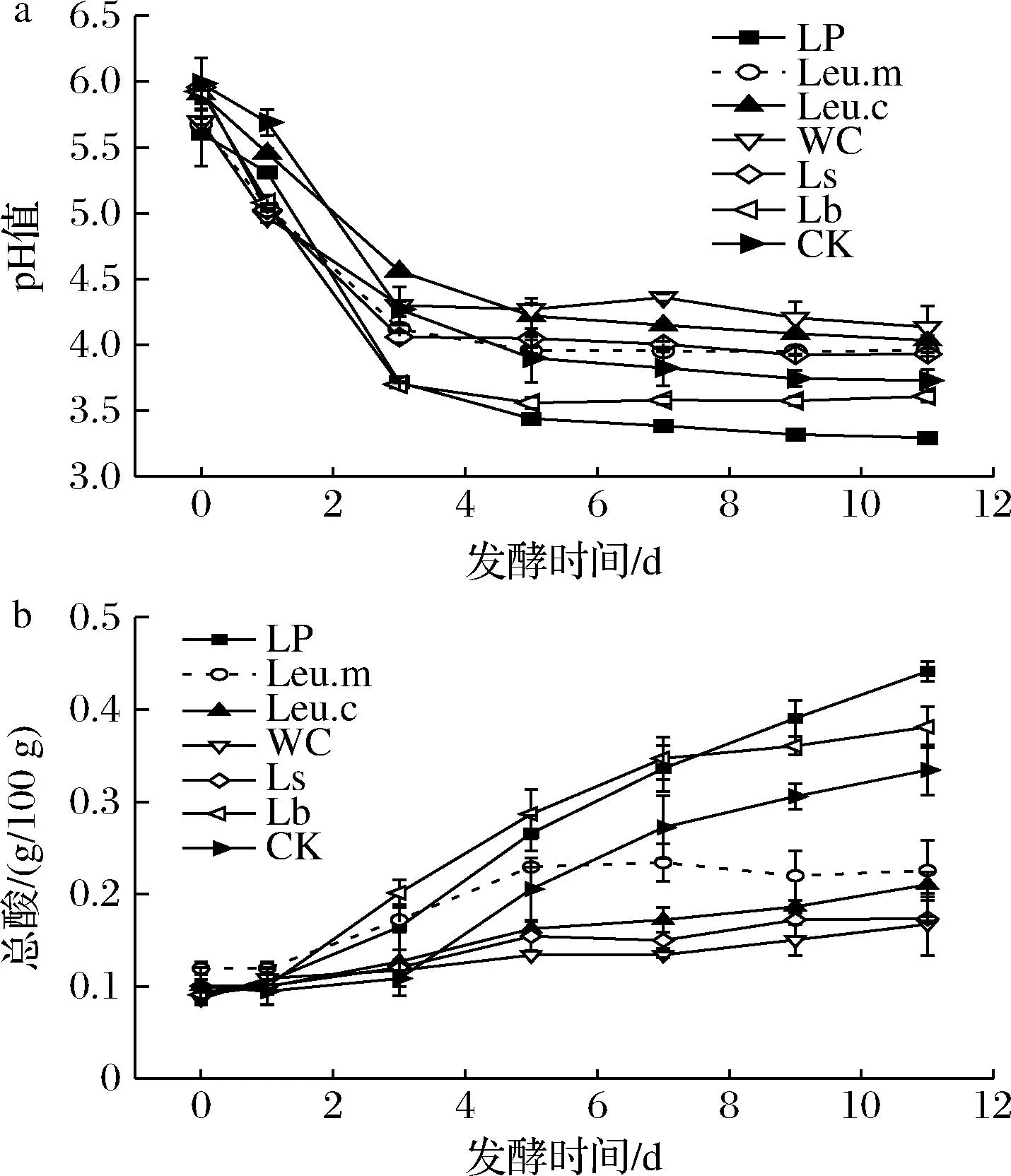
a-pH值;b-总酸图1 发酵过程中泡白菜pH和总酸的变化Fig.1 Changes in pH and total acid of Chinese cabbage pickles during fermentation
2.2 还原糖含量分析
还原糖是微生物生长优先消耗的碳源。如图2所示,随着发酵的进行,各组泡菜中的还原糖含量呈快速下降趋势,第7天后逐渐趋于稳定。发酵过程中多糖不断溶出到发酵液并被水解为还原糖,乳酸菌消耗还原糖代谢产酸,发酵后期微生物受到酸胁迫生长代谢受到抑制,从而出现还原糖含量趋于稳定[17]。到发酵结束时,各组还原糖含量高低为WC>Ls>Leu.m>Leu.c>LP>CK>Lb,其中,WC组还原糖含量降低了55.06%,Lb组还原糖含量降低了87.89%,表明不同菌株利用白菜中还原糖进行生长代谢的能力不同。

图2 发酵过程中泡白菜还原糖含量的变化Fig.2 Changes in reducing sugar content of Chinese cabbage pickles during fermentation
2.3 微生物数量分析
微生物的种类、数量及其代谢类型对发酵蔬菜风味物质的形成有重要影响。如图3-a所示,各接菌组、对照组泡菜的初始乳酸菌数量分别为7~7.5 lg CFU/mL、4.02 lg CFU/mL。在发酵早期,泡菜处于弱酸性和较少厌氧条件下,除LP组外,其余组乳酸菌数量增加;第3天,CK组数量快速上升至7.54 lg CFU/mL,而Leu.m、WC两组乳酸菌数量开始下降,可能与肠膜明串珠菌和食窦魏斯氏菌耐酸性较差有关。XIANG等[18]接种食窦魏斯氏菌发酵泡菜,2 d后泡菜中的乳酸菌数量开始下降,与该结果较为相似。第7天后,在酸性和严格的厌氧条件下,LP组乳酸菌数量快速增加,而Lb、CK两组乳酸菌数量开始下降,可能是白菜中的糖类物质被大量消耗,无法满足乳酸菌生长需求,导致发酵后期乳酸菌数量下降;Leu.c、Ls两组在发酵过程中乳酸菌数量总体增加。
由图3-b可知,各组酵母菌数量总体呈先下降后缓慢上升趋势。发酵结束时,对照组和Leu.c组酵母菌数量较高,分别为3.56 lg CFU/mL、3.15 lg CFU/mL,而其余组低于3.0 lg CFU/mL。酵母菌在发酵蔬菜中可代谢糖类、多种氨基酸,产生醇类、芳香化合物等,适量的酵母菌有利于增加发酵蔬菜的风味[19]。
大肠杆菌是食品污染程度的重要参数指标。由图3-c可知,随着发酵的进行,各接菌组大肠杆菌数量总体呈下降趋势,而CK组在0~5 d大肠杆菌数量增加。LP、Lb两组在第5天后未检出大肠杆菌,WC组到发酵结束时大肠杆菌数量为3.64 lg CFU/mL。乳酸菌在代谢过程中会产生有机酸、细菌素、多糖等,这些物质对致病菌、腐败菌等具有一定的抑制和清除作用[20]。因此,可能接种植物乳杆菌和短乳杆菌的泡菜其较强的酸性环境有效地抑制了大肠杆菌的生长,而食窦魏斯氏菌在整个发酵过程中生长缓慢,代谢产物对抑制大肠杆菌的效果较差。
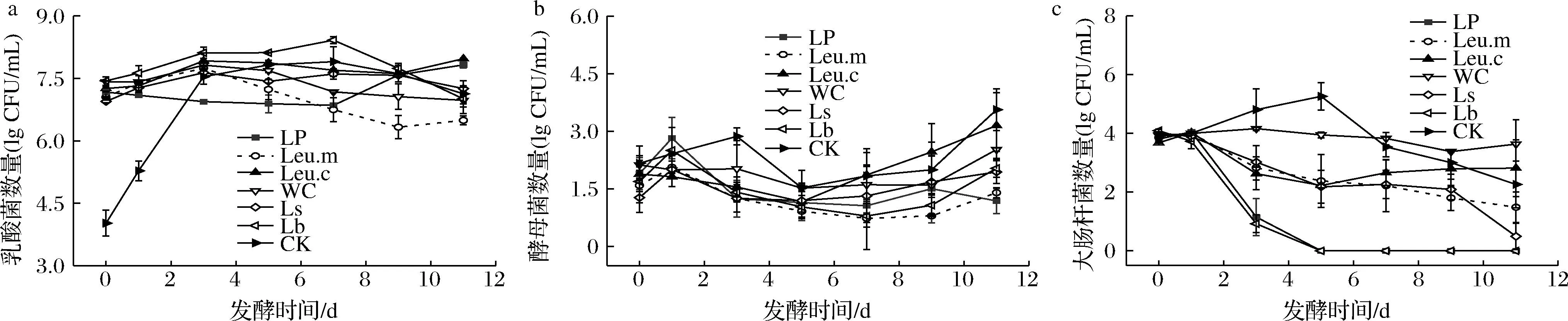
a-乳酸菌;b-酵母菌;c-大肠杆菌图3 发酵过程中泡白菜乳酸菌、酵母菌以及大肠杆菌数量的变化Fig.3 Changes in the number of lactic acid bacteria, yeast, and Escherichia coli in Chinese cabbage pickles during fermentation
2.4 有机酸和乙醇分析
如图4所示,泡菜发酵过程中有机酸主要以乳酸、乙酸、柠檬酸以及苹果酸为主,随着发酵的进行,柠檬酸和苹果酸被微生物大量消耗利用,第3天后柠檬酸被消耗殆尽,第7天后各组苹果酸逐渐被消耗完全,其中Leu.m组消耗苹果酸最少,苹果酸是生物体代谢三羧酸循环的中间体,随着发酵的进行逐渐被分解为乳酸等物质[21],可能是肠膜明串珠菌在发酵中后期数量持续降低,因此相较于其他组,Leu.m组苹果酸消耗缓慢。各组在发酵过程中不断积累大量乳酸和少量乙酸,乳酸可以赋予泡菜柔和的酸味,乙酸主要由乳酸菌的异型发酵产生,可以促进风味的形成[22]。发酵结束时,乳酸和乙酸含量高低分别为LP>Lb>CK>Ls>Leu.m>Leu.c>WC和Lb>CK>Leu.c>Leu.m>WC>Ls>LP。有研究表明泡菜中有机酸产生的越多,发酵速度越快[23],因此LP、Lb两组的发酵速度优于其他组。
在发酵蔬菜中,乙醇可以和酸类物质结合生成酯类,增加发酵蔬菜的风味[24]。由图4-e可知,除Lb 组外,其余组乙醇含量先呈增加趋势,3 d后趋于稳定,发酵前期异型发酵菌和蔬菜表面携带酵母菌迅速繁殖并代谢产生乙醇,使其含量增加,到发酵中后期耐酸性较差的菌株生长代谢受到抑制,使得乙醇含量趋于稳定[25]。而Lb 组乙醇含量0~7 d处于上升趋势,7 d后趋于稳定,且其含量明显高于其他组,可能是一部分来源于少量酵母菌产乙醇,而另外一部分来源于短乳杆菌的异型发酵,有研究表明短乳杆菌能够通过磷酸酮醇酶途径分解碳水化合物,产生一定量的乳酸、乙酸和乙醇[26],且该菌株具有一定的耐酸性,在0~7 d不断的积累乙醇,而在7 d后其数量开始下降,使得其含量趋于稳定。

a-乳酸;b-乙酸;c-柠檬酸;d-苹果酸;e-乙醇图4 发酵过程中泡白菜有机酸、乙醇的变化Fig.4 Changes in organic acids and ethanol of Chinese cabbage pickles during fermentation
2.5 游离氨基酸分析
游离氨基酸是食品中重要的滋味物质,分析中17种游离氨基酸可分为4类,即鲜味(Glu、Asp)、甜味(Gly、Ala、Ser、Thr)、苦味(Arg、His、Leu、Ile、Met、Phe、Val、Pre、Lys)、无味(Cys、Tyr)[27]。如图5所示,随着发酵的进行,各组氨基酸总量整体呈下降趋势,到发酵结束时,接菌组的氨基酸含量低于对照组。氨基酸对于乳酸菌的生长代谢至关重要,说明接菌发酵消耗泡菜中的氨基酸更多,尤其是LP组。氨基酸也是风味物质形成的前体物,在转氨酶的作用下转化为α-酮酸,α-酮酸是风味形成的中间体,再经过特定的酶催化或化学反应,转化为相应的醛、醇、羧酸等物质[28]。
在4类氨基酸中,以苦味氨基酸含量最高,但其阈值较高,对泡菜滋味的形成贡献较小。其中精氨酸、赖氨酸被大量消耗(图5-b、图5-c),相较于其他接菌组,WC、Lb两组中的精氨酸含量降低最快。精氨酸是泡菜发酵中细菌生长的重要营养来源,可以通过参与精氨酸酶途径和精氨酸脱亚胺酶途径转化为二氧化碳、氨、瓜氨酸、鸟氨酸等物质,对细菌在酸性条件下的生长和适应性有重要影响[29-30]。HWANG等[30]研究分离自泡菜的7种乳酸菌对精氨酸的分解代谢,结果表明短乳杆菌和融合魏斯氏菌培养基中的精氨酸含量显著降低,这与不同菌代谢途径中的精氨酸脱亚胺酶、鸟氨酸转羧基酶、氨基甲酸激酶等有重要关系。此外,精氨酸、赖氨酸可能通过各种酶转化为腐胺、尸胺等生物胺,生物胺在发酵蔬菜中可能存在安全隐患,但生物胺的形成与微生物的种类、代谢途径中的酶的表达能力等多种因素有关[31]。甜味氨基酸在泡白菜中占有较高比例,均以丙氨酸、丝氨酸为主。由图5-d、图5-e可知,到发酵结束时,LP组丙氨酸和丝氨酸含量最低。丙氨酸可以在丙氨酸转氨酶作用下生成丙酮酸,然后进入三羧酸循环被彻底氧化分解或用于合成脂肪酸、氨基酸等[29]。谷氨酸、天冬氨酸对泡菜的鲜味有重要的影响[32],到发酵结束时,Lb组谷氨酸消耗最少(图5-f)。无味氨基酸则只在发酵初期含量较高。综上所述,6组接菌组中,植物乳杆菌接种发酵泡菜会大量消耗精氨酸、丙氨酸、丝氨酸、谷氨酸等;清酒乳杆菌和短乳杆菌接种发酵泡菜分别是甜味和鲜味氨基酸略高于其他组。可见,乳酸菌种类的不同,导致了泡菜中不同氨基酸的分解代谢存在较大差异。

a-氨基酸含量;b-精氨酸含量;c-赖氨酸含量;d-丙氨酸含量;e-丝氨酸含量;f-谷氨酸含量图5 发酵过程中泡白菜游离氨基酸的变化Fig.5 Changes of free amino acids in Chinese cabbage pickles during fermentation
2.6 挥发性风味物质分析
通过顶空固相微萃取-气质联用分析乳酸菌发酵泡白菜过程中的挥发性风味物质,如图6所示,接菌组和对照组共检测到挥发性风味物质56种,包括醇类23种,醛类16种,酸类1种,酯类3种,酮类3种,烃类5种,其他化合物5种,各组之间挥发性风味成分差异较大。
醇类物质是发酵蔬菜中重要的香气成分,可以赋予发酵蔬菜愉快的香气[24]。所有组泡菜风味成分以醇类为主,在发酵中后期,其相对含量均高于50%,主要包括乙醇、1-辛烯-3-醇、顺-2-戊烯-1-醇、叶醇、1-戊烯-3-醇等多种醇类,尤其是乙醇在发酵过程中相对含量逐渐升高,可能是乳酸菌的异型发酵不断积累和酵母菌代谢产生,其中以Lb组的醇类物质相对含量最高。醛类化合物的阈值一般较低,对发酵蔬菜的风味有较大影响,随着发酵的进行,其相对含量增加;相较于其他组,Ls、Leu.m两组的醛类物质相对含量更高,发酵产生了更多的2-己烯醛、反,反-2,4-庚二烯醛、己醛等物质,赋予泡菜果香、脂香以及蔬菜香等多种香气。酸类是以乙酸为主,其中以Lb组的乙酸相对含量最高,其次是CK组,LP、WC、Ls三组仅产生少量乙酸,适量的乙酸可以增加泡菜的酸味。各组泡菜中的酯类相对含量均呈逐渐降低趋势,酯类主要包括乙酸异戊酯、硫氰酸甲酯和3-丁烯基异硫氰酸酯3种,具有果香和强烈的辛辣风味,硫氰酸甲酯和3-丁烯基异硫氰酸酯是十字花科植物中芥子苷的水解产物,发酵过程中泡菜pH不断降低,逐渐被水解成其他化合物[33]。发酵结束时,各组酮类物质相对含量较低,但甲基庚烯酮、香叶基丙酮等可以赋予泡菜一定的果香味。烃类物质在发酵过程中相对含量减少,这类物质的香气阈值较高,对发酵泡菜的风味贡献不大。
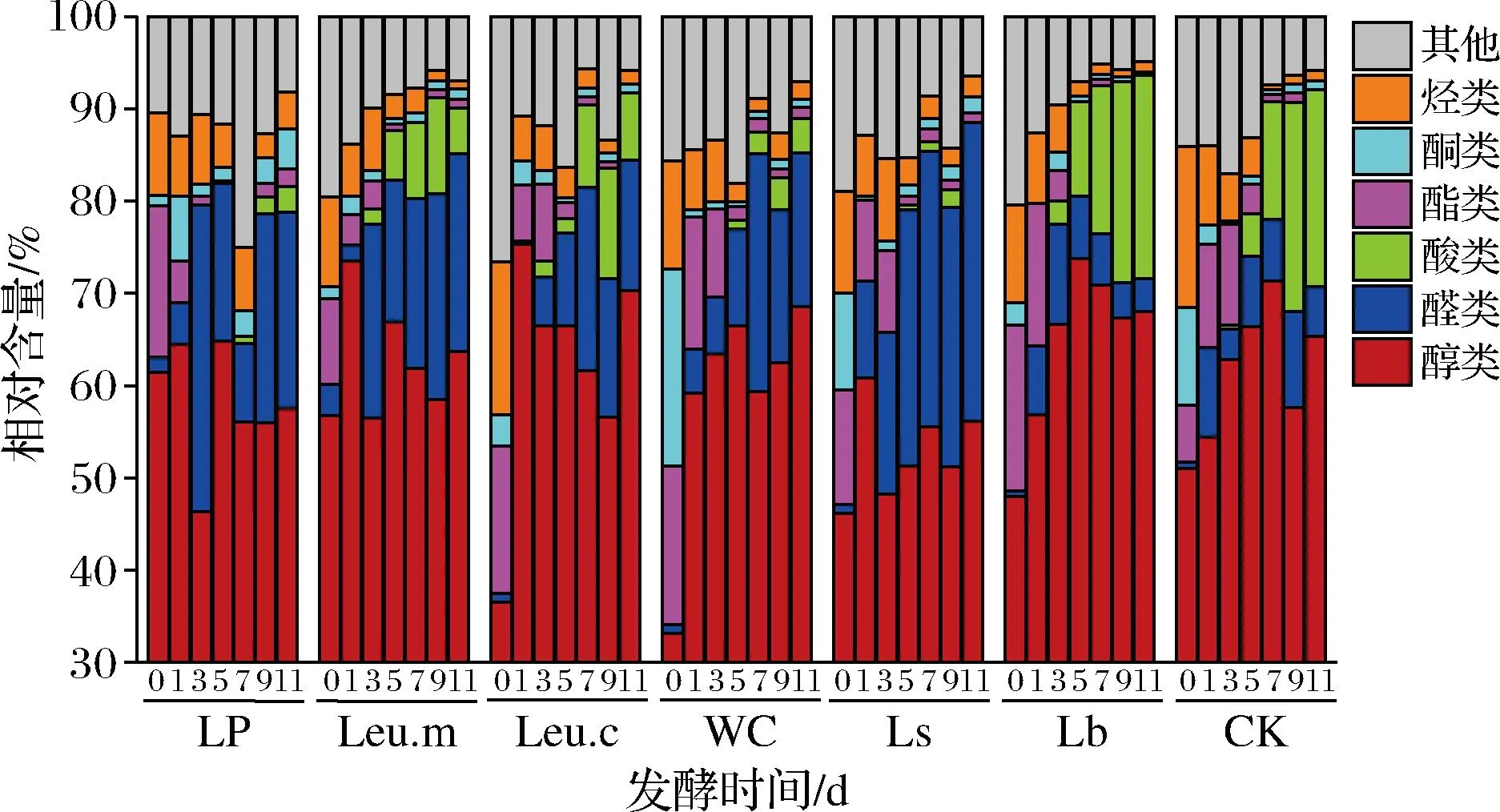
图6 发酵过程中泡白菜挥发性风味物质的变化Fig.6 Changes in volatile flavor compounds of Chinese cabbage pickles during fermentation
为反应发酵结束时各组泡菜挥发性风味成分的差异,采用无监督的PCA进行分析,如图7所示,共得到2个主成分,累积方差贡献率达到69.7%,同一95%置信区间内显示6组接菌组和对照组发酵的泡菜差异明显,表明不同乳酸菌发酵白菜其挥发性风味成分差异较大。3组乳杆菌属主要在X轴下方,其中LP组泡菜离自然发酵的CK组最远,表明风味差异最大;Leu.m、Leu.c两组距离接近,说明肠膜明串珠菌PC137、柠檬明串珠菌PC222两株菌发酵的泡菜挥发性风味相似。说明乳酸菌在种水平上的风味代谢差异较小,属水平上的差异较大。
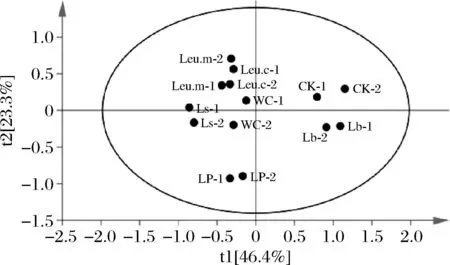
图7 发酵结束时各组泡白菜挥发性风味成分PCA结果Fig.7 PCA results of volatile flavor components of Chinese cabbage pickles for each group at the end of fermentation
3 结论
本研究对6种乳酸菌发酵泡白菜的理化特征和风味成分进行了分析,结果表明不同乳酸菌对泡白菜的代谢产物有较大的影响,尤其在属水平上差异较大。植物乳杆菌PC295和短乳杆菌PC330发酵泡白菜时,糖和氨基酸利用率较高,发酵速度快,产酸量较高,抑制大肠杆菌效果好。耐酸性较差菌株食窦魏斯氏菌PC311发酵的泡白菜不仅生长缓慢,其风味代谢也弱。泡白菜的挥发性风味物质均以醇类为主,主要包括乙醇、1-辛烯-3-醇、顺-2-戊烯-1-醇、叶醇、1-戊烯-3-醇等多种醇类;清酒乳杆菌组和短乳杆菌组分别在醛类和酸类物质的相对含量高于其他组;PCA结果显示,发酵结束时肠膜明串珠菌组和柠檬明串珠菌组泡菜的挥发性风味相似。综上所述,接种不同乳酸菌发酵泡白菜时,其产酸、利用糖和氨基酸等方面各不相同,表现出菌株差异性。本文探究了单菌发酵泡白菜的特性,下一步可深入研究多菌协同发酵对泡白菜风味品质的影响。研究结果可为进一步开发白菜类泡菜发酵剂奠定基础。