LncRNA MIAT靶向miR-204对氧糖剥夺/复氧诱导PC12细胞损伤的保护作用
刘美苓,安影丹
作者单位:廊坊市第四人民医院神经内科,河北 廊坊065700
中风是最常见的脑血管疾病类型之一,由于其高发病率、致残率和病死率[1],已成为世界范围内的主要神经系统问题。缺血性脑卒中(IS)是脑卒中的主要亚型,被认为是全球成年人发病和死亡的主要原因[2],仅在2016 年就造成约550 万人死亡[3]。IS的主要症状包括面部麻木、记忆力减退、说话困难和部分瘫痪[4]。在过去的几年里,IS 的发病率不断上升,这可能是由多种因素造成的,例如高胆固醇血症、高血压、肥胖和糖尿病[5]。虽然包括溶栓治疗、经皮血管内介入治疗和药物治疗在内的传统临床治疗已取得一定作用,但不理想的后续效果促使寻求新的缓解IS策略。
IS 本质上是由恢复到缺血区域的血流引起的脑损伤,这会促进进一步的缺血性器官损伤。虽然脑血再灌注可以减轻葡萄糖和氧气剥夺,但再灌注过程会加剧炎症反应、氧化应激和细胞凋亡,从而进一步加剧再灌注引起的脑损伤进展[6]。炎症和细胞凋亡是参与缺血性卒中进展的关键,据报道,抑制炎症可在一定程度上减少神经组织损伤[7]。因此,抑制炎症和细胞凋亡可能是治疗脑缺血∕再灌注损伤的有效策略[8]。长链非编码RNA(LncRNA)是一类长度大于200 个核苷酸的非编码RNA,可以在转录前、转录中和转录后水平调节蛋白质编码基因的表达。LncRNAs 是近年来的研究热点,之前的大量研究报道LncRNAs 可能与心脏、大脑、肝脏、肾脏和血管内皮组织等几个重要器官的IRI 的病理过程有关[9]。LncRNA MIAT(心肌梗死相关转录本),也称为RNCR2(视网膜非编码RNA2),是一种参与多种疾病的LncRNA,如心肌梗死、糖尿病并发症、缺血性卒中和癌症[10-11]。曾有研究报道心肌梗死相关转录本(MIAT)通过海绵化微RNA-330-5p(miR-330-5p)并激活下游肿瘤坏死因子受体相关因子6(TRAF6)∕核因子-κB(NF-κB)信号传导来增强脓毒症诱导的心脏损伤中的炎症和氧化应激[12]。因此,可以推测MIAT 可能是介导缺血∕再灌注(I∕R)损伤的关键LncRNA。
2021 年6—12 月进行本研究,旨在探究LncRNA MIAT 在氧糖剥夺∕复氧(OGD∕R)诱导PC12 细胞损伤的分子调控机制,为缓解IS提供治疗策略。
1 材料与方法
1.1 细胞培养与模型建立PC12 细胞购自ATCC(USA),并在含有10%胎牛血清的Dulbecco 氏改良eagle 培养基(Invitrogen,Grand Island,NY,USA)中培养。为了建立缺血样条件,暴露于缺氧条件的无葡萄糖培养基中的细胞:1%氧气,5%二氧化碳和94%的氮气4 h。然后将细胞与含有4.5 g∕L 葡萄糖的正常培养基一起孵育,并复氧24 h。
1.2 PC12 细胞处理LncRNA MIAT 过表达载体(pcDNA3.1-LncRNA MIAT)及其阴性对照pcDNA3.1-NC、miR-204 mimic 及其阴性对照mimic-NC均购自上海吉玛制药技术有限公司(上海,中国),通过Lipofectamine 2000(Invitrogen,Carlsbad, CA)以50 nmol作为终浓度转染至PC12细胞中,命名为:过表达MIAT(oe-MIAT)和相应的阴性对照(oe-NC),以及miR-124模拟物(miR-124 mimic)和相应的阴性对照(mimic NC),测定转染效率,24 h 后进行后续实验。
1.3 实时荧光定量聚合酶链式反应(qRT-PCR)利用Bio-Rad 软件(California,USA)确定最佳引物对,并委托上海生工合成。用Promega 公司(USA)的RNA 提取试剂盒从各组细胞中提取总RNA。用PrimerScript RT Master Mix(Takara,Dalian,China)将1 μg RNA 反转录为cDNA。根据说明书用SYBR Premix Ex Taq(Takara, Dalian, China)在ABI 7500(ABI,American)上进行qRT-PCR,以GAPDH 为内参,检测MIAT 的相对表达水平,以U6 为内参检测miR-204 的相对表达水平。通过2-ΔΔCt法[13]分别计算基因的相对表达量。PCR引物如表1。

表1 引物序列
1.4 CCK-8将细胞接种到96 孔板中(每孔3 000个细胞)并在37 ℃下培养。分别培养0、24、48 和72 h 后,向每个孔中加入10 μL CCK-8 反应试剂(上海碧云天生物技术有限公司)。37 ℃孵育4 h 后,检测450 nm处的吸光度(OD450),绘制细胞增殖曲线。
1.5 流式细胞术使用凋亡检测试剂盒(上海碧云天生物技术有限公司)检测细胞凋亡率。简而言之,用500 μL 结合缓冲液(含镁、钙、0.5%NaN3和1%FBS 的培养基)将细胞混悬。向细胞中加入Annexin V(5 μL)和PI(10 μL),并在室温下避光孵育10 min。使用流式细胞仪(Attune NxT; Thermo Fisher Scientific, Inc)和ModFiLT 软件(4.1,Verity Software House)检测并计算凋亡细胞百分比。
1.6 Elisa 检测使用Elisa 试剂盒(Abcam,UK)检测炎症相关因子IL-6、IL-1β、IL-10 的含量。简而言之,使用试剂盒中裂解缓冲液重悬细胞,于4 ℃、1 500×g离心15 min,取上清液,保存于-70 ℃。根据样品和标准品在450 nm的吸光度测定浓度。
1.7 RNA 下拉实验生物素(biotin)标记的miR-204 和阴性对照(上海生工)分别命名为biotin-miR-204 和biotin-NC,并分别与PC12 细胞裂解物孵育。然后添加链霉亲和素涂层磁珠(Life Technologies,Rockville,MD,USA)。使用生物素偶联RNA 复合物(Pierce Biotechnology,USA)进行下拉实验,通过qRT-PCR检测MIAT的表达。
1.8 双萤光素酶报告实验通过Starbase 网站(http:∕∕starbase.sysu.edu.cn∕)分析MIAT 和miR-204的靶向结合位点,通过将结合序列及突变的序列分别克隆至萤光素酶载体pGL3 (Pro-mega, Madison,WI,USA)中来建立野生型(MIAT-WT)和突变型(MIAT-MUT)萤光素酶质粒。将PC12 细胞接种在6孔板中(2×105细胞∕孔)。孵育24 h,按照说明书使用LiPofectamine 2000 (11668-019,Invitrogen,Carlsbad,CA,USA)将构建好的萤光素酶载体与mimic NC 或miR-204 mimic (Shanghai Genechem Co.,Ltd.,Shanghai,China)(miRNA-mimic 30nmol)同时转染到PC12 细胞中。24 h 后,用Dual-Lucy Assay Kit (Solarbio)对萤光素酶活性进行评估。
1.9 统计学方法所有数据均采用SPSS 21.0(SPSS,Inc,Chicago,IL,USA)统计学软件进行处理,计量资料采用±s的形式表示。两组间数据采用独立样本t检验。多组间比较采用one-way ANOVA单因素方差分析,事后检验采用Tukey"s多重比较检验。P<0.05为差异有统计学意义。
2 结果
2.1 MIAT 对OGD/R 诱导的PC12 损伤起保护作用建立PC12 细胞OGD∕R 模型,通过qRT-PCR 检测OGD∕R 后MIAT 的表达变化,观察到OGD∕R 下调了MIAT 的表达(P<0.01)。进一步,通过CCK-8、流式细胞术检测OGD∕R诱导对细胞活力及凋亡的影响,观察到OGD∕R降低了PC12的细胞活力,增加了细胞的凋亡率(P<0.01)。最后通过Elisa试剂盒检测OGD∕R诱导上调了炎性因子白细胞介素(IL)-6、IL-1β的含量,下调了抗炎性因子IL-10的含量(均P<0.01)。在OGD∕R 诱导的PC12 细胞中转染pcDNA3.1-MIAT 上调其表达后(P<0.01),上述细胞生物学改变均得到不同程度的逆转(均P<0.01)。提示MIAT 对OGD∕R 诱导的PC12细胞起保护作用。见表2,3。
表2 各组MIAT表达和细胞活力的比较∕ ± s
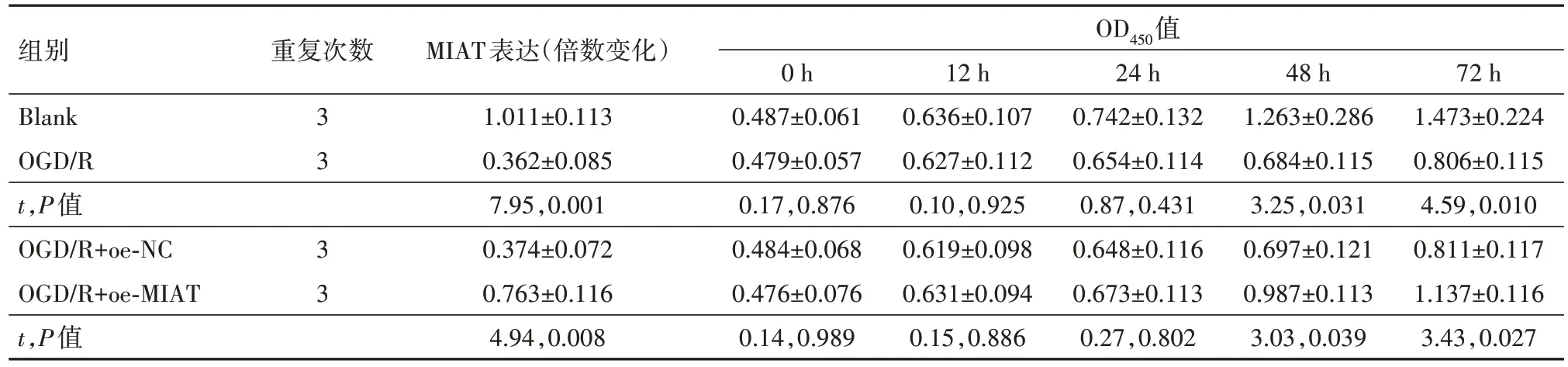
表2 各组MIAT表达和细胞活力的比较∕ ± s
注:Blank为空白对照,OGD∕R为氧糖剥夺∕复氧,MIAT为心肌梗死相关转录本,OD450为450 nm处的吸光度,oe-NC为过表达载体阴性对照,oe-MIAT为MIAT过表达载体。
组别Blank OGD∕R t,P值OGD∕R+oe-NC OGD∕R+oe-MIAT t,P值重复次数OD450值MIAT表达(倍数变化)1.011±0.113 0.362±0.085 7.95,0.001 0.374±0.072 0.763±0.116 4.94,0.008 24 h 0.742±0.132 0.654±0.114 0.87,0.431 0.648±0.116 0.673±0.113 0.27,0.802 12 h 0.636±0.107 0.627±0.112 0.10,0.925 0.619±0.098 0.631±0.094 0.15,0.886 48 h 1.263±0.286 0.684±0.115 3.25,0.031 0.697±0.121 0.987±0.113 3.03,0.039 72 h 1.473±0.224 0.806±0.115 4.59,0.010 0.811±0.117 1.137±0.116 3.43,0.027 3 3 3 3 0 h 0.487±0.061 0.479±0.057 0.17,0.876 0.484±0.068 0.476±0.076 0.14,0.989
表3 各组细胞凋亡和炎性因子水平的比较∕ ± s
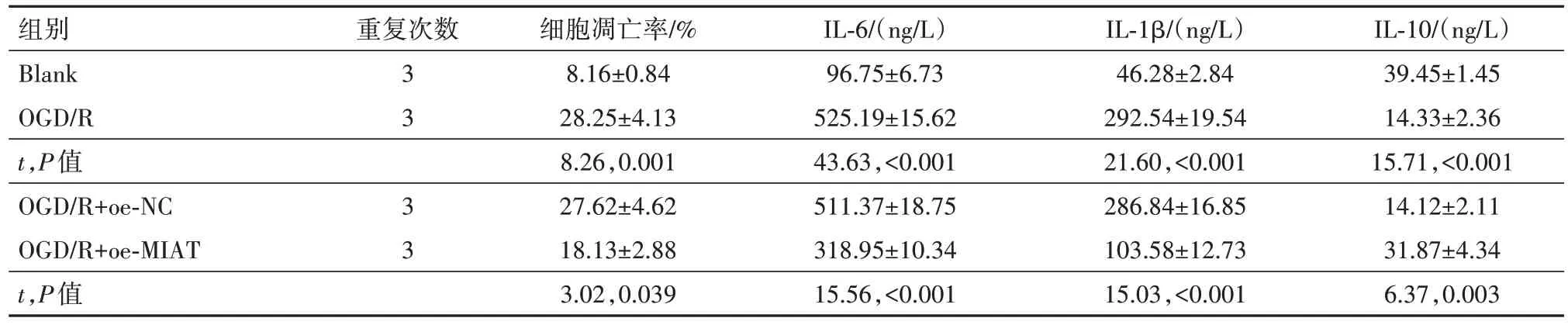
表3 各组细胞凋亡和炎性因子水平的比较∕ ± s
注:Blank 为空白对照,OGD∕R 为氧糖剥夺∕复氧,MIAT 为心肌梗死相关转录本,oe-NC 为过表达载体阴性对照,oe-MIAT 为MIAT 过表达载体,IL-6为白细胞介素-6,IL-1β为白细胞介素-1β,IL-10为白细胞介素-10。
IL-10∕(ng∕L)39.45±1.45 14.33±2.36 15.71,<0.001 14.12±2.11 31.87±4.34 6.37,0.003组别Blank OGD∕R t,P值OGD∕R+oe-NC OGD∕R+oe-MIAT t,P值重复次数3 3 3 3细胞凋亡率∕%8.16±0.84 28.25±4.13 8.26,0.001 27.62±4.62 18.13±2.88 3.02,0.039 IL-6∕(ng∕L)96.75±6.73 525.19±15.62 43.63,<0.001 511.37±18.75 318.95±10.34 15.56,<0.001 IL-1β∕(ng∕L)46.28±2.84 292.54±19.54 21.60,<0.001 286.84±16.85 103.58±12.73 15.03,<0.001
2.2 MIAT 可以靶向结合miR-204 抑制其表达通过miRcode(http:∕∕ www.mircode.org∕)预测了LncRNA MIAT 下游靶向结合miRNA,在这之中,有研究表明miR-204可以促进神经细胞的损伤[14]。首先使用生物素化的miR-204 探针来下拉LncRNA MIAT,与对照组(1.001±0.003)相比,MIAT 特异性富集在生物素标记的miR-204(14.984±4.762)探针上(t=5.09,P=0.007)。进一步通过双萤光素酶报告实验检测LncRNA MIAT 与miR-204 的靶向结合,与NC组相比,转染miR-204 mimic 后,MIAT-WT 组的萤光素酶活性显著降低;而MIAT-MUT 组的萤光素酶活性没有变化(表4)。最后qRT-PCR 检测了前述实验各组PC12细胞中的miR-204的表达,发现OGD∕R 上调了miR-204 的表达,但转染pcDNA3.1-MIAT 后,miR-204 表达显著降低(表5)。提示LncRNA MIAT可以靶向miR-204抑制其表达。
表4 双萤光素酶报告实验∕ ± s
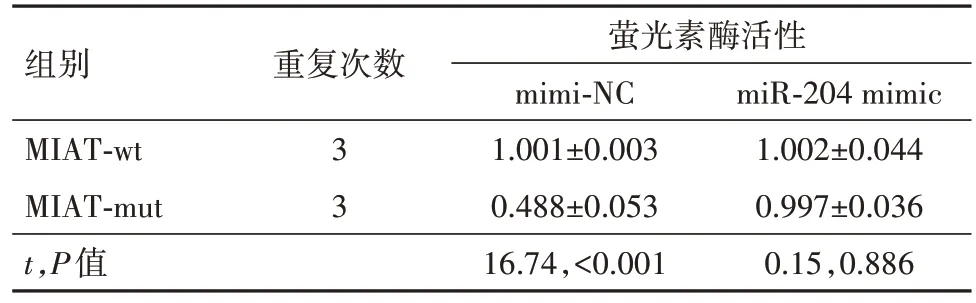
表4 双萤光素酶报告实验∕ ± s
注:MIAT 为心肌梗死相关转录本,MIAT-wt 为野生型MIAT,MIAT-mut 为突变型MIAT,mimi-NC 为模拟物阴性对照,miR-204 mimic为miR-204模拟物。
组别MIAT-wt MIAT-mut t,P值重复次数萤光素酶活性mimi-NC 1.001±0.003 0.488±0.053 16.74,<0.001 miR-204 mimic 1.002±0.044 0.997±0.036 0.15,0.886 3 3
表5 各组细胞中miR-204表达的比较∕ ± s
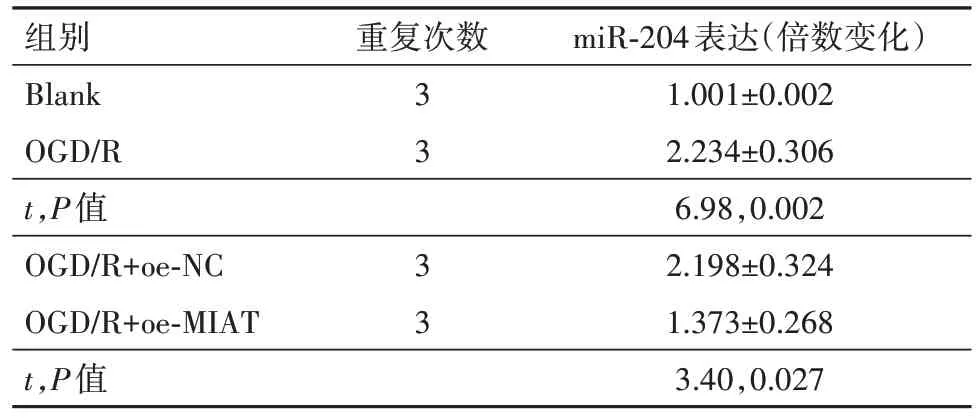
表5 各组细胞中miR-204表达的比较∕ ± s
注:Blank为空白对照,OGD∕R为氧糖剥夺∕复氧,MIAT为心肌梗死相关转录本,oe-NC 为过表达载体阴性对照,oe-MIAT 为MIAT 过表达载体。
miR-204表达(倍数变化)1.001±0.002 2.234±0.306 6.98,0.002 2.198±0.324 1.373±0.268 3.40,0.027组别Blank OGD∕R t,P值OGD∕R+oe-NC OGD∕R+oe-MIAT t,P值重复次数3 3 3 3
2.3 上调miR-204 可以部分逆转高表达MIAT 对OGD/R 诱导的PC12 损伤保护在转染了pcDNA3.1-MIAT 且OGD∕R 诱导的PC12 细胞中 共 转染了miR-204 mimic,qRT-PCR 检测了转染效率(P<0.01)。通过CCK-8、流式细胞术检测miR-204 对细胞活力及凋亡的影响,观察到上调miR-204 降低了PC12 的细胞活力,增加了细胞的凋亡率(P<0.01)。最后通过Elisa 试剂盒检测观察到高表达miR-204上调了炎性因子IL-6、IL-1β 的含量,下调了抗炎性因子IL-10 的含量(均P<0.01)。提示上调miR-204的表达可以部分逆转高表达MIAT 对OGD∕R 诱导的PC12损伤保护。见表6,7。
表6 各组miR-204表达和450 nm处的吸光度(OD450值)的比较∕ ± s
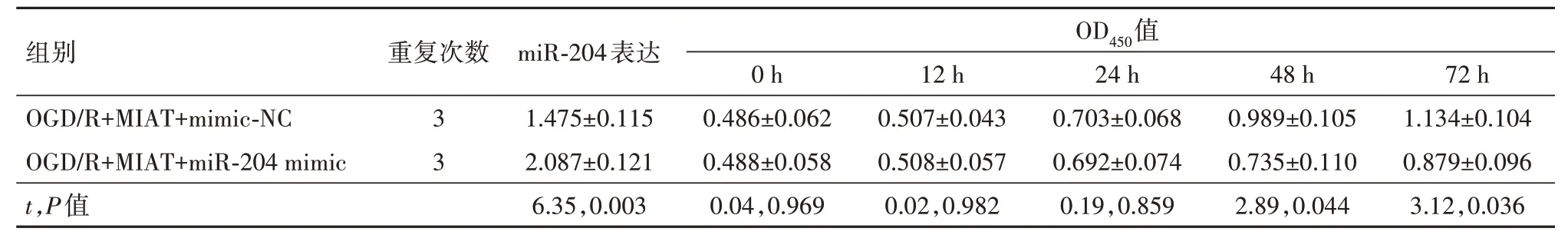
表6 各组miR-204表达和450 nm处的吸光度(OD450值)的比较∕ ± s
注:OGD∕R为氧糖剥夺∕复氧,MIAT为心肌梗死相关转录本,mimic-NC为模拟物阴性对照,miR-204 mimic为miR-204模拟物。
组别OGD∕R+MIAT+mimic-NC OGD∕R+MIAT+miR-204 mimic重复次数OD450值miR-204表达1.475±0.115 2.087±0.121 24 h 0.703±0.068 0.692±0.074 72 h 1.134±0.104 0.879±0.096 12 h 0.507±0.043 0.508±0.057 0 h 0.486±0.062 0.488±0.058 48 h 0.989±0.105 0.735±0.110 3 3 t,P值6.35,0.003 0.19,0.859 3.12,0.036 0.02,0.982 0.04,0.969 2.89,0.044
表7 各组细胞凋亡率和炎性因子水平的比较∕ ± s
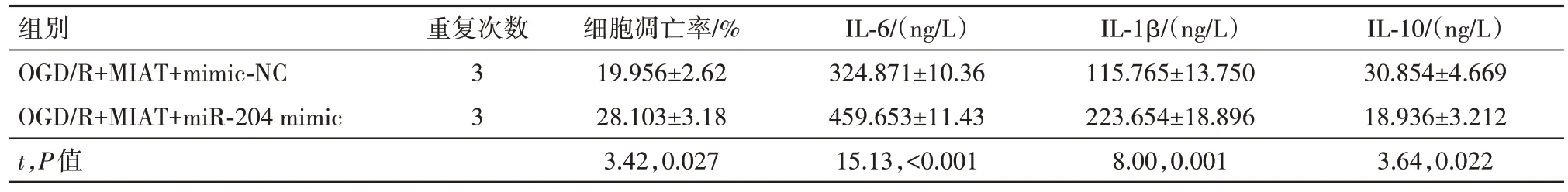
表7 各组细胞凋亡率和炎性因子水平的比较∕ ± s
注:OGD∕R 为氧糖剥夺∕复氧,MIAT 为心肌梗死相关转录本,mimic-NC 为模拟物阴性对照,miR-204 mimic 为miR-204 模拟物,IL-6 为白细胞介素-6,IL-1β为白细胞介素-1β,IL-10为白细胞介素-10。
IL-10∕(ng∕L)30.854±4.669 18.936±3.212 3.64,0.022组别OGD∕R+MIAT+mimic-NC OGD∕R+MIAT+miR-204 mimic t,P值重复次数3 3细胞凋亡率∕%19.956±2.62 28.103±3.18 3.42,0.027 IL-6∕(ng∕L)324.871±10.36 459.653±11.43 15.13,<0.001 IL-1β∕(ng∕L)115.765±13.750 223.654±18.896 8.00,0.001
3 讨论
缺血性卒中是临床常见的脑血管疾病,每年约有15 万人遭受中风伤害,并且近500 万人死于中风伤害[15]。在缺血条件下,大脑不能获得足够的能量供应,包括血液和氧气,用于生物合成、细胞膜结构的维持和酶的正常功能,从而导致神经损伤[16]。迄今为止,恢复缺血脑组织的血液和氧气供应被认为是缺血性卒中临床治疗中的首要问题[15]。然而,血液和氧气供应可能导致缺血组织的病理损伤,导致不可逆的脑缺血∕再灌注损伤[17]。因此,保护神经细胞免受I∕R 诱导的损伤可能有益于中风的治疗[18]。脑缺血∕再灌注损伤的基本机制尚未完全阐明。研究表明,再灌注后大量自由基产生和自由基清除能力下降导致的氧化应激是脑缺血再灌注损伤的关键调节因素,过度的氧化应激可导致脂质过氧化、蛋白质硝化、核酸损伤以及神经细胞膜和细胞器的严重炎症[19]。因此,防止氧化应激和炎症反应的有效策略显示出抑制脑I∕R损伤的有益效果。
最近,LncRNA 的作用逐渐引起人们的广泛关注[20],本研究的主要发现是确认LncRNA MIAT 在缺血性卒中中的重要性并阐明其潜在机制。LncRNA广泛存在于中枢神经系统中,在脑功能和神经系统疾病中发挥着重要作用。以往的研究表明,LncRNA MIAT 在神经损伤疾病中异常表达,例如,LncRNA MIAT 通过miRNA-379 的竞争性结合调节视神经损伤,促进神经血管重塑[21]和调节心脏休克蛋白5(HSPA5)[22];LncRNA MIAT 的 过 表 达 通 过RAD21 激活血管内皮生长因子A 促进急性脊髓损伤的神经损伤修复[23],Xu 等[24]研究也发现MIAT 能够通过调miR-132∕SIRT1 轴来抑制1-甲基-4-苯基吡啶鎓(MPP+)诱导的氧化应激损伤。在本研究发现MIAT 在由OGD∕R 诱导的PC12 细胞中高表达,还发现LncRNA MIAT的过表达对OGD∕R诱导的PC12损伤具有保护作用,而进一步的机制研究表明,PC12细胞中LncRNA MIAT 的过表达通过抑制miR-204表达,上调细胞活力及降低细胞凋亡率,还减轻了细胞的炎症,从而减轻PC12细胞损伤。
多项报道揭示miRNA 在调节神经发育中发挥重要作用。2015 年,研究人员首次提出miR-27a 上调可减弱缺血再灌注诱导的血-脊髓屏障炎性损伤的证据[25]。之后,Li 等[26]发现抑制miR-124-3p 可减弱脊髓缺血后的神经损伤。Li 等[27]证实了SCII 大鼠中4 个差异表达的microRNA(miR-22-3p、miR-743b-3p、miR-201-5p 和miR144-5p)及其共同靶基因,其中miR-22-3p 上调,miR-743b-3p、miR-201-5p和miR-144-5p 下调。2006 年,miR-204 首次在胰腺内分泌和腺泡肿瘤中被发现,然后,它被证明是一种广泛表达的miRNA,在甲状腺癌等细胞中异常表达[28]。既往报道证明缺氧刺激神经元细胞表达miR-204[29],而本研究也发现miR-204在OGD∕R诱导后高表达,且促进了PC12细胞的损伤。
总而言之,本研究探究了OGD∕R 诱导的PC12损伤的分子调控机制,为其治疗提供了新的思路,未来也将会在动物模型中对分子机制进行进一步的验证。

