血清白细胞介素-35、乳酸脱氢酶在骨髓增生异常综合征120例中的临床意义
王宁,匡歆,赫宁宁
作者单位:青岛市胶州中心医院检验科,山东 青岛266300
骨髓增生异常综合征(MDS)是起源于造血干细胞的肿瘤性疾病,其主要特征是骨髓造血功能异常、血细胞发育异常,且高风险向急性髓系白血病(AML)转化[1]。MDS 病情具有多样性,且众多病人病情危险程度不一,临床常给予个体化治疗以延缓病情进展为主[2]。因MDS 存在极大异质性,尽管目前已推广出众多治疗方案,仍有部分病人治疗疗效和生存时间存在显著差异[3]。因此,临床应探究与MDS 病人疗效有关的指标,评估病人治疗失败风险。修订的国际预后积分系统(IRSS-R)被认为是评估MDS 预后的金标准,但其评估标准是否适用于化疗或靶向治疗等病人依然未知,以此成为应用局限。研究指出,MDS 发病机制主要涉及造血前体细胞的特定分子缺陷,不同免疫途径均参与其中,自身免疫异常和T细胞介导的免疫抑制被认为是MDS的主要特征[4]。白细胞介素(IL)-35 属于Ⅰ型细胞因子受体,主要在细胞相互接触时大量生成,可促进效应T细胞活化、成熟[5]。有研究发现,IL-35与免疫负向调节有关,可通过抑制辅助性T 细胞17(Th17)分化而产生免疫抑制作用[6]。韩冰等[7]研究发现,MDS 仍存在病态造血、原位溶血及细胞过度损害等病理反应。乳酸脱氢酶(LDH)是人体组织中细胞代谢酶,其活性增高常见于白血病、恶性肿瘤等疾病,尤其可反应细胞增殖、代谢异常,与骨髓原位溶血、红细胞破坏等紧密相关[8]。由此推测,IL-35、LDH 可通过增强免疫抑制途径和加速细胞损坏,促进MDS 病情进展,影响治疗效果。本研究将分析血清IL-35、LDH 与MDS 病人治疗效果的关系,评估MDS治疗失败风险,制定后续干预方案。
1 资料与方法
1.1 一般资料选取青岛市胶州中心医院2019 年5 月至2020 年5 月收治的128 例MDS 病人作为研究对象。纳入标准:①MDS 符合《骨髓增生异常综合征中国诊断与治疗指南(2019年版)》[9]中相关诊断;②伴有贫血相关症状,如乏力、疲倦等;③参照上述指南在医院接受个体化治疗,治疗期间同步进行随访;④入院时预计生存周期>6 个月。排除标准:①合并白血病或实体恶性肿瘤;②合并急性感染;③合并先天性免疫功能缺陷;④合并先天性造血干细胞功能障碍;⑤合并其他血液疾病;⑥合并自身免疫性疾病;⑦合并其他骨髓疾病;⑧长期接受激素治疗者。剔除标准:①发生任何不良反应需停止用药;②随访期间突发重大疾病需停止观察;③随访期间全因死亡;④病人或其近亲属主动要求退出研究。本研究病人或其近亲属知情同意,符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法
1.2.1 临床资料收集 设计调查问卷,统计病人临床资料:年龄、性别(男∕女)、WHO 分型[MDS 伴单系发育异常(MDS-SLD)∕MDS 伴多系发育异常(MDSMLD)∕MDS 伴原始细胞过多-Ⅰ(MDS-EB-Ⅰ)]、WHO 分型预后积分系统(WPSS)[9]、IRSS-R 评分[9]、危险程度[较低危(IRSS-R≤3.5 分)∕较高危(IRSS-R>3.5分)][9]。
1.2.2 MDS 治疗及预后评估方法 (1)治疗方案:研究中120 例病人均参照《骨髓增生异常综合征中国诊断与治疗指南(2019 年版)》[9]在医院接受个体化治疗:对于较低危病人以改善造血,提高生活质量为治疗目标,包括成分输血、造血生长因子、去铁治疗等,对于存在输血依赖性贫血,且对细胞因子治疗效果不佳病人可采用免疫调节剂治疗,如来那度胺治疗,28 d 为1 个疗程。对于较高危病人以降低病情向AML 转化风险,改善生存为治疗目标,采用去甲基化药物治疗,如5-阿扎胞苷(AZA)、5-阿扎-2-脱氧胞苷(地西他滨)等药物;AZA 治疗:用法用量为皮下注射AZA(Celgene Europe BV,批号H20170238),75 mg·m-2·d-1)×7 d,28 d 为1 个疗程。(2)疗效评估[9]:治疗6 个疗程时参照指南中疗效标准评估治疗效果,分为完全缓解(CR):原始细胞≤5%且所有细胞系均成熟,血红蛋白(Hb)≥110 g∕L、血小板(PLT)≥100×109∕L、中性粒细胞绝对计数(ANC)≥1.0×109∕L、原始细胞为0;部分缓解(PR):外周血绝对值持续≥2个月、其余条件达到CR标准但原始细胞较治疗前仅减少≥50%,仍>5%不考虑骨髓细胞增生程度;疾病稳定(SD):未达部分缓解最低标准但至少8周病情未进展;治疗失败(failure):治疗期间病死或病情进展,主要表现为血细胞进一步减少、骨髓原始细胞增高等。根据病人治疗效果分为治疗有效组(CR、PR、SD)和治疗失败组(Failure)。
1.3 研究相关实验室指标检测方法治疗前,采集病人空腹外周静脉血8 mL分别放置于两支试管中,取其中一支试管采用全自动血细胞分析仪(南京贝登医疗股份有限公司,BH-5360)检测全血白细胞(WBC):参考值(4~10)×109∕L、ANC:参考值(1.8~6.3)×109∕L;取 另 一 支 试 管 以3 500 r∕min速率离心10 min 分离血清和血浆(离心半径为10 cm),血浆中加入抗凝剂,采用全自动血细胞分析仪检测血浆红细胞(RBC):参考值男(4.3~5.8)×1012∕L;女(3.8~5.1)×1012∕L、Hb:参考值男130~175 g∕L;女115~150 g∕L、PLT:参考值(125~350)×109∕L,采用连续检测法测定血清LDH 水平,采用酶联免疫吸附法检测血清IL-35水平,LDH参考为120~250 U∕L、IL-35正常值为3.3~200.0 ng∕L,试剂盒均购自南京贝登医疗股份有限公司。
1.4 样本量估算使用Kendall 粗略样本量估算方法,样本量为自变量的5~10倍,本研究以MDS病人治疗效果作为因变量,纳入的自变量包括一般资料(6项),检测指标(7项),共计13项,考虑到10%的失访病人,研究至少需纳入72~143例病人,以2019年5月至2020年5月收治的128例MDS病人作为研究对象。
1.5 统计学方法采用SPSS 25.0 统计学软件处理数据,采用例(%)表示计数资料,采用χ2检验,等级资料采用秩和检验;采用Shapiro-Wilk 正态分布检验计量资料的正态性情况;符合正态分布的计量资料以±s表示,两组间比较以独立样本t检验;非正态分布计量资料采用中位数(第25、75 百分位数)、即M(P25,P75)表示,组间比较采用非参数Mann-WhitneyU检验;以P<0.05 为差异有统计学意义;血清IL-35、LDH 与MDS病人治疗效果的关系,采用logistic 回归分析检验;绘制受试者操作特征(ROC)曲线,并计算曲线下面积(AUC),获取血清IL-35、LDH预测MDS 病人治疗失败的最佳阈值;采用限制性立方样条函数评估血清IL-35、LDH 与MDS 病人治疗效果的OR值关系,采用样条函数与logistic 回归相结合的限制性立方样条法分析自变量与因变量之间关系,以估血清IL-35、LDH最佳阈值为参考值,采用限制性立方样条法分析血清IL-35、LDH 与MDS病人治疗效果的剂量反应关系。
2 结果
2.1 MDS病人治疗效果128例MDS病人,治疗期间2 例要求退出研究,2 例因使用来拿度胺发生PLT减少,1例发生中性粒细胞减少症,需停止用药,3例失访,共剔除8 例病人,以120 例病人为实际研究对象。120 例MDS 病人,于治疗6 个疗程时,CR 占12例(10.00%)、PR 占60 例(50.00%)、SD 占20 例(16.67%)、Failure 占28 例(23.33%);治疗失败组占23.33%(28∕120),治疗有效组占76.67%(92∕120)。
2.2 治疗有效组和治疗失败组一般资料比较治疗失败组WPSS评分、IRSS-R均高于治疗有效组,较高危病人占比多于治疗有效组,差异有统计学意义(P<0.05);两组其他资料比较,差异无统计学意义(P>0.05)。见表1。
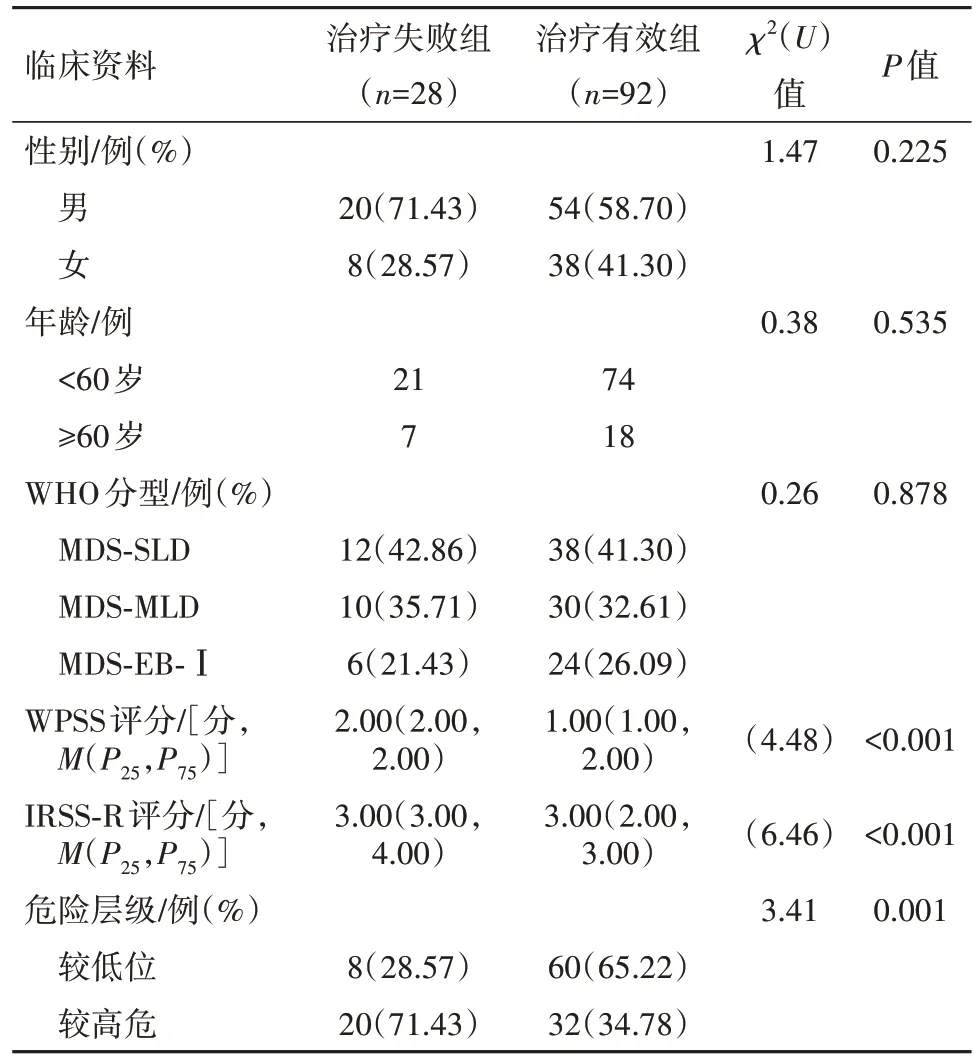
表1 骨髓增生异常综合征120例中治疗有效组和治疗失败组一般资料比较
2.3 治疗有效组和治疗失败组实验室指标比较治疗失败组全血ANC,血浆Hb、PLT 低于治疗有效组,血清IL-35、LDH表达量高于治疗有效组,差异有统计学意义(P<0.05);两组其他指标比较,差异无统计学意义(P>0.05)。见表2。
表2 骨髓增生异常综合征120例中治疗有效组和治疗失败组实验室指标比较∕ ± s
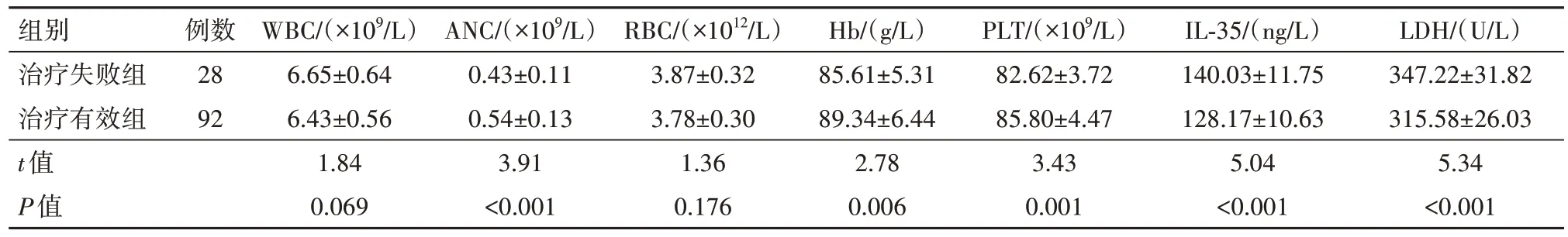
表2 骨髓增生异常综合征120例中治疗有效组和治疗失败组实验室指标比较∕ ± s
注:WBC为白细胞,ANC为中性粒细胞绝对计数,RBC为红细胞,Hb为血红蛋白,PLT为血小板,IL-35为白细胞介素-35,LDH为乳酸脱氢酶。
组别治疗失败组治疗有效组t值P值LDH∕(U∕L)347.22±31.82 315.58±26.03 5.34<0.001例数28 92 WBC∕(×109∕L)6.65±0.64 6.43±0.56 1.84 0.069 ANC∕(×109∕L)0.43±0.11 0.54±0.13 3.91<0.001 RBC∕(×1012∕L)3.87±0.32 3.78±0.30 1.36 0.176 Hb∕(g∕L)85.61±5.31 89.34±6.44 2.78 0.006 PLT∕(×109∕L)82.62±3.72 85.80±4.47 3.43 0.001 IL-35∕(ng∕L)140.03±11.75 128.17±10.63 5.04<0.001
2.4 各指标与MDS 病人治疗效果关系的logistic回归分析以MDS 病人治疗效果作为因变量(1=治疗失败,0=治疗有效),将差异有统计学意义的指标纳入作为自变量,经logistic 回归分析显示,MDS 病人治疗失败与全血ANC,血浆Hb、PLT 低表达,血清IL-35、LDH高表达有关(P<0.05)。见表3。
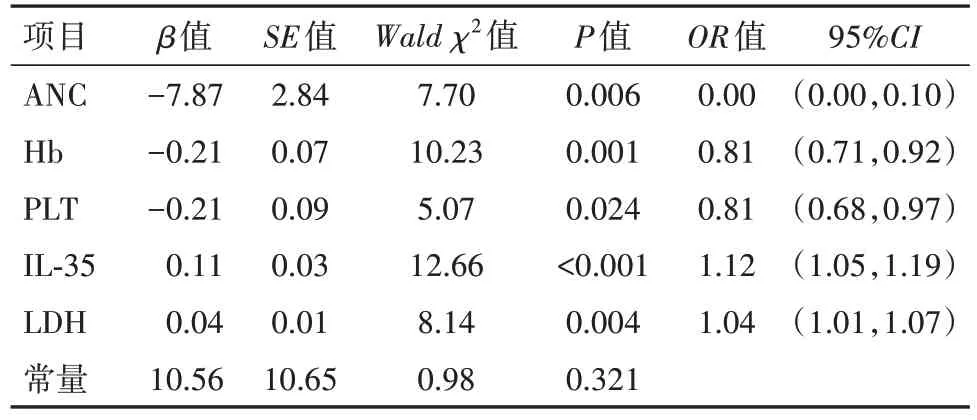
表3 各指标与骨髓增生异常综合征120例治疗效果关系的logistic回归分析
2.5 血清IL-35、LDH 联合预测MDS 病人治疗效果以MDS 病人治疗效果作为状态变量(1=治疗失败,0=治疗有效),将血清IL-35、LDH 作为检验变量,绘制ROC 曲线图发现,血清IL-35、LDH 单独及联合预测MDS 病人治疗失败风险的AUC 分别为0.77、0.79、0.83,当二者截断值分别取129.70 ng∕L、324.28 U∕L时,可获取最佳预测效能。见表4。
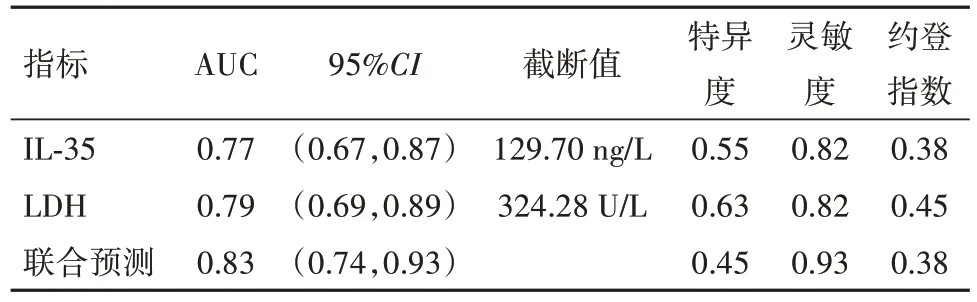
表4 血清IL-35、LDH联合预测骨髓增生异常综合征120例治疗效果
2.6 血清IL-35、LDH 与MDS 病人治疗效果的剂量反应关系以血清IL-35、LDH 最佳截断值129.70 ng∕L、324.28 U∕L 为参考值,采用样条函数与logistic 回归相结合的限制性立方样条法,分析血清IL-35、LDH 与MDS 病人治疗效果的剂量反应关系。血清IL-35、LDH 连续变化与MDS 病人治疗失败的关联强度成线性剂量反应关系(P<0.05);血清IL-35、LDH 与MDS 病人治疗失败呈显著正相关,当血清IL-35>129.70 ng∕L、血清LDH>324.28 U∕L 时,MDS病人治疗失败风险随血清IL-35、LDH升高而升高。
3 讨论
文献指出,MDS 病人自然病程和危险层级差异有统计学意义,治疗宜个体化,以改善自然病程、血液学质量及生存质量为主[10]。然而目前MDS 治疗方案存在多样性,不同病情病人所制定治疗方案不同,整体疗效难以提升,这也导致MDS 病人预后产生一定差异[11]。为评估MDS 病人整体治疗效果,郑丽坤等[12]研究发现,80 例MDS 病人治疗24 个月时疾病进展率高达31.25%。但本研究中,120 例MDS病人治疗失败率约23.33%,与上述研究不同原因在于,病人危险层级、观察周期等差异,但上述研究数据均表明MDS 的整体治疗收益有待提高,探究与MDS病人治疗效果有关的指标十分必要。
研究指出,自身免疫异常参与骨髓造血抑制与疾病进展,其中Tregs 细胞在维持免疫耐受、调节T细胞稳态等方面具有重要作用,能够抑制免疫效应细胞对异常发育克隆细胞的清除能力,促进MDS 病情进展[13]。IL-35 为IL-12 家族成员,与其他家族成员不同,IL-35 是由Tregs 分泌的免疫抑制性细胞因子,能够抑制T 细胞增殖及向Th1、Th17 细胞分化,诱导Tregs 增殖,以发挥免疫抑制作用[14]。除此之外,IL-35 能够诱导新型Tregs(即iTR35)生成,即使无Tregs 存在,iTR35 仍可发挥强大免疫抑制效应,加重疾病进展[15]。近年来,Ye 等[16]研究证实,高浓度的IL-35可有效抑制T细胞增殖,增强免疫抑制作用。LDH 为糖代谢中重要酶系之一,广泛存在于器官和骨骼肌等组织中。早在2011 年,Kim 等[17]研究证实,LDH 与白血病病情进展有关,通过参与RBC、PLT 损伤而增加出血风险,加重白血病病情。近年来研究发现,LDH 与MDS 发病风险有关,可进一步引起细胞损伤,从而加重MDS病情[18]。
本研究中,治疗失败组血清IL-35、LDH 表达均高于治疗有效组,也进一步证实血清IL-35、LDH 与MDS 病情进展有关。与此同时,治疗失败组较高危病人居多,该结果也表明较高危病人血清IL-35、LDH水平普遍较高。这可能与血清IL-35、LDH参与MDS病情进展有关。结合上述研究结果认为,IL-35通过增强免疫抑制作用,导致异常发育克隆细胞增生,从而导致MDS 病情进展,增加病情危险程度。LDH 介导RBC、PLT 等细胞损伤参与MDS 的发病过程,增加病情危险程度。这也成为较高危病人治疗失败普遍较多的主要原因。为进一步明确血清IL-35、LDH 与MDS 的关系,经logistics 回归分析显示,MDS病人治疗失败与血清IL-35、LDH高表达有关。
目前认为IL-35、LDH 通过以下机制参与MDS进展,影响治疗效果:(1)IL-35:IL-35 可通过抑制细胞毒性T 细胞过度增殖及CD4+细胞分化为Th 或Th17 效应细胞,发挥免疫抑制作用,从而加速异常发育细胞克隆和血细胞损伤,以此加重MDS 危险层级,最终增加治疗难度[19]。IL-35与Treg可相互上调表达,诱导T 细胞转化为iTR35 细胞,构成机体免疫调控网络,进一步加重免疫抑制,加重MDS 病人细胞损伤,从而增加治疗难度[20]。Egwuagu 等[21]研究显示,IL-35 可协同Treg 发挥免疫抑制作用,从而加重相关疾病病情。(2)LDH:LDH 升高与细胞结构和功能改变有关,LDH 在RBC 红含量比正常血清中活性高出1 000 余倍,LDH 升高可导致RBC 过度损伤,从而加重MDS 病情进展[22];除此之外,LDH 通过糖酵解可产生大量乳酸,而乳酸可通过促进异常发育细胞增殖、转移,从而加速MDS 病人骨髓细胞损伤,利于病情恶性发展,增加临床治疗难度[23]。为明确LDH 与MDS 病人预后的关系,陈春平等[24]研究发现,血清LDH高表达可作为MDS病人病死的危险因素。由此可见,血清LDH 高表达一定程度上增加MDS病人治疗失败风险。
本研究在最后通过绘制ROC 曲线获取血清IL-35、LDH 预测MDS 病人治疗失败的最佳阈值,结果显示,当二者截断值分别取129.70 ng∕L、324.28 U∕L 时,在预测MDD 治疗失败时可获取最佳预测效能,由此认为,临床在预测MDS 治疗效果时,不仅可采用ANC、Hb、PLT 等指标,仍可将血清IL-35、LDH水平作为参考,以提高预测效能。然而本研究中,血清IL-35、LDH 预测MDS 病人治疗失败的灵敏度偏高,特异度偏低,这是由于IL-35 属于天然免疫和适应性免疫反应中重要细胞因子,在MDS 中免疫反应可有效激活IL-35 导致其水平升高,这也是导致其灵敏度偏高的原因。而LDH 是机体损伤的重要标志物,机体几乎所有脏器损伤均可导致LDH 升高,在MDS 中,骨髓细胞损伤导致造血功能和免疫功能等多系统功能障碍,这是造成LDH 灵敏度偏高的原因之一。此外,本研究为明确血清IL-35、LDH与MDS 病人治疗效果的关系,采用限制性立方样条分析显示,血清IL-35、LDH 与MDS 病人治疗失败风险呈线性剂量反应关系,由此可见,临床在治疗MDS 前可考虑优先获取血清IL-35、LDH 最佳阈值,评估MDS 病人治疗失败风险,从而制定更加有效的干预方案,以改善治疗预后。
本研究虽证实血清IL-35、LDH 与MDS 病人治疗效果的关系,但由于观察周期较短,尚未针对血清IL-35、LDH 实施针对性干预,并观察病人治疗效果。与此同时,本研究为单中心研究,能够提供的MDS 样本量有限,这也导致本研究结果一定程度上与后期研究产生差异,此为本研究的局限。今后研究将联合多中心开展,扩增样本量,继续延长随访周期,将血清IL-35、LDH 作为MDS 病人治疗靶点之一,进一步评估病人治疗效果,为探究MDS 治疗方案提供新的参考。
综上所述,MDS 治疗失败与血清IL-35、LDH 高表达有关,血清IL-35、LDH 高表达与MDS 病人治疗失败风险呈线性剂量反应关系,临床中或可以血清IL-35、LDH 作为MDS 的潜在治疗靶点,通过改善血清IL-35、LDH 水平,延缓MDS 病情进展,尽可能降低治疗失败风险。

