身体质量指数联合三酰甘油与高密度脂蛋白胆固醇比值预测2型糖尿病风险
雷庆华,李军华,霍燕飞,郭子静,李霞,李宗虎
作者单位:邯郸市中心医院体检中心,河北 邯郸056000
近年来,2 型糖尿病(type 2 diabetes mellitus,T2DM)的发病率在全球范围内稳步上升,中国人口众多,是T2DM的大国,2017年的糖尿病患病达到了11.2%,并且90%是T2DM[1]。与非T2DM 病人相比,T2DM 病人发生心脑血管事件、眼底疾病、糖尿病肾病和外周血管疾病的风险及病死率更高[2]。先前的临床试验已经证明,个体化干预可有效减少或延缓高危人群中T2DM 的发病[3]。因此,识别T2DM 风险较高的人群,给予早期干预,可以降低医疗成本,提高生活质量。因此,需要一种新颖、准确且简单的预测指标来识别T2DM的高危人群。
机体的β 细胞功能障碍和胰岛素抵抗(insulin resistance,IR)均与T2DM 的发病有直接关系。此外,已有研究表明,血脂异常,例如三酰甘油(triglyceride,TG)升高或高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平低都能导致血糖异常[4]。高甘油三酯血症可导致IR 和随后的恶性循环后果,其中代偿性高胰岛素血症和IR 可进一步加剧高甘油三酯血症[5]。另一方面,一些临床观察表明,HDL-C 与糖尿病风险呈负相关[6]。目前有研究使用三酰甘油与高密度脂蛋白胆固醇(TG∕HDLC)的比值来预测T2DM 的发生,我们在临床工作中发现,身体质量指数(body mass index,BMI)会影响TG∕HDL-C 与T2DM 的关系。所以本研究分析BMI联合TG∕HDL-C对T2DM的预测作用。
1 资料与方法
1.1 一般资料选取瑞慈医疗集团2010—2016 年体检人群的体检数据库[7],所有纳入研究的人群至少两次随访,且随访间隔大于2 年。排除基线时有缺失值、基线时诊断为糖尿病、随访时未确定是否患有糖尿病的参与者。最后,共纳入研究对象13 685 例。糖尿病诊断标准参见《中国2 型糖尿病防治指南(2020年版)》[1]。根据该诊断标准,随访结束时共有315 例诊断为T2DM。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。。
1.2 方法我们记录如下信息:年龄、性别、BMI、TG、HDL-C、血压、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine, Cr)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、空 腹 血 糖(fasting blood glucose,FPG)、吸烟史、饮酒史、T2DM家族史和随访结果(是否患T2DM)。以BMI=24 kg∕m2作为分界点,将所有纳入研究的人群分为两个亚组:BMI<24 kg∕m2亚组和BMI≥24 kg∕m2亚组。其中BMI<24 kg∕m2亚组共有8 238例,96例研究对象在随访结束时患T2DM;BMI≥24 kg∕m2亚组共有5 447 例,219 例研究对象随访结束时患T2DM。根据TG∕HDL-C 的五分位数将研究人群分为五组,即Q1、Q2、Q3、Q4 和Q5 组。研究的终点定义如下:在随访期间,研究对象诊断为T2DM或截至随访结束时未出现终点事件。T2DM 事件的诊断标准参见《中国2型糖尿病防治指南》[1]。
1.3 统计学方法应用R 软件(4.1.0 版本)进行统计分析。数据分为定量数据和定性数据,正态分布的定量数据用±s来表示,非正态分布计量资料采用中位数(第25、75百分位数)即M(P25,P75)表示,定性数据用例(%)表示。分别用单因素方差分析、Kruskal-Wallis 秩和检验、Pearsonχ2检验来分析每组间的差异是否有统计学意义。Cox 比例风险模型用于研究不同亚组间TG∕HDL-C 对T2DM 发生风险的影响,TG∕HDL-C 分别以连续变量和分组变量两种形式代入模型。所有模型都分为不调整任何因素(原始模型),调整性别、年龄(模型Ⅰ)和调整性别、年龄、收缩压、谷丙转氨酶和肌酐(模型Ⅱ)共计3 个模型。绘制Kaplan-Meier 生存曲线以计算不同亚组间累积T2DM 发病率,并且通过限制性立方样条模型评估不同亚组间TG∕HDL-C 与T2DM 发病率之间非线性关系。
2 结果
2.1 一般资料比较在最终纳入研究的13 685 例受试者中,至随访结束共有315 例(2.3%)诊断为T2DM。如表1 所示,在这13 685 例受试者中,男性7 396 例(54.0%),女性6 289 例(46.0%),年龄44.06 岁,TG∕HDL-C 为1.06。根据TG∕HDL-C 的 五分位数,将研究人群分为五组:Q1 组,TG∕HDL-C为0.37±0.07(n=2 737),Q2 组,TG∕HDL-C 为0.58±0.06(n=2 735),Q3 组 的TG∕HDL-C 为0.82±0.08(n=2 736),Q4 组 的TG∕HDL-C 为1.20±0.15(n=2 740),Q5 组 的TG∕HDL-C 为2.35±1.01(n=2 737)。见表1。

表1 糖尿病13 685例一般资料比较
2.2 BMI<24 kg/m2 亚 组中TG 与HDL-C 比 值 与T2DM 发病率之间的关系在BMI<24 kg∕m2的人群中,TG 与HDL-C 比值,与T2DM 发病率之间的关系见表2。在未调整任何变量的模型中,T2DM 发病率随着TG 与HDL-C 比值的升高而显著增加[HR=1.67;95%CI:(1.48,1.89);P<0.01]。将TG∕HDL-C分成五组,以第一组为参照,随着组别的升高,T2DM 发生的风险呈上升趋势(趋势P<0.01)。原始模型未调整任何混杂因素,模型Ⅰ调整了性别和年龄,模型Ⅱ在模型Ⅰ的基础上调整了收缩压、谷丙转氨酶和肌酐,3个模型的结果类似。见表2。

表2 BMI<24 kg∕m2亚组8 238例TG∕HDL-C与T2DM发病风险的关系
2.3 BMI≥24 kg/m2 亚 组中TG 与HDL-C 比值 与T2DM 发病率之间的关系在BMI≥24 kg∕m2的人群中,TG 与HDL-C 比值,与T2DM 发病率之间的关系见表3。在未调整任何变量的模型中,T2DM 发病率随着TG 与HDL-C 比值的升高而显著增加[HR=1.84;95%CI:(1.07,1.31);P<0.01]。将TG∕HDL-C分成五组,以第一组为参照,随着组别的升高,T2DM 发生的风险呈上升趋势(趋势P<0.01)。原始模型未调整任何混杂因素,模型Ⅰ调整了性别和年龄,模型Ⅱ在模型Ⅰ的基础上调整了收缩压、谷丙转氨酶和肌酐,在后两个模型中,随着TG∕HDL-C 的增加,T2DM发病率差异无统计学意义。见表3。
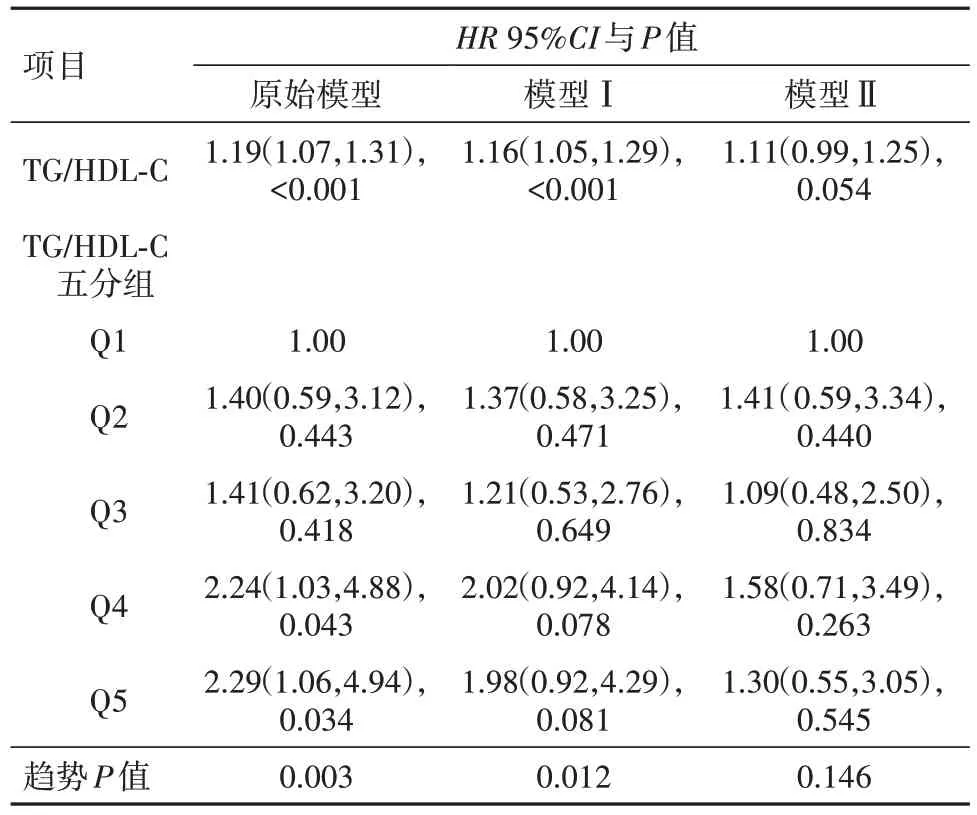
表3 BMI≥24 kg∕m2亚组5 447例TG∕HDL-C与T2DM发病风险的关系
2.4 两亚组的交互作用根据BMI=24 kg∕m2的切点值,将BMI 分为两个亚组,TG∕HDL-C 与BMI 的交互作用P<0.01。
2.5 两亚组T2DM 患病率比较在随访期间共有315 例(2.3%)研究对象患T2DM。Q1、Q2、Q3、Q4 和Q5 的T2DM 分别为0.6%(n=17),1.0%(n=27),2.0%(n=55),3.3%(n=90)和4.6%(n=126)。随着时间延长,BMI<24 kg∕m2和BMI≥24 kg∕m2的亚组患T2DM的人数均增加,且Q1、Q2、Q3、Q4 和Q5 五组中T2DM的患病人数增加均差异有统计学意义(分别为P<0.001和P=0.013)。见图1。
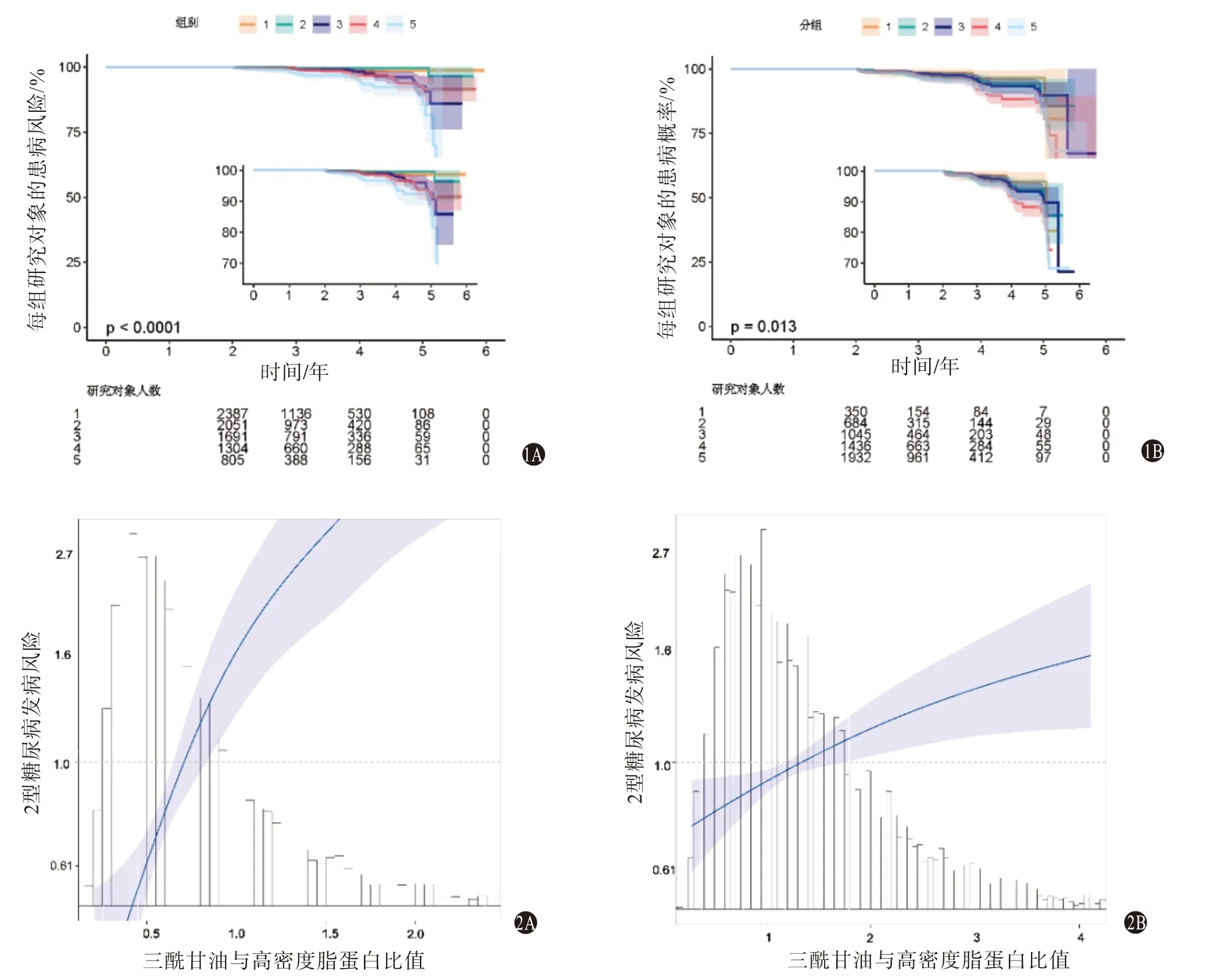
图1 非糖尿病体检人群患2型糖尿病的风险:1A为BMI<24kg/m2组;1B为BMI≥24kg/m 2组图2非糖尿病体检人群TG/HDL-C与T2DM发病率的曲线关系:2A为BMI<24kg/m 2组8238例;2B为BMI≥24 kg/m 2组5 447例
2.6 TG/HDL-C 与T2DM 发病率的曲线关系我们通过使用限制性立方样条分析评估了TG∕HDL-C与T2DM 发病率之间的非线性特征。在对性别、年龄、收缩压、谷丙转氨酶和肌酐进行调整后,我们可以看到:随着TG∕HDL-C 的升高,T2DM 发病的风险逐渐升高并呈现曲线相关性(BMI<24 kg∕m2亚组增长稍快,BMI≥24 kg∕m2亚组增长较慢)。见图2。
2.7 两个亚组中ROC 曲线我们绘制了两个亚组中,以TG∕HDL-C 分别预测3 年和5 年T2DM 发病的ROC 曲线、截断值(BMI<24 kg∕m2:3 年为0.72、0.90;5 年为0.77、0.71。BMI≥24 kg∕m2:3 年为0.55、1.08;5年为0.57、1.05)。
3 讨论
TG∕HDL-C 在预测T2DM 发病率方面显示出相当大的敏感性和特异性[8]。本研究将研究人群根据BMI 分为两组,探讨BMI 联合TG∕HDL-C 预测T2DM发病风险,结果发现:两组人群中,随着TG∕HDL-C的增加,T2DM 发病风险均呈非线性增加,这一变化在BMI<24 kg∕m2的人群中更显著。
血脂异常对T2DM 发展的影响已在之前的研究中得到充分证实。已经发现 TG∕HDL-C 比值是胰岛素抵抗和β 细胞功能障碍的潜在预测标志物[9]。最新研究表明,葡萄糖稳态与脂质代谢密切相关。较高的TG∕HDL-C、TG 和较低的HDL-C 可加速T2DM的发展和进展[10]。在没有诊断出T2DM 的健康个体中,胰腺脂质含量沉积增加可能导致β 细胞功能障碍增强[11]。胰腺三酰甘油储存的减少可能有助于T2DM 中β 细胞功能和胰岛素敏感性的正常化。高脂血症通过诱导胰腺β 细胞凋亡、下调胰岛素的生物合成和分泌以及糖代谢异常来促进T2DM 的发展。这些结果与脂肪酸代谢异常有关,包括脂质沉积、内质网应激、炎症反应、氧化应激和胰岛素信号传导缺陷,最终导致β 细胞损伤和凋亡[12]。相反,HDL-C 已被证明是一种潜在的抗糖尿病因子,可改善胰岛素抵抗和β 细胞功能障碍[13]。另一方面,在胰岛素抵抗或高胰岛素血症的T2DM 病人中,过量的胰岛素分泌可以调节脂蛋白脂肪酶和载脂蛋白的产生以及胆固醇酯转移蛋白的功能,从而进一步促进糖尿病血脂异常的进展[14]。因此,IR、β 细胞功能障碍、TG 和HDL-C 的恶性循环可显著增加T2DM发病和进展的风险。
高的BMI 是众所周知的IR 风险因素[15],而IR是T2DM 发生发展过程中关键的一环[16]。不同BMI的人脂肪的含量是不同的,脂肪组织的特点是乳糜微粒的清除减少和胰岛素介导的脂解抑制受损,这可能导致IR[17]。因此,身体脂肪的含量和IR之间存在直接联系,而IR 则直接影响了T2DM 的发生和疾病进程。本研究就是探讨不同的BMI 状态下,TG∕HDL-C 和T2DM 的关系。结果显示在BMI<24 kg∕m2的亚组中,随着TG∕HDL-C 增加或组别的升高,T2DM 的发病风险均增加,在BMI≥24 kg∕m2的亚组中,在未调整任何混杂因素的情况下,TG∕HDL-C 每升高一个单位,T2DM 的发病风险变为原来的1.84倍。但在调整潜在的混杂因素后,随着TG∕HDL-C的升高,T2DM 的发病风险的增加无统计学意义。既往文献也报道了不同的BMI 人群中,TG∕HDL-C与T2DM 发病风险的不同[8,18]。但是对其中的机制并未进行更多的探讨,我们分析可能在高BMI 的人群中,IR较严重,故血脂水平的变化对T2DM的发病风险影响相对较小。
我们进一步使用非限制性立方样条模型探讨了不同的BMI 分组下TG∕HDL-C 与T2DM 发病风险的非线性相关性。我们发现在两个亚组中,随着TG∕HDL-C 的增加,T2DM 发病风险均升高,并且升高的速度是非线性的,先快后慢。在BMI<24 kg∕m2的亚组中,T2DM 发病风险增加得较快,在BMI≥24 kg∕m2亚组中,增加得较慢。先前的研究表明,一些预测因子的异常,包括血压、体重指数、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇和空腹血糖,不仅与T2DM 独立相关,还与其他疾病如心血管疾病、脑血管疾病、心力衰竭和与这些疾病相关的病死率增加有关[19]。我们绘制了在BMI<24 kg∕m2和BMI≥24 kg∕m2两个亚组中,以TG∕HDL-C 分别预测3 年和5 年T2DM 发病的ROC 曲线,结果发现在BMI<24 kg∕m2亚组中,ROC 曲线下面积均高于0.70,尤其在5年的ROC曲线中,曲线下面积达到了0.77,提示在该亚组中TG∕HDL-C 对T2DM 的发病有很强的预测作用。但是在BMI≥24 kg∕m2的亚组中,ROC曲线下面积均低于0.60,提示在该亚组中TG∕HDL-C与T2DM 的发病风险关联较弱。我们在临床工作中很容易获得病人的血脂,在BMI<24 kg∕m2的人群中,要关注这些病人的TG∕HDL-C,因为这部分人群有较高的患T2DM的风险。
总之,TG∕HDL-C 的升高对T2DM 患病具有一定的预测价值,尤其在BMI<24 kg∕m2的人群中。本研究是回顾性研究,病人没有口服葡萄糖耐量试验,所以可能会造成T2DM 的漏诊此外,随访期间,TG和HDL-C 缺失比较严重,所以我们没有分析TG∕HDL-C 的动态变化与T2DM 的关系。我们使用的是公共数据库,里面没有腰围、臀围等数据,所以我们分析的指标有一定局限性,下一步我们将进一步完善相关数据,加强前瞻性随访,以验证结果。
(本文图1,2见插图1-1)

