氚水对斑马鱼早期发育阶段的剂量-效应关系研究
薛惠元 王天姿 刘坤 崔凤梅 涂彧 孙亮
1苏州大学苏州医学院放射医学与防护学院,放射医学与辐射防护国家重点实验室,苏州215123;2 温州医科大学公共卫生与管理学院,温州325035
沿海地区核设施的建设使得水生生态环境成为放射性污染物的主要接受者,核电正常运行时的液态流出物或事故后释出的大量放射性污染物都会对海洋生态环境产生危害。近年来,由于核电排污的增加,导致氚的排放量增加,并引起了社会各界的广泛关注。此外,氚可以迅速融入环境和生物系统,因此研究电离辐射在一定剂量范围内对水生生物的影响很有必要。氚(3H)是氢元素的放射性同位素之一,会随核反应装置中的冷却水排放入环境[1]。氚流动性极强,可通过食物链进入人体,对人类健康造成影响[2-3]。水生模式动物斑马鱼的基因与人类基因有着高达87%的相似度[4]。有研究结果表明,对非人类物种的研究结果可在一定程度上外推至人体[5]。针对斑马鱼早期发育阶段氚暴露的生物效应也有诸多研究,其结果显示氚暴露可诱发斑马鱼生长发育的改变[6-8]。此外,鱼类早期发育阶段被认为是其生命周期中最敏感的发育时期,可用作评估污染物毒性作用[9-10]。因此,本研究选择处于早期发育阶段的斑马鱼为研究对象,在前期斑马鱼辐射剂量评估的理论基础上[11],尝试将观察到的氚水对斑马鱼的辐射生物学效应与理论剂量计算相结合,以研究剂量-效应关系。
1 材料与方法
1.1 实验动物及试剂
野生型斑马鱼(AB 品系)购于苏州木芮生物科技有限公司。实验经苏州大学伦理委员会同意,符合《实验动物护理和使用指南》的要求。
甲基纤维素(M0387-100G)由美国Sigma-Aldrich®公司提供;氚水(5 mCi,185 MBq)由美国PerkinElmer 股份有限公司提供;闪烁液(UItima Gold LLT, PerkinElmer)由美国PerkinElmer 股份有限公司提供。甲基纤维素溶液、E3 溶液由本实验室自行制备。
根据购买氚水的出厂时间,计算配置溶液时氚水的活度,使用E3 溶液分别稀释得到3.7×103、3.7×104、3.7×105Bq/ml 实验用氚水。
1.2 氚水活度浓度测定及其吸收剂量率的计算
分别取培养皿中3.7×103、3.7×104、3.7×105Bq/ml 3 种浓度氚水各4.5 ml,与6.5 ml 闪烁液于20 ml液闪瓶中混合均匀,避光8~12 h。使用检出限为5 Bq/L 的 液 体 闪 烁 计 数 器(Tri-Carb 2910TR,Quantulus 1220,美国PerkinElmer 股份有限公司)测量。使用公式(1)对氚样品活度浓度进行计算:
式中,A 为氚样品的活度浓度,单位 Bq/ml;cpms为待测氚样品总计数率,单位计数每秒;cpmb为本底样品总计数率,单位计数每秒;V 为测量所用溶液的体积,单位为ml; η为计数效率,无量纲。
根据生物实验中所关注的发育阶段及斑马鱼发育形态的差异,选用斑马鱼受精后24 h(24 hours post fertilization,24 hpf)胚胎和96 hpf 幼鱼为建模对象,使用前期建立的胚胎和幼鱼模型[11]。考虑到散射影响,本研究模拟斑马鱼在培养皿中的实际情况建立相应模型:培养皿直径为90 mm,高度为20 mm,内有30 枚斑马鱼胚胎或10 条斑马鱼幼鱼和25 ml 溶液(根据模拟条件不同有所变化,具体如下文所述)。模拟内照射条件时,斑马鱼胚胎和幼鱼几何条件不变,培养皿中溶液为水,氚在胚胎、幼鱼头部、躯干及卵黄囊中均匀分布,源为各向同性。模拟外照射时,氚在溶液中均匀分布,源为培养皿中圆柱体体积源,直径与培养皿内径相同,源为各向同性。表1 为斑马鱼材料组成,游囊内气体以空气替代。应用蒙特卡罗软件GATE(the geant4 application for tomographic emission)8.2 版,结合实验条件对斑马鱼吸收剂量率进行计算[12]。
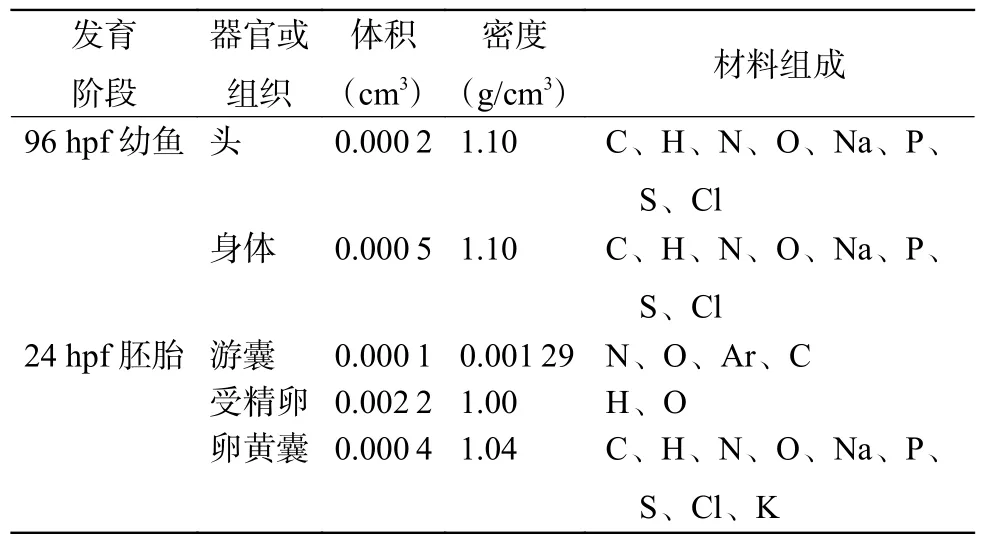
表1 斑马鱼受精后24 h 胚胎和96 h 幼鱼模型的器官体积、密度和组成Table 1 Volume, density and composition of organs of zebrafish 24 hours post fertilization embryos and 96 hours post fertilization larvae models
建立斑马鱼早期发育阶段氚染毒剂量计算模型(图1)。
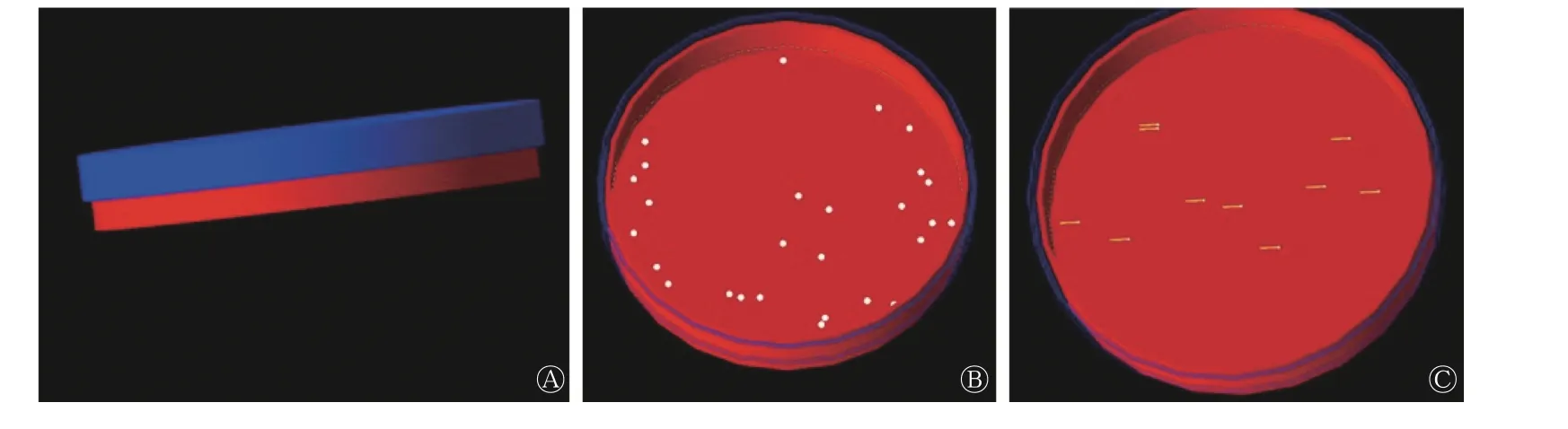
图1 早期发育阶段斑马鱼受精后24 h 胚胎和受精后96 h 幼鱼氚染毒剂量计算模型 A 为模拟的培养皿形态;B 为将30 枚斑马鱼胚胎随机分布于培养皿的30 个点位置;C 为将10 条斑马鱼幼鱼随机分布于培养皿的10 个点位置Figure 1 A model for the calculation of tritium contamination dose for 24 hous post fertilization embryos and 96 hours post fertilization larvae of zebrafish at early developmental stages
根据公式(2)计算斑马鱼的吸收剂量率:
式中,D 为剂量率,单位μGy/h;DCext为外照射剂量系数,单位μGy·L·Bq-1·h-1;DCint为内照射剂量系数,单位μGy·kg·Bq-1·h-1;Aw为水中氚的活度浓度,单位Bq/L;Ao为生物体中氚的活度浓度,单位Bq/kg。
实际实验中,生物体内氚活度由于条件限制难以测量,因此采用浓度比的方法进行计算。本研究中采用Arcanjoa 等[13]文献中的浓度比公式进行计算。
式中,CF 为浓度比,也称为浓集因子,无量纲。定义为生物体内放射性核素的活度浓度与环境介质中放射性核素的活度浓度的比值。Ao为生物体中氚的活度浓度,单位Bq/kg;Aw为水中氚的活度浓度,单位Bq/L。
1.3 斑马鱼翻转频率和心率计数
1.3.1 斑马鱼染毒
取10 对成年斑马鱼,雌雄1∶1 配比放入生殖缸,待受精后收集胚胎,28℃恒温保存在E3 培养液中。对照组为E3 溶液,处理组氚水的3 种浓度分别为3.7×103、3.7×104、3.7×105Bq/ml。将3 hpf胚胎分别暴露于E3 溶液和 3 种不同浓度的氚水中,每组50 枚,并重复3 次实验。
1.3.2 斑马鱼胚胎翻转实验
受精后24 h,在上述3 种不同浓度的氚水中用简单随机抽样方法各选取30 枚斑马鱼胚胎,体式显微镜(中国麦克奥迪实业集团有限公司,Motic SMZ-168)测定胚胎1 min 翻转次数。
1.3.3 斑马鱼幼鱼心率
受精后96 h,在上述3 种不同浓度的氚水中用简单随机抽样方法各选取10 条斑马鱼幼鱼,将其放入甲基纤维素中进行固定,测定20 s 心率。各阶段结果取平均值。
1.4 统计学分析
应用SPSS 20.0 软件对数据进行统计学分析。符合正态分布的数据以±s表示。多组间比较采用单因素方差分析,对照组与处理组之间的比较采用LSD-t检验(方差齐)。P<0.05 为差异有统计学意义。
2 结果
2.1 斑马鱼幼鱼氚染毒剂量计算模型和吸收剂量率
由表2 可知,氚活度浓度的测定结果与理论浓度值的误差在5%以内, 24 hpf 斑马鱼胚胎和96 hpf 幼鱼的内照射剂量系数一致,外照射剂量系数均高于内照射剂量系数,这可能是因为实验条件无法满足“均匀各项同性模型”的假设条件,培养皿的材料中产生了一定的散射线所致;外照射剂量系数96 hpf 幼鱼要略高于24 hpf 胚胎,这可能与外形和材料组成的不同有关。因此,虽然斑马鱼幼鱼氚的实际浓度比较低,但是最终氚的吸收剂量率幼鱼略高于胚胎。

表2 受精后24 h 斑马鱼胚胎与96 h 幼鱼在不同浓度氚水中的测量浓度、浓度比、内外照射剂量系数和吸收剂量率Table 2 Measured concentration, concentration ratio, internal and external radiation dose coefficient and absorbed dose rate after exposure of 24 hours post fertilization embryos and 96 hours post fertilization larvae of zebrafish in different concentrations of tritium water
2.2 氚水对斑马鱼翻转频次和心率的影响
由表2 可知,24 hpf 斑马鱼胚胎在3.7×103、3.7×104、3.7×105Bq/ml 3 种不同浓度的氚水中对应的吸收剂量率分别为2.15×10、2.21×102、2.55×103μGy/h。氚水暴露后,斑马鱼胚胎翻转频率和斑马鱼幼鱼心率结果如图2 所示。各组间斑马鱼胚胎翻转频率的差异有统计学意义(F=7.64,P<0.001),与对照组相比,3.7×103Bq/ml 氚水处理组斑马鱼胚胎翻转频率明显减少(t=3.94,P<0.001);3.7×104Bq/ml 氚水处理组斑马鱼胚胎翻转频率虽有升高趋势,但差异无统计学意义(t=-0.06,P=0.95);3.7×105Bq/ml 氚水处理组斑马鱼胚胎翻转频率无明显改变(t=0.17,P=0.87)。
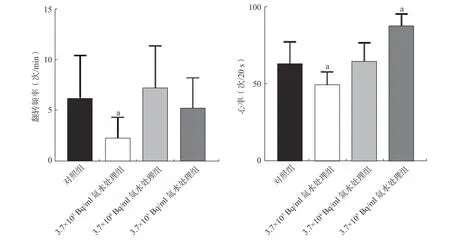
图2 氚水对受精后24 h 斑马鱼胚胎翻转频率和受精后96 h 斑马鱼幼鱼心率的影响 a 表示与对照组比较,差异有统计学意义(t=3.94、2.86、12.12,P<0.001、=0.01、<0.001)Figure 2 Effects of tritiated water on the frequency of zebrafish embryo flipping at 24 hours post fertilization and on the heart rate of zebrafish larvae at 96 hours post fertilization
96 hpf 斑马鱼幼鱼在3 种不同浓度的氚水暴露下,相对应的剂量率分别为2.95×10、3.03×102、3.47×103μGy/h,3 组间斑马鱼幼鱼心率的比较,差异有统计学意义(F=93.85,P<0.001)。由图2 可见,与对照组相比,3.7×103Bq/ml 氚水处理组斑马鱼幼鱼心率明显下降(t=2.86,P=0.01),而3.7×105Bq/ml 氚水处理组斑马鱼幼鱼心率上升(t=-12.12,P<0.001),3.7×104Bq/ml 氚水处理组斑马鱼幼鱼的心率无明显变化(t=1.27,P=0.21)。
3 讨论
斑马鱼胚胎和幼鱼对辐射环境较敏感,低剂量辐射即可对其发育产生影响,还伴随着DNA 损伤和基因表达的变化。Gagnaire 等[9]和Arcanjo 等[14]用氚水对斑马鱼胚胎和幼鱼进行染毒,结果显示,0.4 mGy/h 和4 mGy/h 2 种剂量率的斑马鱼自发翻转次数与对照组的差异无统计学意义,但随着发育时间的不同,自发翻转次数也有变化;在0.4 mGy/h剂量率下,96 hpf 幼鱼游泳活性较对照组有明显下降,但在4 mGy/h 剂量率下,2 组的差异无统计学意义。其原因可能与氚水调节编码肌肉收缩的相关基因引起DNA 损伤、神经毒性及免疫毒性有关。有研究结果表明,自然情况下,斑马鱼胚胎自发翻转频率先上升后下降,在19 hpf 时达到巅峰,然后至26 hpf 缓慢下降[15]。在另一项关于双酚A 对斑马鱼神经发育毒性的研究结果也表明,发育时间的长短可以影响斑马鱼胚胎自发翻转[16]。在本研究中,2.21×102μGy/h 吸收剂量率下,胚胎自发翻转频率轻微上升,可能是因为我们实验观察斑马鱼翻转情况是在受精后23~27 h 进行,从而由于发育时间的不同造成的。因此在本研究所对应的吸收剂量率下,也许会影响斑马鱼有关神经发育或肌肉运动的基因表达;同时,高剂量诱发了斑马鱼胚胎的损伤保护机制,使得较高剂量氚水处理组胚胎翻转频率与对照组无明显差异。
Arcanjo 等[6]在0.4 mGy/h 和4 mGy/h 2 种氚暴露剂量情况下,对 24 hpf 斑马鱼胚胎和96 hpf 斑马鱼幼鱼进行转录组分析,结果表明,无论剂量率如何,在24 hpf 斑马鱼胚胎中,氚水污染对斑马鱼调控肌肉收缩的基因均有影响,但在不同剂量率下差异表达基因的种类及调控方式不同,只有少部分差异表达基因之间有所重叠。在剂量率为0.4 mGy/h时,暴露于氚水24 h 后,有关斑马鱼肌肉收缩的基因有所上调,而剂量率为4 mGy/h 时,有关斑马鱼肌肉收缩的基因却出现下调的情况。本研究中,3.7×103Bq/ml与3.7×105Bq/ml 不同浓度氚水处理组斑马鱼却表现出截然相反的心率变化,其可能原因是由于基因表达不同所造成的。Arcanjo 等[14]在之后的研究中对72 hpf、96 hpf 斑马鱼心率进行观察,结果显示,发育时间对不同剂量率的心率有显著的影响,生物体也许可以通过早期基因表达的变化来应对氚毒性效应。
斑马鱼24 hpf 和96 hpf 是辐射生物学效应研究中观察生物学评价终点常见的时间点。本研究通过观察氚染毒条件下斑马鱼24 hpf、96 hpf 这2 个重要发育阶段的翻转频率和心率生物学指标,结合实验环境,计算斑马鱼早期发育阶段的吸收剂量率,将剂量计算结果与观察到的生物效应相结合,结果表明,斑马鱼受照剂量随发育时间的增长有所提高,这可能是由于幼鱼破膜骨性材料增加所致。斑马鱼胚胎翻转实验中,当前剂量率中胚胎翻转频率的轻微上升可能是胚胎发育时间轻微不同和有关神经发育或肌肉运动的基因表达受到影响造成的。较高剂量处理组翻转频率与对照组无明显差异,这可能是由于高剂量诱发了胚胎的损伤保护机制所致。同时,胚胎自发翻转的实效性,对在一个时间段内进行的翻转计数结果有一定的影响,后期实验应尽量避免该情况。在斑马鱼心率实验中,幼鱼心率随浓度的变化可能是由于不同剂量率下,基因调控行为不同而导致的。
本研究由于鱼体较小,且发育速度较快,未开展不同组织滞留核素相互影响的定量分析。并且假设核素在氚染毒环境和斑马鱼器官内均匀分布,这一假定对于某些体内再分布的核素而言具有一定局限性。上述假定和不足都是今后优化斑马鱼模型和进行剂量-效应关系研究工作的重点。
利益冲突 所有作者声明无利益冲突
志谢 感谢江苏省高校协同创新中心对本研究的支持
作者贡献声明 薛惠元负责模型的建立、论文的撰写;王天姿负责实验内容与数据的分析;刘坤负责数据的采集与整理;崔凤梅、涂彧负责论文撰写的指导与修改;孙亮负责论文的设计、审阅与修改
- 国际放射医学核医学杂志的其它文章
- 重水堆核电厂氚职业内照射的辐射防护管理实践
- 氚水长期暴露对斑马鱼子代生长发育影响的研究

