富血小板血浆联合玻璃酸钠关节腔注射治疗膝骨关节炎的临床效果
刘燕,徐鹏,藏剑,孙文晓
骨性关节炎指慢性骨骼、肌肉退行性病变,伴关节僵硬、疼痛、肿胀等症状。膝骨关节炎(KOA)为骨性关节炎中较为常见的一种,病变会影响膝关节结构,包括关节附近肌肉、软骨下骨、韧带、滑膜及关节软骨等[1]。膝关节内应力变化、损伤、退行性变化会进行性破坏到关节软骨,本质为关节软骨机制合成和分解代谢紊乱,可能与遗传、关节畸形、女性绝经、关节创伤、肥胖及年龄等因素有关[2]。因此,改善膝关节功能、缓解膝关节疼痛的主要途径是促进修复关节软骨组织、延缓病变进展。非手术疗法凭借自身创伤性小、疗效可观等优势,已在KOA病变治疗中获得一定疗效,但需患者长时间治疗。关节腔注射玻璃酸钠,对关节有润滑效果,可缓解疼痛,但对修复关节软骨是否有促进作用目前暂未明确。富血小板血浆(PRP)是经相应技术从全血内提取血小板浓缩物。张莲等[3]报道称,PRP能促进合成细胞外基质、软骨细胞增殖,用于KOA治疗有效、安全。为提升疗效,近年来笔者医院已尝试关节腔注射玻璃酸钠与PRP联用于KOA治疗中,取得满意疗效。本研究观察PRP联合玻璃酸钠关节腔注射治疗KOA的临床效果,报道如下。
1 资料与方法
1.1 临床资料 选取2021年7月—2022年7月珠海市中西医结合医院收治的KOA患者120例,根据随机数字表法分为玻璃酸钠关节腔注射组(A组)、PRP关节腔注射组(B组)、PRP联合玻璃酸钠注射组(C组),每组40例。A组年龄45~71(52.69±1.24)岁;病程1.21~5.68(3.58±0.16)年;Kellgren-Lawrence分级:Ⅰ级14例,Ⅱ级15例,Ⅲ级11例;左侧21例,右侧19例。B组年龄46~72(52.87±1.21)岁;病程1.25~5.75(3.64±0.15)年;Kellgren-Lawrence分级:Ⅰ级15例,Ⅱ级16例,Ⅲ级9例;左侧22例,右侧18例。C组年龄44~73(52.62±1.25)岁;病程1.22~5.78(3.52±0.16)年;Kellgren-Lawrence分级:Ⅰ级14例,Ⅱ级16例,Ⅲ级10例;左侧20例,右侧20例。3组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准,患者和家属签署知情同意书。
1.2 病例选择标准 纳入标准:患者符合《自体单采富血小板血浆关节腔注射治疗膝骨关节炎的专家共识》[4]中膝关节炎诊断标准、关节腔注射指征,且影像学显示存在关节腔狭窄者;视觉模拟评分法(VAS)评分>7分。排除标准:伴凝血功能障碍者;伴类风湿性关节炎者;有膝关节手术史、膝关节外伤史者;存在认知功能障碍、语言障碍及精神疾病患者;恶性肿瘤患者;Kellgren-Lawrence分级为Ⅳ级者;膝关节畸形、膝关节冠状面夹角>10°、运动角度伸展<20°或屈曲<90°者;中途中断治疗或存在治疗禁忌者。
1.3 治疗方法 A组接受玻璃酸钠关节腔注射,患者仰卧屈膝,从膝关节外上侧部位穿刺,常规消毒后进针,患者感到突破感后提示已刺入关节腔中,回抽关节液,关节腔匀速注入玻璃酸钠注射液(华熙生物科技股份有限公司生产)2 ml,注射完毕后覆盖敷料,指导患者膝关节做屈伸活动。B组接受PRP关节腔注射,PRP制备用套装由威海联生医疗器械有限公司提供,注射方式同A组,注射量为2 ml。C组接受PRP联合玻璃酸钠关节腔注射,注射方式同A组,PRP 1 ml+玻璃酸钠1 ml。3组均1周注射1次,持续治疗3次。
1.4 观察指标与方法 (1)血清炎性因子:治疗前后采集患者空腹静脉血液4 ml,离心处理获得血清,采用酶联免疫吸附试验检测超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)水平。(2)膝关节功能、疼痛评分:治疗前与治疗后1个月、3个月、6个月、12个月时,采用骨性关节炎指数(WOMAC)进行判定,包括关节功能、僵硬等方面,共24个项目,分值<80分为轻度,80~120分为中度,>120分为重度[5];采用VAS评分判定疼痛程度,分值0~10分,0分为无痛,10分为剧烈疼痛[6]。
1.5 疗效评价标准 显效:治疗后疼痛消失,膝关节能正常收放,可正常活动、生活,不影响睡眠;有效:治疗后疼痛得到缓解,疼痛可忍受,但膝关节活动稍微受限;无效:症状无改善,疼痛影响睡眠、生活。总有效率=(显效+有效)/总例数×100%。
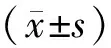
2 结 果
2.1 治疗效果比较 C组治疗总有效率为97.50%,高于A组的62.50%、B组的65.00%,差异有统计学意义(χ2=15.393,P<0.001),见表1。

表1 3组治疗效果比较 [例(%)]
2.2 血清炎性因子比较 治疗前3组血清hs-CRP、TNF-α、IL-1β水平比较差异无统计学意义(P>0.05);治疗后3组血清hs-CRP、TNF-α、IL-1β水平均低于治疗前,且C组低于A组、B组,差异有统计学意义(P均<0.01),见表2。

表2 3组治疗前后血清炎性因子比较
2.3 WOMAC、VAS评分比较 治疗前3组WOMAC、VAS评分比较差异无统计学意义(P>0.05);治疗后1个月、3个月、6个月、12个月3组WOMAC、VAS评分低于治疗前,且C组WOMAC、VAS评分低于A组、B组,差异有统计学意义(P均<0.01),见表3。

表3 3组不同时点WOMAC、VAS评分比较分)
3 讨 论
KOA高发于女性中老年群体,典型表现为软骨破坏与退变,并合并有韧带、半月板、滑膜等组织功能变化,表现为肢体功能障碍、肿胀、疼痛,且患者主要因疼痛而就诊。目前认为KOA发病与职业、肥胖、性别、年龄等因素相关,其中最为密切的是年龄。近年来我国老龄化问题日益严重,KOA发病率明显增高,KOA在我国发病率达8.1%。相关数据显示,2020年全球年龄>40岁人群中约有6.5亿人KOA发病,KOA也是老年人群致残的主要因素[7]。
目前临床治疗KOA,涉及到机械力传导、代谢、免疫、遗传等方面。口服药物为主要疗法,包括软骨保护药物、非甾体抗炎药物,非甾体抗炎药物可明显缓解疼痛,但药效时间短,常需长时间服用,不良反应多。膝关节药物注射也是主要疗法,可选择的药物有PRP、激素、玻璃酸钠等,其中PRP、玻璃酸钠为常用药物。苏鸿年等[8]报道称,经透明质酸钠+PRP治疗KOA,其疗效可达98.33%,且患者膝关节功能评分、疼痛评分更佳,利于症状缓解和关节功能恢复。本研究结果显示,C组治疗总有效率高于A组、B组,表明PRP+玻璃酸钠关节腔注射的疗效优势明显。分析原因,关节腔注射玻璃酸钠能适当补充内源性滑液,可降低滑膜部位炎性反应,抑制病变进展。但单一使用此药物无法彻底处理软骨退变问题。PRP可更持久地缓解疼痛和改善关节功能,可重建关节功能和表面、修复关节软骨,控制病变进展[9]。因此,联用治疗疗效显著。
本研究结果显示,3组治疗后血清hs-CRP、TNF-α、IL-1β水平均出现降低,且C组低于A组、B组,证实联用PRP治疗后疗效更佳。黄小华等[10]报道称,KOA患者经PRP治疗后,机体炎性因子可得到明显控制,进而间接反映疗效。分析原因,激活PRP后能产生富含生长因子的纤维蛋白支架,对创面有收缩效果,负载细胞,进而产生凝血功效。PRP内类胰岛素生长因子、转化生长因子、血管内皮生长因子,并含丰富的炎症调节因子和生长因子,此类生长因子会对靶细胞受体产生作用,诱导生成靶基因,促进修复蛋白和细胞再生,修复组织,并对炎性因子有调控作用,逐步控制机体炎性反应。本研究结果还显示,3组治疗后1个月、3个月、6个月、12个月的WOMAC、VAS评分低于治疗前,且C组WOMAC、VAS评分低于A组、B组,表明联用PRP能更好地改善患者膝关节功能、疼痛症状。分析原因,PRP可进一步改善细胞新陈代谢活力,降低细胞凋亡率,产生一种与纤维支架结构类似的胶样结构[11];且PRP中含大量生长因子,可促进生成软骨基质,对软骨增生有刺激作用,结合干细胞后,能持续调节机体抗炎、免疫功能,进而修复损伤软骨,因此可持续降低疼痛感。
综上所述,PRP联合玻璃酸钠关节腔注射治疗KOA效果显著,可明显调节炎性因子水平,改善膝关节功能,缓解疼痛。
利益冲突:所有作者声明无利益冲突。

