Rotigotine长链酯改善帕金森病小鼠嗅觉障碍的机制
郭春敏,张 红,田付港,于 昕
(烟台大学药学院,分子药理和药物评价教育部重点实验室(烟台大学),新型制剂与生物技术药物研究山东省高校协同创新中心,山东 烟台,264005)
帕金森病(Parkinson′s disease,PD)是世界第二大神经退行性疾病,其临床表现包括震颤、行动迟缓、姿势不稳等运动症状及嗅觉损伤、认知减退、抑郁等非运动症状,其中嗅觉障碍作为PD典型的非运动症状在PD患者中的发病率高达90%[1-2],但其发病机制尚不清楚,研究表明其可能涉及神经递质系统紊乱、α-syn异常聚集、神经免疫炎性反应等[3]。目前临床上对PD嗅觉障碍的治疗尚无明确的指导药物,仅局限于嗅觉训练、深部脑刺激等物理方法[4]。有文献报道,多巴胺(Dopamine,DA)受体激动剂可以改善PD大鼠的嗅觉障碍,但其具体作用机制均未被探讨[5-6]。罗替戈汀(Rotigotine)作为D3D2D1受体激动剂,是治疗原发性帕金森病运动症状的一线药物。Rotigotine长链酯(Rotigotine long chain ester,RLCE)是一种长效微晶制剂,进入体内可实现28~30 d持续稳定释放Rotigotine。因此,本实验通过腹腔注射1-甲基-4-苯基-1,2,3,6,-四氢吡啶(1-methy1-4-pheny1-1,2,3,6-tetrahydropyridine,MPTP)制作PD小鼠模型,评价RLCE对PD嗅觉障碍的改善作用,同时在α-syn的聚集和神经炎症等方面探讨其可能的作用机制,为PD嗅觉障碍的治疗提供实验依据。
1 实验材料
1.1 实验动物
雄性SPF级C57BL/6小鼠,50只,8~10周龄,质量20~25 g,济南朋悦实验动物繁育有限公司,动物许可证号:SCXK(鲁)20190003,质量合格证流水号:370726211101063435。小鼠饲养在山东绿叶实验动物中心SPF级屏障饲养环境,室温保持(23 ± 2)℃,垫料每周更换一次,自由饮水及采食,人工照明12 h/12 h明暗交替。本研究经过烟台大学动物伦理委员会批准。
1.2 药品与试剂
RLCE,山东绿叶制药有限公司生产;MPTP,批号:L2031451(上海阿拉丁生化科技股份有限公司);GTVision TMIII 型免疫组化检测试剂盒(含DAB),(上海基因科技股份有限公司);TH抗体、GFAP抗体、IBA1抗体、iNOS 抗体(CST); β-actin 抗体(小鼠单抗)、BCA 浓度测定试剂盒(增强型)、酶标山羊抗兔 IgG、山羊抗鼠 IgG (碧云天生物技术公司)。
1.3 仪器
离心机(上海贝克曼库尔特有限公司); 酶标仪(美国伯腾仪器有限公司); 全自动化学发光成像凝胶成像系统(北京赛智创业科技有限公司); 石蜡切片机(上海赛默飞世尔科技有限公司); Vectra3定量病理成像分析系统(上海珀金埃尔默企业管理有限公司)。
2 方 法
2.1 实验分组与造模
C57(每组10只,全雄)小鼠随机分为正常组,模型组,RLCE低(11.2 mg·kg-1)、中(22.4 mg·kg-1)、高(44.8 mg·kg-1)剂量组。根据文献报道的剂量和方法[7],结合预试验结果,模型组及给药组小鼠以0.1 mL/10 g的给药体积连续腹腔注射MPTP(25 mg·kg-1) 28 d,正常组小鼠给予等体积的生理盐水。于MPTP造模前48 h对给药组小鼠以0.05 mL/10 g的给药体积单次肌肉注射RLCE,正常组与模型组小鼠给予等剂量的1% CMC-Na,并于给药后26~30 d进行行为学观察。
2.2 行为学实验
2.2.1 埋丸实验 埋丸实验检测小鼠的嗅觉识别能力[8]。将食物颗粒埋藏在干净的玉米垫料下0.5 cm处,小鼠进入鼠盒时开始计时。记录小鼠寻找食物颗粒的时间,若5 min找不到即记为300 s,允许小鼠找到食物颗粒后吃完作为奖励。实验连续进行3 d,取三次平均值进行统计;第四天将食物颗粒放在垫料表面,记录各组小鼠寻找食物颗粒的时间,以排除各组小鼠因缺乏动机造成的差异。
2.2.2 木块实验 以木块实验检测小鼠嗅觉辨别能力[8]。准备实验木块2 cm×2 cm×2 cm,放入装有雌鼠笼垫料的袋子内,室温放置24 h。实验时,试验区域分别放置带有雌性小鼠的气味的木块和不作任何处理的空白木块。在实验区域的正中央放入实验鼠,录像5 min,统计小鼠嗅闻目标木块(带有雌性小鼠气味)的时间与空白木块的时间。计算小鼠的识别指数:

2.3 Western Blot 实验
每组随机取3只小鼠,断颈,心脏灌流,分离嗅球。RIPA裂解,超声,15 000 r·min-1离心15 min,BCA法配置蛋白,以每孔50 μg的上样量进行蛋白电泳,转膜,常温牛奶孵育2 h,一抗4 ℃过夜处理,次日二抗常温孵育2 h,采用ECL显影液显影。Image J 2.0软件进行分析,相对积分光密度(IDO)比值表示结果。
2.4 免疫组化法检测小鼠黑质及嗅球TH的表达
每组随机取3只小鼠,断颈,采用4 %多聚甲醛进行心脏灌注,取脑,4 ℃固定24 h。脑组织脱水固定,按照免疫组化试剂盒中的步骤进行染色并封片。Vectra3定量病理成像系统拍摄图片,Image J 2.0软件进行分析。
2.5 统计学方法
3 实验结果
3.1 小鼠的状态和数量观察
给予MPTP 30 min后小鼠均出现震颤、行动迟缓、肢体僵硬、步态不稳、弓背、竖毛等情况。且在造模后期进行的行为学试验中,模型组表现出明显的嗅觉障碍,造模期间小鼠无死亡情况发生。RLCE治疗后PD小鼠的震颤、行动迟缓、肢体僵硬、步态不稳、弓背、竖毛现象得到改善。
3.2 RLCE对PD小鼠嗅觉障碍的影响
如图1所示,第1~3天的实验中,与正常组相比,模型组小鼠寻找食物颗粒的时间显著延长(###P<0.001),提示模型组小鼠出现了嗅觉察觉功能障碍;与模型组相比,RLCE各给药组小鼠寻找食物颗粒的时间显著降低(**P<0.01),结果表现出剂量依赖,提示RLCE改善了PD小鼠的嗅觉察觉功能障碍。第4天的实验中各组小鼠寻找食物颗粒的时间无显著性差异,因此排除小鼠因缺乏动机造成的实验结果的差异。
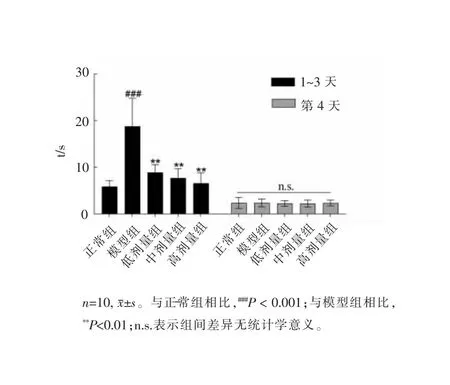
图1 埋丸实验结果
如图2所示,与正常组相比,模型组小鼠对目标木块的识别指数显著降低(##P<0.01),说明模型组小鼠嗅觉辨别功能发生障碍;与模型组相比,RLCE各给药组小鼠对目标木块的识别指数显著提高(*P<0.05,**P<0.01),结果表现出剂量依赖性,提示RLCE改善了PD小鼠的嗅觉辨别能力。
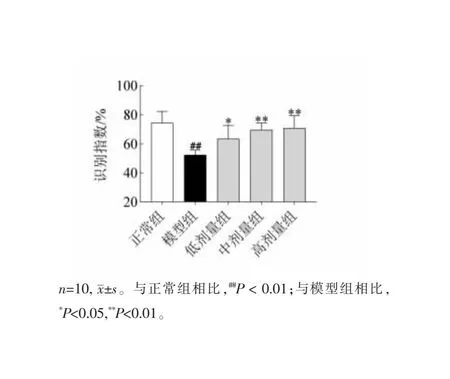
图2 木块实验结果
3.3 RLCE对PD小鼠嗅球及黑质 TH 表达的影响
如图3所示,与正常组比较,模型组黑质TH神经元的表达量显著降低(##P<0.01),与模型组相比,RLCE各给药组黑质TH神经元的表达量均显著增多(**P<0.01),结果表现出剂量依赖,说明RLCE对PD小鼠黑质的TH神经元具有保护作用。

图3 各组小鼠黑质TH神经元的表达情况
如图4所示,与正常组比较,模型组嗅球的TH神经元的表达量显著升高(##P<0.01),与模型组相比,RLCE各给药组嗅球TH神经元的表达量均显著下降(**P<0.01),结果表现出剂量依赖,说明RLCE可抑制PD小鼠的TH神经元在嗅球内的异常增多。
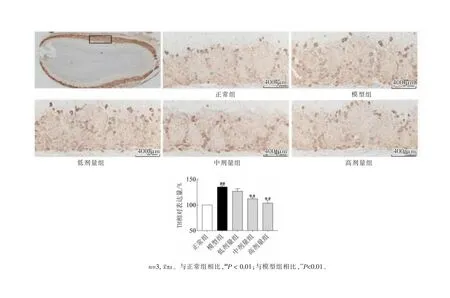
图4 小鼠嗅球TH神经元的表达情况
3.4 RLCE对PD小鼠嗅球蛋白表达的影响
3.4.1 RLCE对PD小鼠嗅球α-syn及P-α-syn表达的影响 如图5所示,Western Blot 实验结果显示,与正常组相比,模型组小鼠嗅球α-syn、P-α-syn的表达量显著提高(##P< 0.01);与模型组相比,各给药组小鼠α-syn、P-α-syn的表达量显著降低(**P<0.01)。图6的免疫组化结果表明,模型组嗅球α-syn、P-α-syn的表达量显著提高,RLCE给药显著降低了嗅球α-syn、P-α-syn的表达,结果提示RLCE可以显著抑制PD小鼠嗅球α-syn的聚集及磷酸化。

图5 小鼠嗅球α-syn及P-α-syn蛋白表达情况
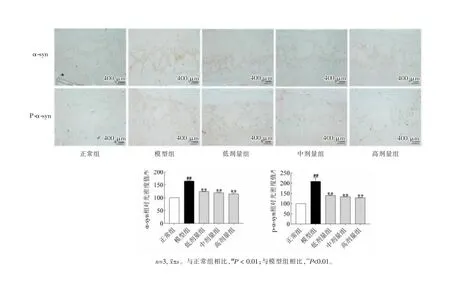
图6 小鼠嗅球α-syn及P-α-syn蛋白表达情况
3.4.2 RLCE对PD小鼠嗅球炎症相关蛋白表达的影响 如图7所示,与正常组相比,模型组小鼠嗅球IBA1、GFAP、iNOS的表达量显著提高(##P<0.01),与模型组相比,各给药组IBA1、GFAP、iNOS的表达量显著降低(**P<0.01),表现出剂量依赖,说明RLCE可显著降低PD小鼠嗅球内的炎症反应。

图7 小鼠嗅球IBA1、GFAP和iNOS蛋白的表达情况
4 讨 论
PD是一种好发于老年人的神经退行性疾病,主要病理表现为黑质DA神经元缺失以及纹状体神经末梢退行性变,但PD的病理改变并不局限于黑质-纹状体系统,BRAAK等提出PD的标志性蛋白α-syn在PD早期首先出现在嗅球以及前嗅核[9],因此嗅觉功能障碍是PD 疾病进展中最早发生的非运动症状之一。Rotigotine是典型的DR受体激动剂,能有效改善PD运动症状,但其在PD嗅觉障碍中的应用未被明确探讨。本研究评价RLCE对PD小鼠嗅觉障碍的改善作用,同时在α-syn的聚集和神经炎症等方面探讨其可能的作用机制,为PD嗅觉障碍的治疗提供实验依据。
MPTP及其代谢产物通过损害线粒体电子传递链,导致活性氧的产生,诱导DA神经元凋亡,从而产生类PD样症状和病理特征[10],研究证实,MPTP可以诱导C57小鼠出现嗅觉障碍[11]。行为学观察发现,与正常组比较,模型组小鼠寻找食物颗粒的时间显著延长,对目标木块的识别指数显著下降,表明模型小鼠的嗅觉功能明显降低,证实动物模型已成功构建。此外,给予RLCE可以明显改善PD小鼠的嗅觉功能,且具有剂量依赖性,表明RLCE对PD嗅觉障碍具有治疗作用。
TH是DA合成的限速酶,黑质内DA神经元丢失、TH神经元活性下降是PD的病理标志[12]。黑质的DA神经元可直接投射到嗅球的球周细胞层(GL),介导嗅觉感知。有研究发现,PD患者嗅球内TH可增加到原来的两倍,认为可能是对黑质DA能神经元丢失的代偿反应[13],且该过程可能与嗅觉障碍有关。本研究对黑质和嗅球进行了TH神经元的免疫组化染色,结果表明RLCE可增加黑质内TH神经元数量,降低嗅球GL内TH神经元的表达,说明RLCE可通过增加PD小鼠中脑黑质TH神经元的数量,来抑制嗅球内TH神经元的代偿性增加。该结果可以解释RLCE对PD嗅觉障碍的改善作用。
神经炎症反应在PD的发生、发展中起到重要的作用。研究表明,嗅觉神经系统对炎症因素存在易感性,而α-syn在神经元中的异常聚集是神经炎症的主要刺激因素,一方面表现为小胶质细胞和星形胶质细胞的异常活化,导致固有免疫系统异常,增加对受损神经元的攻击;另一方面活化的小胶质细胞对α-syn降解效率显著下降,进一步促进α-syn的聚集[14],加重嗅觉障碍病理。IBA1是一种小胶质细胞特异性钙结合蛋白,是小胶质细胞活化的标记[15]。GFAP是星形胶质细胞活性的标志,活化的星形胶质细胞会激活诱导型一氧化氮合酶(iNOS)产生NO,从而激活炎症反应[16]。实验结果表明,RLCE给药可降低嗅球α-syn、P-α-syn以及IBA1、GFAP、iNOS的表达,说明RLCE可抑制嗅球内胶质细胞及小胶质细胞的激活,降低炎症反应,且该过程可能与其降低α-syn的聚集及磷酸化互为因果。
5 结 论
本研究结果表明,RLCE可以改善PD小鼠的嗅觉障碍,该过程可能与RLCE抑制PD小鼠嗅球内胶质细胞及小胶质细胞的激活,降低嗅球内的炎症反应,减少α-syn的聚集及磷酸化,并降低嗅球内TH的代偿性增加有关。

