黄芩苷对干酵母致热大鼠的解热作用及血清TNF-α、IL-1β、IL-6、PGE2、cAMP和脑组织NF-κB表达的影响
吴 迪,王 清,张殿文,李 伟,李 响
(1吉林省中医药科学院·吉林 长春 130012;2吉林大学基础医学院·吉林 长春 130021)
发热是各种疾病常见的临床症状,西医常规给予解热药等进行治疗,反复应用易出现一定的副作用。而中药治疗不仅标本兼治,可双向调节且毒副作用较小[1-2]。黄芩是清热复方制剂中应用较为广泛的中药之一,具有清热泻火解功效[3]。黄芩黄酮类化合物的含量较高,黄芩苷具有抗氧化、抗炎、抗菌、抗病毒、抗肿瘤、抗抑郁、解热、降压和抗变态反应等药理作用[4]。在很黄芩复方制剂中,黄芩苷解热作用显著[5],其解热机制还不十分清楚。本研究采用背部皮下注射干酵母方法构建大鼠发热模型,观察不同剂量不同时间黄芩苷的解热作用,通过检测大鼠血清TNF-α、IL-1β、IL-6、PGE2和cAMP的含量以及脑组织NF-κB表达,探讨其解热机制。
1 实验材料
1.1 实验动物 健康SPF级SD 大鼠75 只,雄性,6周龄,体质量180~200 g,购自辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(辽)2020-0001,质量合格证号为210726220101217356。实验前适应环境3 d,屏障条件下常规喂养,自由摄取水和食物。
1.2 药物及试剂 黄芩苷:购自润友化学(深圳)有限公司,批号G07S11L123706;阿司匹林肠溶片:购自沈阳奥吉娜药业有限公司,国药准字H20065051。酵母浸粉:北京奥博星生物技术有限责任公司,批号20210302;RIPA裂解液:北京康为世纪生物科技有限公司;BCA蛋白浓度测定试剂盒:上海碧云天公司;TNF-α、1L-1β、1L-6、PGE2和cAMP ELISA试剂盒:美国BD公司。
1.3 主要仪器 ST-360酶标仪:上海科华实验系统有限公司;DT5-3低速台式离心机:北京时代北利离心机有限公司;HC-3618R型高速冷冻离心机:安徽中科中佳科学仪器有限公司;KZ-II高速组织研磨仪:武汉赛维尔生物科技有限公司;微量移液器:德国Eppecdorf公司;BT255天平:北京赛多利斯科学仪器有限公司。
2 方法
2.1 动物分组、造模及给药 取适应环境的SD大鼠75 只,实验前测量大鼠的基础肛温。剔除体温超过正常范围或相邻两次体温差值过大的动物。取其平均值作为基础体温。选出符合实验条件的大鼠70 只,分为正常对照组10 只(蒸馏水10 mL/kg)、造模组60 只(20%干酵母10 mL/kg)。造模组随机分为模型组(蒸馏水10 mL/kg),阿司匹林肠溶片组(0.1 g/kg),黄芩苷高、中、低剂量组(160、80、40 mg/kg),每组12 只。正常组和模型组灌胃相同体积的蒸馏水,其他各组分别给予相应药液,每日1 次,连续3 d。第3 天采用酵母菌诱导大鼠发热模型[6-7]。实验前12 h禁食不禁水,给药第3 天,除正常组背部皮下注射生理盐水(10 mL/kg),其余各组均背部皮下注射20%干酵母混悬液(10 mL/kg)。酵母菌注射2 h后,给予第3 天药液。
2.2 观察指标及检测方法
2.2.1 体温测定 造模组大鼠皮下注射干酵母混悬液后,每间隔1 h测量1 次体温,造模成功后(约2 h),每组选择造模成功的10 只大鼠进行测温。各组分别灌胃给予相应药液,药后1、2、3、4 h各测量体温1 次,记录数据。
2.2.2 血清TNF-α、IL-1β、IL-6、PGE2与cAMP含量测定 末次测温后,3%水合氯醛溶液腹腔注射麻醉(300 mg/kg,10 mL/kg),解剖大鼠,腹主动脉取血,静置,4 ℃、离心半径8 cm,2 500 r/min离心10 min,收集上清液,按照试剂盒说明书方法,ELISA方法测定大鼠血清TNF-α、IL-1β、IL-6、PGE2、cAMP含量。
2.2.3 脑组织NF-κB p65蛋白表达的Western Blot检测 称取100 mg脑组织加入RIPA裂解液及磷酸酶抑制剂于1.5 mL的EP管中,超声粉碎后静置15~20 min,4 ℃、12 000 r/min离心15 min,取上清用BCA法进行蛋白定量;Western blot法检测NF-κB p65蛋白表达,以β-actin为内参,根据蛋白灰度比值,计算相对表达量。
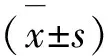
3 实验结果
3.1 各组大鼠体温变化 见表1。
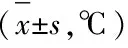
表1 各组大鼠体温变化比较
3.2 各组大鼠血清TNF-α、IL-1β、IL-6、PGE2、cAMP含量变化 见表2。

表2 各组大鼠血清TNF-α、IL-1β、IL-6、PGE2、cAMP水平比较
3.3 各组大鼠脑组织NF-κB p65蛋白表达的Western Blot检测结果 见图1~图2。
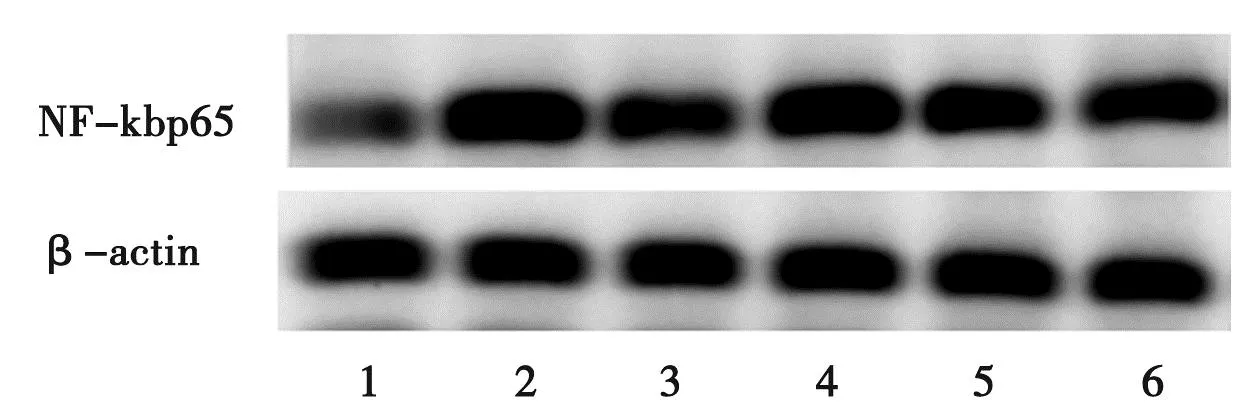
注:1.正常组;2.模型组;3.阿司匹林组;4~6.黄芩苷高、中、低剂量组图1 各组大鼠脑组织NF-κB p65蛋白表达的Western Blot 检测结果

注:1.正常组;2.模型组;3.阿司匹林组;4~6.黄芩苷高、中、低剂量组与模型组比较 *P<0.05,**P<0.01图2 各组大鼠脑组织NF-κB p65表达的比较
4 讨论
利用干酵母构建发热模型是研究药物解热作用机制的常用方法[8]。注射酵母菌后,注射部位发生局部溃烂,从而引发剧烈炎症反应而发热[9]。龚春燕[10]利用干酵母诱导发热模型明确了酵母菌的致热作用。党珏[11]吴佳霖[12]等的研究证实干酵母致热后动物体温的发展变化趋势,本文模型组动物体温的发展变化与之相一致。干酵母诱导体温升高后,促进内生致热原的产生和释放,同时激活体内的内生致热原细胞[13]。目前公认的参与多种致热性发热的重要细胞因子包括 TNF-α、IL-1β、IL-6[14],其通过作用于中枢体温正性调节介质,促使下丘脑前部视前区的体温正调节中枢核将体温调定点上调,引起发热[15]。PGE2是与体温调节有关的主要介质,同时也是最强的内生致热源之一[16-17]。研究表明,发热时动物的血清或者脑脊液中PGE2含量增高。cAMP是发热中枢正调节介质[18],cAMP含量增多,体温相对应升高,二者成显著正相关[19]。PGE2和cAMP可通过某种特定方式作用于下丘脑,使体温调定点上移,引起体温升高。NF-κB是细胞内转录因子家族的通用名称,参与机体的应激反应、炎症反应、免疫应答和调节细胞凋亡等,是重要的核转录因子和关键介质[20]。一系列致病刺激如:细菌毒性产物和病毒蛋白、炎性细胞因子、生长因子、物理化学因子、致凋亡因子、辐射、缺血/再灌注和氧化应激均可激活NF-κB通路。由此可见,NF-κB的活化是引起炎症的关键步骤[21]。NF-κB家族成员有P50(NFκB1)、P65(RelA)、P52(NFκB2)、RelB和c-Rel。其发挥生物学作用的前提是各个亚型形成二聚体,最常见的就是NF-κB p65[22]。许多包含中药成分的抗炎药物,都以NF-κB p65炎症信号通路的激活为靶点[23]。因此,抑制NF-κB是抑制发热的有效途径。
本研究结果表明,模型组大鼠皮下注射酵母菌悬液后体温持续升高达6 h,而黄芩苷高剂量组大鼠体温明显低于模型组,且血清TNF-α、IL-1β、IL-6、PGE2和cAMP含量明显降低;提示黄芩苷对致热炎症因子有显著抑制作用。同时,模型组大鼠下丘脑NF-κB p65蛋白表达量增多,而黄芩苷高剂量组大鼠NF-κB p65蛋白表达下降,提示黄芩苷对脑组织NF-κB p65蛋白有抑制作用。表明黄芩苷通过抑制炎症因子的分泌和释放以及降低脑组织NF-κB p65蛋白的活性从而影响NF-κB信号通路来发挥解热作用。

