马铃薯HXK 基因家族鉴定及表达特征分析
王 言,何 雷,刘涛涛,王 玺,韩 佳,杨宏羽
(甘肃农业大学 园艺学院,兰州 730070)
己糖(hexose)是含有6个碳原子的单糖,又称为六碳糖。己糖是呼吸代谢的主要底物,能够作为信号分子调节多种基因的表达[1],植物体内最常见的己糖是葡萄糖,其次是果糖和半乳糖。植物己糖激酶是双功能酶,具有磷酸化己糖和介导糖信号的关键性作用[2]。己糖激酶具有催化己糖磷酸化和感知糖信号的功能[3-5]。在糖代谢过程中,HXK 在糖酵解第一阶段[6]发挥关键作用,在辅助因子镁离子(Mg2+)或锰离子(Mn2+)的协同下,催化ATP并将磷酸基团转移至各种六碳糖上去,从而生成磷酸化六碳糖并继续下一步反应,因此,HXK 能够调控糖酵解的发生;在信号传导过程中,HXK 作为机体内重要的糖传感蛋白[7],对糖信号的感知和传递有关键作用。HXK1介导的控制幼苗发育的葡萄糖信号转导涉及ABA 的增加,并诱导ABA 合成和ABA 信号转导基因的表达[8]。已有研究表明,HXK 参与植物保卫细胞的糖感知,介导气孔关闭,从而协调光合作用与蒸腾作用[9],这与Dai等[10]研究发现HXK具有调节光合作用以及调控植株生长发育和衰老的结论一致。此外,HXK 在淀粉的合成过程中起着关键的调节作用[11],磷酸化的己糖能在AGPase的催化下与ATP 进一步反应生成ADPG[12],而ADPG 则作为前体物质参与淀粉的合成[13],可能对水稻、玉米、马铃薯等淀粉类农作物的产量形成起关键作用。由此可见,己糖激酶与植物体内糖代谢和贮存密切相关,影响逆境胁迫过程中植物的生理和生长。
目前,已从拟南芥(Arabidopsisthaliana)[14]、水稻(Oryzasativa)[15]、玉米(Zeamays)[16-17]、茶树(Camelliasinensis)[18]、苹果(MalusdomesticaBorkh)[19]、木薯(Manihotesculenta)[20]、番茄(Solanumlycopersicum)[21]、葡萄(Vitisvinifera)[22]、油菜(Brassicanapus)[23]等多种植物中鉴定和克隆出了HXK基因,这些研究均表明HXK基因能够被不同胁迫诱导表达,从而影响和调控植株在逆境下的糖代谢水平。研究者从拟南芥中分离鉴定出了6个HXK基因[14],其中AtHXK1~AtHXK3具有己糖催化活性,能够使己糖磷酸化。此外,有研究发现AtHXK1的拟南芥幼苗对外源葡萄糖表现出高度的敏感性[24]。水稻中共鉴定出10个HXK基因,这些基因分别位于水稻的1号、5号和7号染色体上,大多具有9个内含子和8个外显子,其中Os-HXK2、OsHXK5和OsHXK6能够被外源糖诱导表达,OsHXK3在花中特异性表达[15]。Zhang等[16]从玉米中鉴定出了9 个HXK基因,研究表明,低温、NaCl和PEG 诱导能上调玉米幼苗中Zm-HXK5和ZmHXK6的相对表达含量。木薯中的7个HXK基因中,仅MeHXK1、MeHXK2和Me-HXK5具有磷酸化己糖的功能,研究表明,木薯HXK在其块根形成初期以及淀粉快速积累时表达,对木薯块根组织中淀粉的合成起正调控作用[20]。
马铃薯(Solanumtuberosum)是中国第四大主粮作物[25],不仅口感良好、营养价值高、耐储运,还具有巨大的增产潜能,同时也是中国重要的农业经济作物。干旱、盐碱、冷害以及涝渍等逆境因子不仅影响马铃薯的品质,还严重制约着马铃薯的生长发育和产量。然而截至目前,有关HXK基因参与马铃薯生长发育以及逆境适应性方面的研究鲜有报道。因此本研究拟马铃薯HXK 基因家族成员在非生物处理胁迫下的表达特性进行研究,明确该成员在马铃薯逆境条件下的响应功能,为深入研究HXK 家族基因的功能奠定了基础。
1 材料和方法
1.1 试验材料及处理
试验材料选用“大西洋”马铃薯组培苗,采用培养基(4.43 g/L MS+1.0 mg/L NAA(萘乙酸)+0.2 mg/L 6-BA(6-苄基氨基嘌呤)+30 g/L蔗糖+6.5 g/L 琼脂)作为基本培养基。在23 ℃、16 h光照/16 ℃、8 h黑暗条件的人工气候箱中进行培养。培养35 d,选择长势良好相似且无污染的马铃薯组培苗,将其分别置于高温(40 ℃)、低温(4 ℃)、0.2 mol/L NaCl、50 μmol/L ABA、100 μmol/L ABA以及10% PEG(聚乙二醇)进行2 h、6 h、12 h和24 h处理,以正常生长植株作为对照组,每个处理设置3次生物学重复。取经过处理的马铃薯组培苗叶片,剪碎并用锡箔纸包好,置于液氮速冻,-80 ℃保存备用。
1.2 马铃薯RNA提取
RNA 提取采用植物提取试剂盒RNAplant-RTR2303(中科瑞泰生物技术有限公司,北京),并按操作说明书对马铃薯RNA 进行提取。通过Nanodrop和Agilent 2100(安捷伦有限责任公司,美国)检测所提取马铃薯RNA 的纯度(OD260/280)、浓度、完整性,并通过琼脂糖凝胶电泳进行质量检测,确认合格后在-80 ℃下储存。
1.3 马铃薯HXK 家族基因成员鉴定
从拟南芥数据库(http://www.arabidopsis.org/)中下载已登录注册的拟南芥HXK 氨基酸序列,将其作为靶序列在马铃薯数据库(http://solgenomics.net/)中进行BLASTP同源比对,可获得马铃薯HXK基因的候选序列。利用DNAMAN6.0.40 对HXK候选基因进行筛选,利用SMART(http://smart.embl.de/)和Pfam(http://pfam.sanger.ac.uk/)进行保守域预测,筛选出含有HXK特定结构域(PF03727)的基因,最终获得6个StHXK家族基因,根据染色体位置命名为StHXK1~StHXK6。从马铃薯数据库中分别下载该家族成员所对应的编码基因序列(coding sequence,CDS)和基因组序列(genome sequence),作为该家族基因生物信息学分析的基础。
1.4 马铃薯HXK 家族基因相关生物信息学分析
使用MEGA11.0 软件对马铃薯、拟南芥、水稻、玉米、葡萄和木薯的HXK 蛋白序列构建系统进化分析,采用邻接法(neighbor-joining NJ),执行参数Bootstra设为1 000次重复,其余参数设置为默认值。使用ExPASy 数据库(https://web.expasy.org/protparam/)中ProtParam 工具对马铃薯HXK编码蛋白的理论等电点、氨基酸大小、不稳定系数、亲水性等基本信息进行分析[26];使用GSDS 2.0(http://gsds.cbi.pku.edu.cn/)对该家族成员进行基因结构分析;利用WoLF PSORT(http://www.genscript.com/wolf-psort.html)进行亚细胞定位分析预测;使用PRABI(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html)和WISS-MODEL(https://swissmodel.expasy.org/interactive)进行蛋白二级结构和三级结构分析;使用DNAMAN 6.0对马铃薯HXK 氨基酸进行多序列比对分析;使用plantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件分析。
利用在线网站MEME(http://meme-suite.org/tools/meme)对StHXK基因保守基序进行分析,预测基序数设为5 个;利用TBtools v1.09876软件进行染色体位置和共线性分析。
1.5 马铃薯HXK 家族基因qRT-PCR分析
由生工生物工程(上海)股份有限公司进行qRT-PCR 引物(表1)设计与合成。马铃薯cDNA序列由试验提取的RNA 反转录得到,试剂盒选用Primer ScriptTMRT regent Kit with gDNA Eeaser(TaKaRa)。qRT-PCR 试剂盒选用SYBR Primer Ex TaqTMⅡ(TaKaRa),设置3 组重复,以马铃 薯Actin基因作为内参基因[27],反应体系为20 μL:上、下游引物各1 μL,SYBR 10 μL,2 μL cDNA,6 μL ddH2O,95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次。基因的相对表达量采用2-ΔΔCT 法[28]计算。

表1 马铃薯HXK 家族基因的qPCR 分析所用引物Table 1 Primers used for qPCR analysis of potato HXK family genes
1.6 数据统计与分析
使用Excel 2016 进行数据统计与整理;使用SPSS 25进行显著性分析;使用Origin 9.0进行图片绘制。
2 结果与分析
2.1 马铃薯HXK 家族基因鉴定及其编码蛋白的理化性质分析
通过相似性搜索以及保守结构域鉴定,在马铃薯(S.tuberosum)中鉴定出6个HXK基因。根据马铃薯的拉丁名缩写,将其命名为StHXK1~StHXK6。对其编码蛋白理化性质及亚细胞定位进行分析(表2)表明,该家族成员蛋白的氨基酸数目为496(StHXK4)~533 aa(StHXK3);分子量集中在53 736.38~58 184.71 D 之间;StHXK 全长介于4 084(StHXK3)~6 678 bp(StHXK6)之间;理论等电点(pI)介于5.36~6.11之间,其中StHXK2等电点最高,为6.11,StHXK6最低,为5.36,均小于7,偏酸性;不稳定系数集中在28.29~53.5 之间,其中StHXK5 的不稳定系数最高,StHXK6 的不稳定系数最低;该家族成员均为亲水性蛋白。亚细胞定位预测表明,StHXK基因主要在叶绿体中表达,除此,StHXK1、StHXK6在细胞质基质、StHXK3在线粒体中也存在明显定位信号。
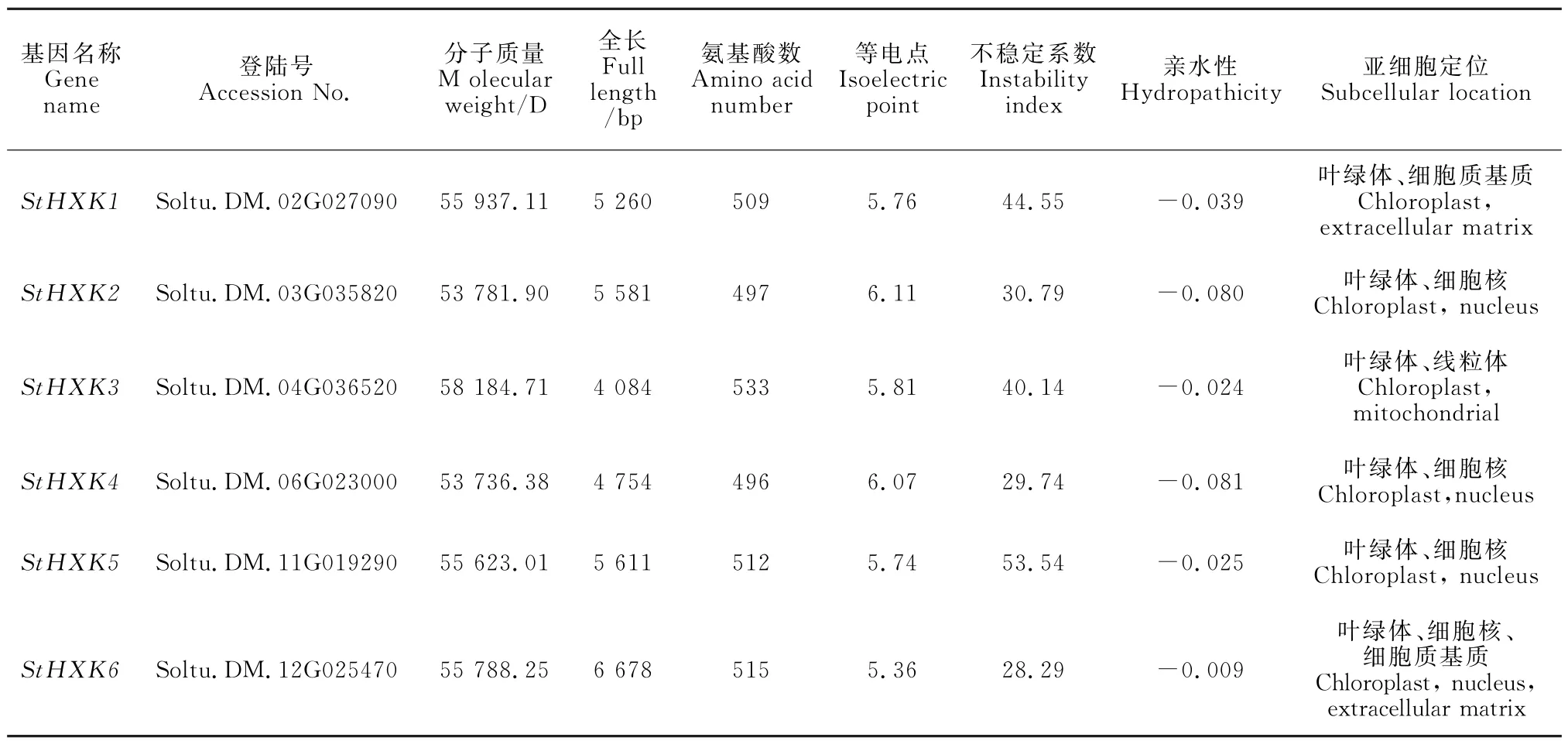
表2 马铃薯HXK 家族基因信息及其编码蛋白理化性质分析Table 2 Analysis of gene information and their coding proteins physicochemical properties of potato HXK family genes
2.2 马铃薯HXK 家族基因编码蛋白的结构、保守基序分析
基因结构分析(图1,A)表明,StHXK长度均位于7 kb以内,且基因结构相似。除了StHXK1无上游结构,其他5个StHXK均具有外显子、内含子及5′和3′非编码区,其中StHXK3含有7个内含子、8个外显子,StHXK1和StHXK6含有9个内含子、10个外显子,其余3个StHXK含有8个内含子、9个外显子。

图1 HXK 家族基因的基因结构及蛋白保守基序分析A.Gene structure diagram;B.Conserved motif diagram;C.Conserved motif Logo diagram.Fig.1 Gene structure and protein conserved motif analysis of HXK family genes
利用MEME 在线软件分析StHXK 家族成员的蛋白保守基序,选取15个motif(图1,B 和图1,C),结果表明,StHXK1缺失motif 3和motif 10,其余StHXK 均含有10个motif,且在结构上的排列顺序相似,推测这些基因功能高度相似。
2.3 马铃薯HXK 家族基因编码蛋白二级结构及三级结构分析预测
为进一步研究HXK 家族基因的结构特点,通过EXPASy在线软件对马铃薯HXK 蛋白进行二级及三级结构分析。结果(图2)显示,6个StHXK均由α-螺旋、β-转角、不规则卷曲和延伸链构成,其中以α-螺旋和不规则卷曲占比最大;α-螺旋所占比率为41.84%(StHXK3)~48.49%(StHXK2);不规则卷曲所占比率为33.2%~36.96%,StHXK3所占比例最大;β-转角所占比率最小,为5.23%~6.75%。

图2 马铃薯HXK 家族基因编码蛋白二级结构分析The horizontal coordinates in the figure represent the proportion of each secondary structure type.Fig.2 Secondary structure analysis of the HXK family genes coding proteins in potato
马铃薯HXK 家族基因编码蛋白三级结构预测(图3)表明,E亚族中StHXK 家族基因蛋白的三级结构差异较大;C 亚族StHXK 家族基因蛋白的三级结构相似度极高。

图3 马铃薯HXK 家族基因编码蛋白三级结构分析Fig.3 Analysis of the tertiary structure of HXK family genes coding protein in potato
2.4 马铃薯HXK 家族蛋白氨基酸序列比对与进化分析
通过对6个StHXK基因编码的氨基酸序列进行多序列同源比对(图4)发现,StHXK1~StHXK6均含有3个保守的结构域:2 个磷酸化位点(phosphorylation site)和1 个底物结合位点(substrate site);其中,磷酸化位点中均含有2个保守的甘氨酸(Gly)残基,底物结合位点中含有3个疏水通道氨基酸。对比发现,StHXK1结构域保守性略低于其他5个HXK基因编码蛋白,共含有11个突变的氨基酸。

图4 马铃薯HXK 家族基因编码蛋白多序列比对Phosphorylation site is phosphorylation site;substrate site is substrate binding site;C is hydrophobic channel amino acid;+is conservative amino acid residue;* is other conserved residues.Fig.4 Multiple sequence alignment of proteins encoded by potato HXK family genes
为了探究StHXK 家族基因的进化关系,利用MEGA7.0软件,根据已注册的拟南芥(6个)、水稻(10个)、玉米(9个)、葡萄(4个)和木薯(7个)中的HXK基因和分析获得的6个StHXK基因,共42个基因构建系统进化树(图5)。通过分析将其分为5个亚族(A_E),其中,C 亚族有3 个StHXK成员,分别是StHXK2、StHXK4和StHXK6;E 亚族中 有2 个StHXK成员,分别是StHXK3和StHXK5;D 亚族中 仅有1 个StHXK成员,为StHXK1。除此,马铃薯HXK与木薯之间亲缘关系最近,其次,马铃薯HXK与拟南芥和葡萄之间的亲缘关系较其他两物种之间的亲缘关系近。

图5 HXK 家族基因的进化树分析Fig.5 Phylogenetic tree analysis of HXK family genes
2.5 马铃薯HXK家族基因的基因定位共线性分析
为进一步了解HXK 家族基因的扩展及功能,对马铃薯HXK基因进行染色体定位和共线性分析。通过染色体定位(图6)发现,马铃薯HXK基因分布于Chr02、Chr03、Chr04、Chr06、Chr11 及Chr12染色体上,分布均匀,每条染色体均只有1个成员且主要位于染色体的后半部分。

图6 马铃薯HXK 家族染色体定位The scale on the left indicates the chromosome length (Mb).Different chromosome colors indicate different gene densities,with red indicating the highest density and blue the lowest.Fig.6 Chromosomal localization of potato HXK family genes
共线性基因是指能够通过复制存在于另一基因组,并且具有相同连续顺序的旁系同源基因,系同源基因是物种形成后由于基因复制而产生的基因[29]。分析马铃薯HXK 家族基因的共线关系(图7,A)发现,马铃薯内部的基因复制现象不明显,存在2对共线性基因,分别是StHXK2与StHXK4、StHXK4与StHXK6。为进一步研究HXK基因在不同物种间的进化关系,对马铃薯与拟南芥、水稻的关联性进行分析(图7,B),发现马铃薯与双子叶植物拟南芥及单子叶植物水稻的关联性存在明显的不同。分析表明,马铃薯与拟南芥之间的关联性较高,存在5对共线性基因,马铃薯与水稻之间的关联性相对较低,存在2对基因对。
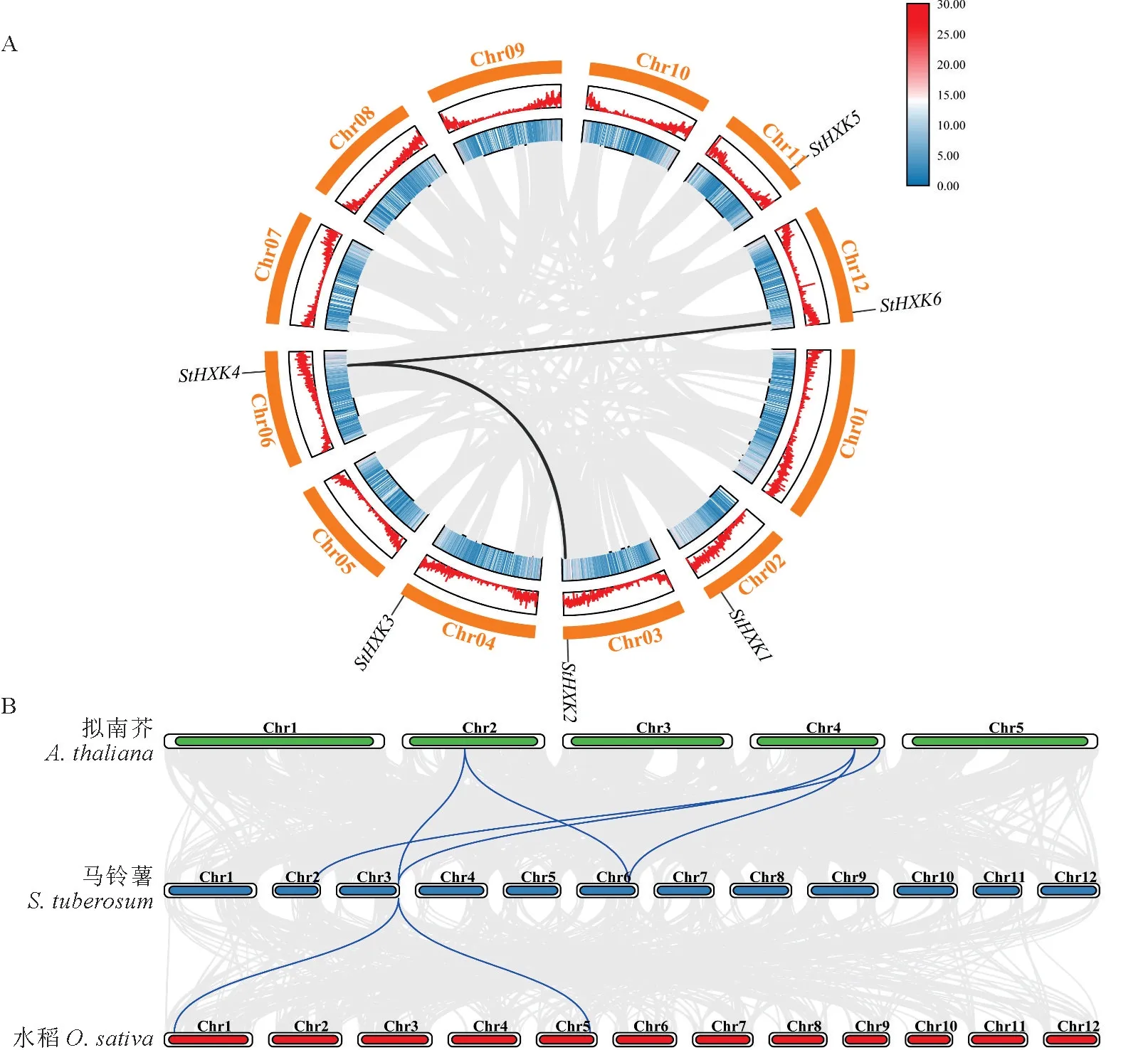
图7 马铃薯HXK 家族成员之间的共线性(A)和拟南芥、水稻与马铃薯之间的 HXK 基因组共线性(B)Fig.7 Collinearity between HXK family members in potato (A) and HXK genomic collinearity between Arabidopsis,rice and potato (B)
2.6 马铃薯HXK 家族基因顺式作用元件分析
为进一步明确马铃薯HXK 家族基因的潜在功能,选取起始密码子前2 000 bp序列作为HXK基因上游2 kb区域,利用plant CARE 在线工具对其顺式作用元件进行分析。结果(图8)显示,StHXK启动子区域包含有光响应元件、激素响应元件、胁迫响应元件及生长发育相关元件。StHXK中均包含有脱落酸响应元件(ABRE);激素响应还包含有类黄酮响应元件(MBSI)、生长素响应元件(TCR-element)以及茉莉酸甲酯响应元件(TGACG-motif,MeJA),StHXK中均含有茉莉酸甲酯响应元件,其中StHXK5最多;除StHXK5和StHXK6外,其余4 个StHXK启动子均含有干旱响应元件(MBS);StHXK启动子区域还含有与低温相关的元件LTR。StHXK3和StHXK6含有较多的厌氧诱导响应元件(ARE)。另外,StHXK1、StHXK3及StHXK5还包含分生组织表达响应(CAT-box)。综上,StHXK除了能够正常进行转录活动,还参与了植物的光响应、激素响应、逆境胁迫以及生长发育活动。
2.7 马铃薯HXK家族基因表达的qRT-PCR分析
对马铃薯HXK基因分别进行高温、低温、ABA、200 mmol/L NaCl和10% PEG 进行诱导胁迫处理2 h、6 h、12 h及24 h后,对不同HXK基因相对表达量进行分析(图9),发现StHXK的表达水平在不同处理下表现出明显的差异。qRT-PCR结果显示,高温胁迫处理后,该家族成员的相对表达量均呈不同程度的上调表达,其中StHXK6在处理6 h 时相对表达量较高,达到对照的7.74 倍,StHXK1在处理24 h时,相对表达量达到最大值,为对照的40.99倍。
低温胁迫处理后,StHXK均呈不同程度的上调表达,StHXK1在处理24 h时表达量达到最大值,达到对照的42.73倍。在200 mmol/L NaCl处理下,StHXK1、StHXK4基因相对表达量随着时间推移呈现出先增高后降低的趋势,StHXK1、StHXK4在处理2 h时呈上调表达。其余StHXK基因在处理24 h内均呈不同程度的下调表达,推测StHXK在盐胁迫中随着时间变化既存在正向调控,也存在负向调控。
StHXK在100 μmol/L ABA 和50 μmol/L ABA 胁迫下均上调显著,呈现正向调控。在100 μmol/L ABA 胁迫下,StHXK在处理6 h和24 h时响应最为强烈,其中StHXK1在处理24 h时达到最大值,为对照的102.01 倍。在50 μmol/L ABA 胁迫下,多数基因在处理24 h时响应最为强烈,其 中StHXK1、StHXK2、StHXK3、StHXK4的相对表达量分别是对照的286.40,152.02,126.60,112.37倍。qRT-PCR 结果显示,在10% PEG 处理后,StHXK呈不同程度的上调表达,StHXK1在处理24 h 时相对表达量达到最大值,达到对照的20.86倍。故推测StHXK在干旱胁迫下主要进行正向调控,且StHXK1对10% PEG 的胁迫较敏感。综上,高温、低温、不同浓度的ABA、NaCl、PEG处理均能诱导StHXK的表达,但表达程度存在差异,在干旱胁迫下主要进行正向胁迫;在ABA 处理下存在正向调控;而在盐胁迫下随着时间变化既存在正向调控,也存在负向调控。
3 讨论
己糖激酶主要在生物体糖酵解第一阶段发挥作用[30-32],同时能够介导植物体内多种糖信号的转导[7]。本研究采用生物信息学技术,鉴定获得共6个马铃薯HXK基因,分别命名为StHXK1~StHXK6。与拟南芥(6个)、水稻(10个)、木薯(7个)、葡萄(4个)、玉米(9个)相比,马铃薯中HXK基因数量变化较小。蛋白理化性质分析发现,马铃薯家族成员均为酸性蛋白且均为亲水性蛋白。马铃薯HXK 家族成员分布于3个亚家族,分别位于马铃薯的6条染色体上,其中StHXK2和StHXK4分别编码497个和496个氨基酸,这与张凯等[33]发现肥城桃、雍彬等[34]对甘薯以及杨娇娇等[35]对枇杷HXK相关基因的鉴定结果类似。进化关系表明,马铃薯StHXK1与其他5个HXK基因同源关系较远,与拟南芥AtHKL3亲缘关系最近,因此,推测StHXK1与AtHKL3[15]一样不具有磷酸化葡萄糖的功能。亚细胞定位预测表明,马铃薯HXK主要在叶绿体中表达,推测其与光合作用关系密切,或直接影响马铃薯源器官对光能的同化效率,这与已报道的番茄LeHXK4[36]、拟南芥AtHXK3[15]及茶树CsHXK2[37]能够定位并作用于叶绿体的研究结果相似。与马铃薯HXK不同的是,StHXK3能够在线粒体中表达,此外,已有研究报道,橡胶HbHXK4[38]、毛竹PeHXK3[37]均能够定位于线粒体并对呼吸作用发挥相应的酶促作用,因此,推测StHXK3主要在马铃薯呼吸代谢过程中发挥作用。对多序列比对显示,StHXKs大多具有2个磷酸化结合域和1个底物(葡萄糖和果糖)结合域,其中StHXK1的结构域保守性较差,这与已报道的茶树CsHXK1[31]、桂花OfHXK1~OfHXK4[39]以及梨PbHXK1[40]均具有完整的磷酸化位点、糖识别及结合位点研究结果类似。共线性基因是指能够通过复制存在于另一基因组,并且具有相同连续顺序的旁系同源基因[29],本研究发现马铃薯HXK 内的基因复制现象不明显,研究HXK基因在马铃薯与其他物种之间的关联性分析发现,发现马铃薯与双子叶植物拟南芥及单子叶植物水稻的关联性存在一定差异,马铃薯与拟南芥之间的关联性和与水稻之间相比较高。通过进化结构、基因结构及保守基序分析发现,存在于同一亚族的StHXK基因结构和motif位置在结构上的排列顺序相似,其保守性较高,推测其具有相似功能。顺式作用元件分析表明,每个成员所含有的应答元件和数量各不相同,其中只有StHXK2基因含有低温响应元件。5个StHXK具盐胁迫响应元件TC-rich repeats,这与刘倩倩[17]在玉米Zm-HXK中的研究相似,GT 元件是与光反应有关的顺式作用元件,在植物生长发育过程中发挥一定作用[41],所有的StHXK均含有大量的光响应元件,说明HXK 在马铃薯光信号调控中起到重要作用。激素响应元件中,MBRE、TGACG-Motif和MBS、ABA 响应元件相对较多,其中StHXK2中ABA响应元件较多,推测马铃薯HXK 能够对外源ABA诱导做出响应。综上,StHXK除了能够正常进行转录活动,还参与了植物的光响应、激素响应、逆境胁迫以及生长发育活动,该结果与周玥[42]在大豆中的研究相似。
实时荧光定量结果表明,不同马铃薯HXK 在不同胁迫下的表达具有明显的差异。其中,StHXK1在高温、低温、干旱和ABA 诱导下的相对表达量均远高于平均水平,表现出明显的差异性,这与茶树CsHXK1[31]在高温、低温和干旱逆境胁迫下的表达情况极为相似。低温诱导能提高StHXK1、StHXK2以及StHXK4~StHXK6的酶活性,这与苹果MdHXK1[19]、茶树CsHXK3和CsHXK4[16]的研究结果相似,此外,董文科等[43]研究发现,低温胁迫能提高青海扁茎早熟禾HXK 的酶活性。高盐(NaCl)胁迫对马铃薯HXK 的表达有普遍抑制作用,主要进行负向调控,NaCl对马铃薯HXK 的胁迫机理还有待进一步研究。马铃薯HXK 的表达明显受ABA 的诱导,并且在较低浓度的ABA 诱导下表达更显著。这与Li等[18]发现在外源ABA 短期处理下,CsHXK3在叶片和根系中被显著刺激的观点类似。
综上所述,StHXK1~StHXK6均能在叶绿体中大量表达,与光合作用密切相关;StHXK2~StHXK6均含有高度保守的磷酸基团结合域和底物结合域,具有己糖磷酸化功能;StHXK1不能使己糖磷酸化,但具有较强的信号感知作用,对外源环境变化高度敏感;StHXK3能在线粒体中有效表达,推测是马铃薯呼吸代谢中的主要功能酶;高盐胁迫能普遍抑制马铃薯HXK 的表达,低温诱导能普遍提高马铃薯HXK 的酶活性,高温和PEG 对马铃薯HXK 的诱导效果不明显;ABA 对StHXK的诱导最显著,且对较低浓度的ABA 响应更为强烈。

