梭梭qRT-PCR 内参基因的筛选及稳定性分析
张玲玲 ,王淑冉 ,张 胜,2*
(1 西北农林科技大学 林学院,陕西杨凌 712100;2 新疆大学 生命科学与技术学院,乌鲁木齐 830046)
实时定量PCR(real-time quantitative polymerase chain reaction,qRT-PCR)是一种利用荧光信号积累,通过内参法或外参法分析样品中mRNA 转录水平的分子技术。qRT-PCR 具有特异性高、重复性好、灵敏度高等优点,弥补了传统PCR 技术的一些局限性,在生命科学研究中被广泛应用[1-3]。但qRT-PCR 结果受样本所处环境或不同生长发育阶段以及RNA 质量浓度和酶诱导反应效率影响,使qRT-PCR 的准确性出现偏差,导致结果不可靠[4]。在试验中加入适当的内参基因为对照,使基因的表达水平标准化,可最大程度避免误差[5-6]。
理想状态下,内参基因不受各种条件的限制,表达水平较为稳定[7]。在植物学研究中,常采用在组织中较稳定的基因作为内参使用,如甘油醛-3-磷酸脱氢酶(GAPDH)[8-9]、18S 核糖体RNA(18S rRNA)[10]、泛素结合酶(UBC)[11]、β-微管蛋白(TUB)[9,11]、肌动蛋白(ACT)[10]、α-微管蛋白(TUA)[9]、蛋白磷酸酶2调节亚基A(PP2A)[12]、延伸因子-1α(EF-1α)[11,13]、多泛素(UBQ)[14]和TIP41样蛋白基因(TIP41)[12]。然而,某种内参基因并不完全适用于多种环境条件或发育阶段。同一内参基因在不同物种和不同处理中的表达量也不尽相同。如在桃的研究中,翻译优化因子2(TEF2)、泛素10(UBQ10)和RNA 聚合酶Ⅱ(RPⅡ)是最适合的内参基因[9];而在番茄的研究中,GAPDH或PGK和EF1分别是氮胁迫和昼夜节律下最适合的内参基因[15]。因此,针对不同物种,不同的生长阶段或环境条件下选择相对稳定的内参基因是准确分析目标基因表达谱的关键[11]。
梭梭(Haloxylonammodendron)生长在荒漠环境,其叶片组织退化成鳞片状,依靠同化枝(assimilating shoots)进行光合作用,对干旱、盐碱等胁迫有较强的适应性[16-18]。作为重要的乡土防风固沙植物,梭梭在中国宁夏、甘肃、青海、新疆等地荒漠化防治和植被恢复中发挥着重要作用,它也是研究沙漠地区植物抗性和高光效机理的重要材料。目前梭梭分子生物学研究基础薄弱,筛选和验证梭梭稳定的qRT-PCR 内参基因对梭梭后续相关研究具有重要的基础性作用。研究一共筛选14个内参基因进行稳定性评价,包括2种类型的微管蛋白(TUA和TUB),参与糖酵解反应关键酶GAPDH,主要参与蛋白合成的EF-1α,广泛参与植物生长发育相关过程的泛素结合酶E2(UBC)以及核糖体蛋白L32(RPL32)、清蛋白(ALB)、50S 核糖体蛋白(50S-1721、50S-1063)、RNA 聚合酶Ⅱ(RPⅡ)、组蛋白(H3)、蛋白磷酸酶2A(PP2A)、铁超氧化物歧化酶(SOD)、热激蛋白70(HSC70)等常见的看家基因。利 用geNorm、BestKeeper、NormFinder 和Ref-Finder软件对梭梭内参基因的稳定性进行综合评价,分析这些基因在ABA、NaCl、热胁迫、干旱和昼夜节律条件下的稳定表达水平。此外,为了评估选用不同内参基因对研究结果的影响,在NaCl胁迫处理下使用2种不同内参检测了梭梭C4光合循环途径关键酶——磷酸烯醇丙酮酸羧化酶(PEPC)基因的表达水平。研究旨在为梭梭qRT-PCR 提供合适的内参基因,并为进一步研究梭梭等荒漠植物的非生物抗性机制提供参考。
1 材料和方法
1.1 植物材料及处理
从新疆古尔班通古特沙漠南缘极端盐碱半荒漠区采集梭梭成熟种子,人工气候箱25 ℃催芽后,栽种于直径9 cm,高12 cm 花盆中(基质:河沙土),幼苗转移至自然光温室[白天温度(32±3) ℃,相对湿度55%]生长8周后进行处理取样。共设5个试验组:热胁迫处理组在人工气候箱(泰斯特,中国)38℃培养2 h,取0 h、1 h、2 h的成熟同化枝;干旱处理组取自然光温室自然干旱0 d[(70±5)%相对含水量]、1 d、3 d 的成熟同化枝;盐处理组使用200 mmol/L NaCl溶液浇灌至饱和含水,取0 h、2 h、8 h的成熟同化枝;ABA 处理组,使用浓度为100 μmol/L ABA,喷施于叶片表面,直至叶片滴液,处理后采集0 h、2 h、6 h的成熟同化枝;昼夜节律处理组采集12:00、下午18:00以及凌晨24:00的成熟同化枝。以上每个处理设置3个生物学重复,每个重复至少包含3株独立处理幼苗。收集所有材料,液氮速冻后,-80 ℃保存备用。
1.2 RNA提取和cDNA合成
取梭梭同化枝样本0.5 g,加液氮充分研磨。使用Omega total RNA Extraction Kit (Omega Bio-Tek,China)提取样品总RNA,使用超微量分光光度计(Gene,China)测定RNA 样品的质量和浓度,260 nm/280 nm 的吸光度范围为1.8~2.2,质量较高,1%琼脂糖凝胶电泳检测RNA 的完整性。使用EasyScript®first-strand cDNA Synthesis Super-Mix(TransGen Biotech,China),将提取的RNA 反向转录为第一链cDNA,将cDNA 稀释10倍,保存于-80 ℃备用。
1.3 qRT-PCR引物设计
根据转录组数据筛选内参基因。所有候选内参基因均采用Primer 5.0软件[11]进行引物设计。引物由上海生工生物技术公司合成,引物稀释后4 ℃保存备用。
1.4 扩增效率检测及内参基因选择
共选取14个基因(GAPDH、EF-1α、UBC、RPL32、ALB、50S-1721、50S-1063、RPⅡ、H3、PP2A、SOD、HSC70、TUA、TUB)作为候选内参基因进行表达稳定性分析。qRT-PCR 扩增时,将扩增产物用原液稀释10倍、102倍、103倍,生成标准曲线,计算引物的扩增效率(E,%)及斜率(S)。
引物扩增效率和R2由原始CT值计算,公式为:E=(10-1/S-1)×100[19],其中斜率用Excel线性回归方程计算[9]。候选内参基因引物序列见表1。
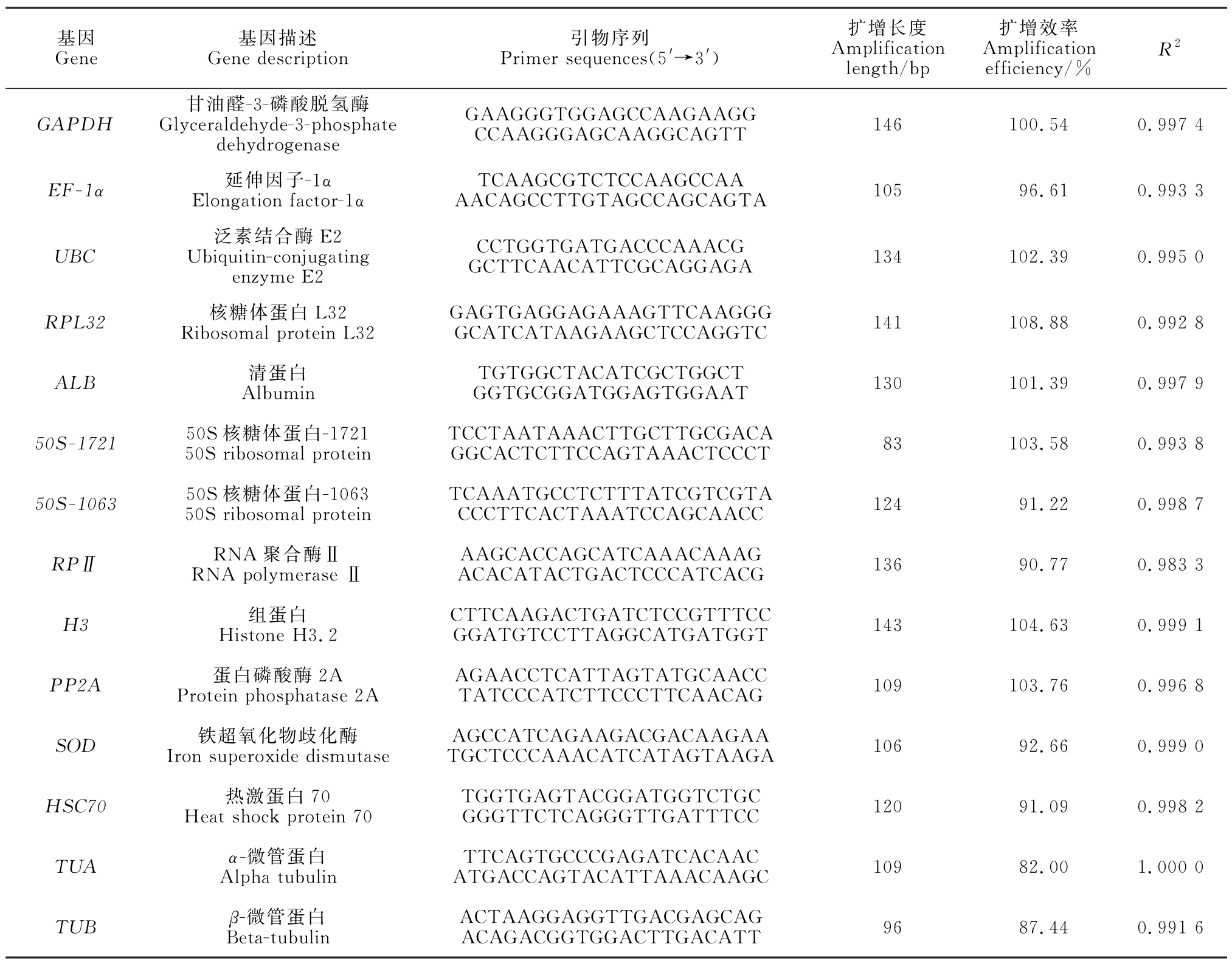
表1 梭梭内参基因、引物序列及PCR 扩增特性分析Table 1 Analysis of H.ammodendron internal reference gene,primer sequence and PCR amplification characteristics
1.5 qRT-PCR分析
qRT-PCR 按照2×SYBR Green qPCR Master mix试剂(Aidlab,China)使用要求进行。使用Roche公司的LightCycler®96荧光定量仪进行反应,反应体系为25 μL,包括2×SYBR qPCR Master Mix 12.5 μL、ddH2O 10.5 μL、上下游引物各0.5 μL、cDNA 模板1 μL,每个样品进行3次生物重复。扩增程序:在94 ℃下预变性30 s、94 ℃变性20 s、60℃退火,并在72 ℃下延长30 s,40个循环周期。
1.6 候选基因稳定性评价
采用geNorm、NormFinder和BestKeeper软件对qRT-PCR 得到的所有CT值进行稳定性评价[20-22]。结合上述分析结果,利用RefFinder软件[23],根据相对表达量(Q)计算公式Q=2-ΔCT(样本ΔCT=CT,max-CT,min)计算不同处理下候选内参基因的综合排序。输入数据后,geNorm 软件通过分析Q值计算表达稳定性。M值<1.5是稳定范围值,随着M值减小,稳定性升高;相反,随着M值增加,基因稳定性降低。NormFinder 程序分析的原理与geNorm 类似,计算采用Q值,随着该值降低,内参基因的相对表达也变得更加稳定。在NormFinder中,通过结合样本集中的组内和组间变异计算候选内参基因的表达稳定性。为了得到均值和标准差,直接使用原始数据CT值进行最佳候选基因分析,最后通过RefFinder网站对上述数据进行比较分析,获得最合适、最稳定的内参基因。
1.7 选择不同内参对试验结果的影响
为了分析所选内参基因对试验结果的影响,选择梭梭C4光合碳代谢途径关键基因PEPC(ON640822.1)作为目标基因,验证内参基因的适用性,选择2 h、4 h、8 h、24 h、2 d和4 d的盐胁迫样品进行qRT-PCR 实验,采用2-ΔΔCT 法[24]计算相对表达量。
2 结果与分析
2.1 引物特异性和扩增效率
用OD260/280值和1%凝胶电泳对RNA 进行浓度测定及质量分析。凝胶结果显示出2条完整清晰的RNA 条带(28S/18S),表明RNA 提取成功,OD260/280值在2.0~2.2之间,满足后续试验要求。筛选出14 个基因(GAPDH、EF-1α、UBC、RPL32、ALB、50S-1721、50S-1063、RPⅡ、H3、PP2A、SOD、HSC70、TUA和TUB)作为候选基因进行稳定性表达分析。
表1展示了上述基因及其qRT-PCR 引物序列和扩增效率。PCR 产物经琼脂糖凝胶(1%)电泳分析,并利用溶解曲线观察、验证引物的特异性。所有合格的引物经凝胶电泳均呈现出预期大小的单条带(图1,A),通过溶解曲线分析,每个基因产物均呈现出单峰(图1,B)。标准曲线的扩增效率范围为80%~110%,相关系数(R2)在0.98~1之间,均在合理范围内(表1)。
2.2 候选基因在不同胁迫处理下的相对表达量
计算每个候选内参基因的CT值,CT值与表达丰度成反比。候选内参基因在不同样本中的表达水平不同。结果(图2)显示,所有样本的CT值都在15~32之间,多数内参基因的CT值为25左右。采集凌晨24:00时的同化枝样HSC70表达最高,CT值为15.99,干旱胁迫下第3 天CT值最高,为31.7,相应基因丰度水平最低。14个候选基因的平均CT值在20~28之间,而RPⅡ的CT值最高,为27.44,表明与其他内参基因相比,其表达水平最低。HSC70的平均CT值最低,仅为20.19,说明与其他内参基因相比,HSC70的表达量最高。在不同的胁迫处理下,不同内参基因的表达没有明显的规律性,需使用稳定性分析软件进一步评价分析。
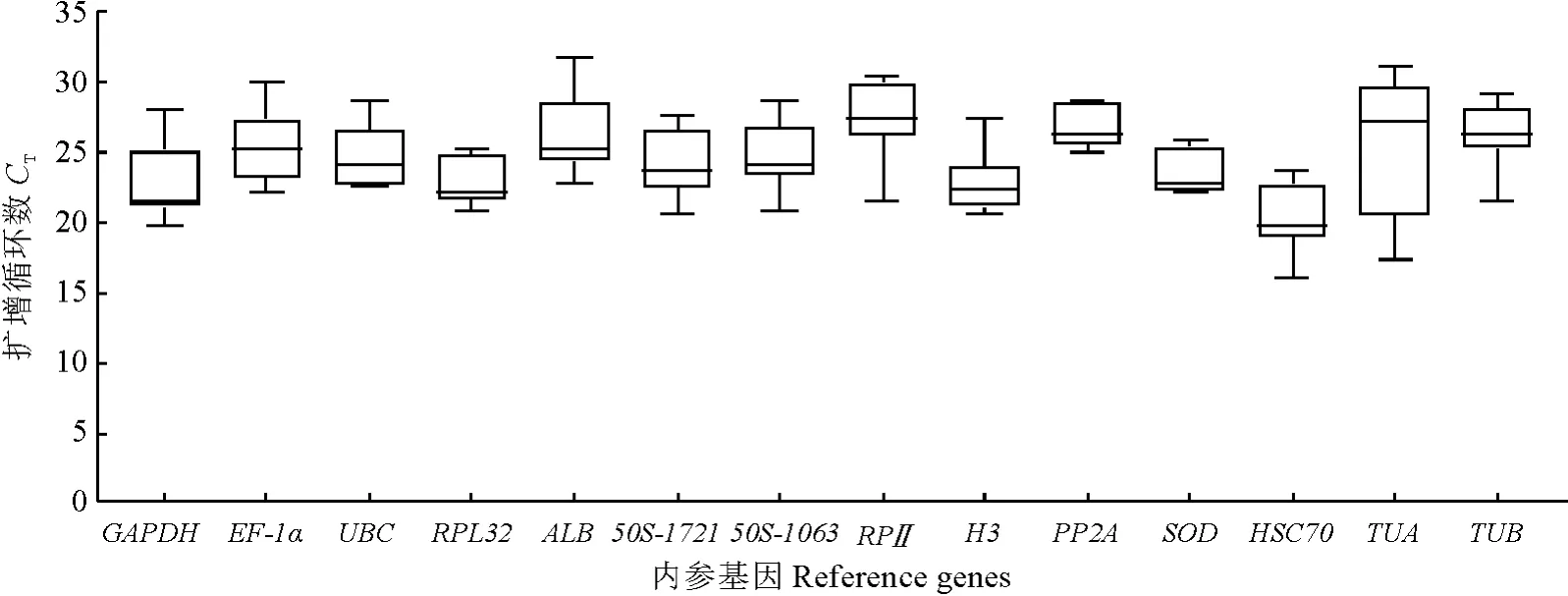
图2 内参基因的平均CT 值A line across the box is depicted as the median.The box indicates the 25th and 75th percentiles.Whiskers represent the maximum and minimum values in all samples.Fig.2 Average CT value of each reference gene
2.3 候选基因稳定性评价
2.3.1geNorm 分析
geNorm 软件可以将荧光qRT-PCR 得到的CT值转化为相对定量数据,并逐渐剔除最不稳定表达的内参基因,直到保留稳定性最高的基因。这一过程由每一步各内参基因的平均表达稳定性值M决定。M的稳定表达阈值为1.5,M值越小,基因表达越稳定。ABA 处理中,PP2A和SOD是最稳定的内参基因,M值为0.05,而TUA最不稳定,M值为2.08。干旱处理组最稳定的候选内参基因为RPⅡ和TUB,M值为0.08;最不稳定的内参基因为ALB,M值为0.98;UBC和TUB的稳定性最高(M=0.13),EF-1α稳定性最差(M=0.93)。热处理条件下,最稳定的基因为50S-1063和H3(M=0.02),而最不稳定的基因为ALB(M=1.38)。在昼夜节律处理中,RPL32和ALB(M=0.36)是最稳定的基因,TUA(M=2.26)是最不稳定的基因。总体而言,RPL32和SOD(M=0.43)是所有处理中最稳定的基因,而TUA(M=2.21)表达最不稳定(图3)。
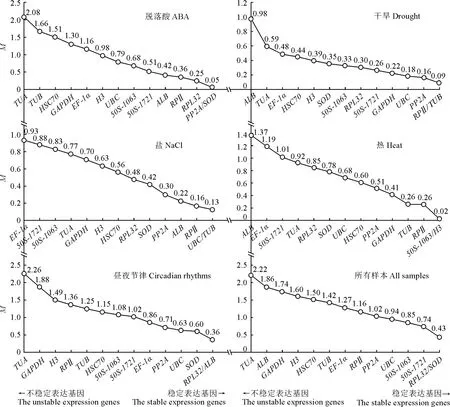
图3 geNorm 软件分析14个内参基因表达稳定性值(M)Fig.3 Expression stability values (M) of 14 internal reference genes analyzed by geNorm software
为确定试验标准化所需的最佳内参基因数量,采用geNorm 软件对最佳配对变异值(Vn/Vn+1)[23]进行分析。该计算方法基于Vn/Vn+1值(<0.15)来衡量n为最合适的内参基因数量。如果该值大于0.15,则n+1为最合适的内参基因数。最佳配对变异值显示在ABA、NaCl、干旱、热胁迫处理组中V2/V3值均小于0.15,说明使用2个内参基因能够达到对目的基因较好的校正效果(图4)。
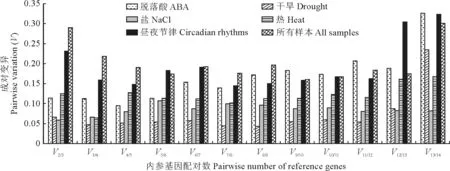
图4 geNorm 分析14个内参基因在不同处理条件下V 值和6个样本亚群14个候选内参基因的成对变异(Vn/Vn+1)分析Fig.4 geNorm analysis of the V values for the 14 reference genes under various conditions,pairwise variation(Vn/Vn+1) analysis of 14 candidate reference genes analyzed in six sample subsets
2.3.2NormFinder分析
NormFinder软件是一种能够有效识别候选内参基因的基本可视化应用工具,通过估计组内变异和组间变异[25],分析基因相对表达的稳定性值,并对候选基因进行排序。稳定表达值越低,表明基因表达越稳定[26]。候选内参基因在各处理中的稳定值见表2。
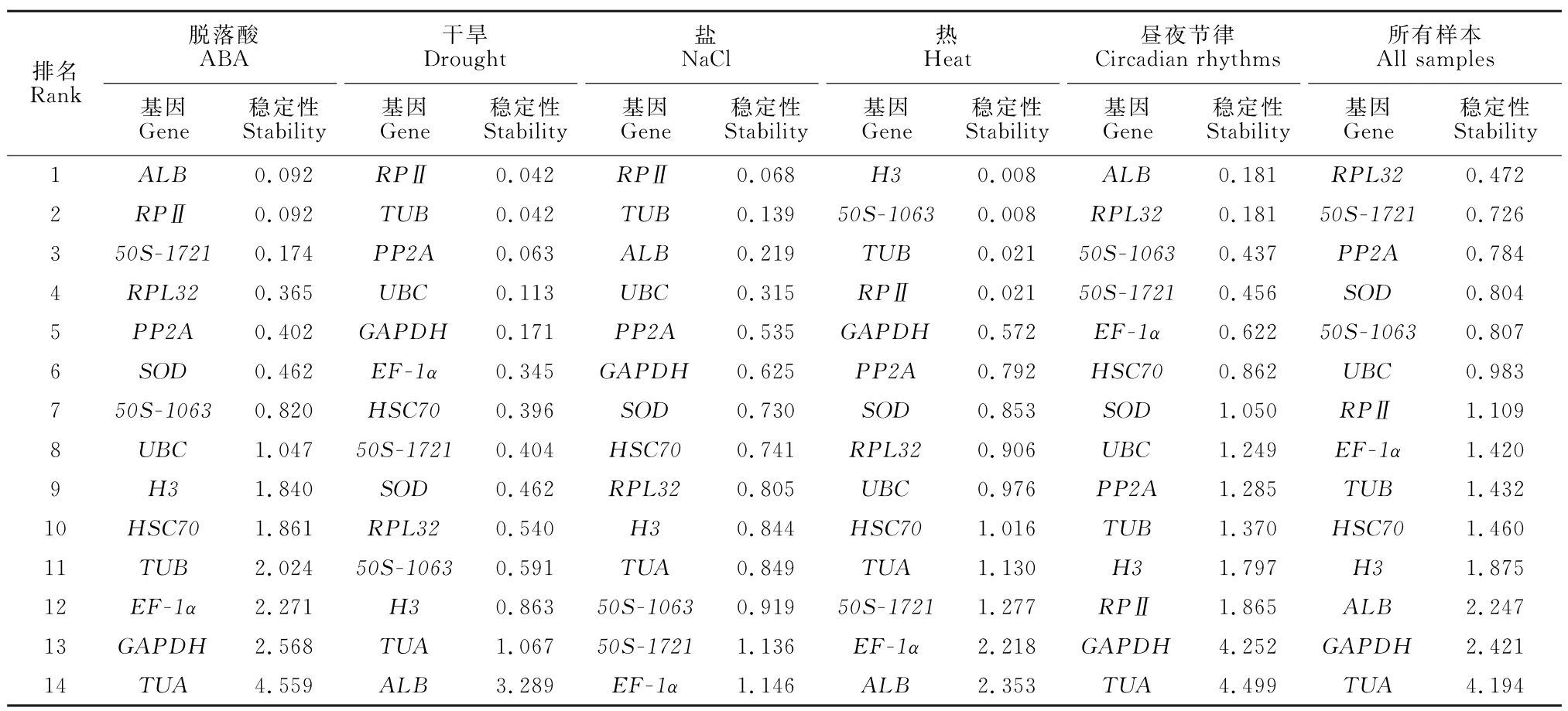
表2 基于NormFinder分析14个内参基因不同胁迫处理下的表达稳定性Table 2 Expression stability of 14 reference genes under various treatments based on the NormFinder analysis
分析结果表明,叶面喷施ABA 处理中,ALB和RPⅡ是最稳定的内参基因,TUA是最不稳定的内参基因。在干旱处理中,RPⅡ和TUB是最稳定的基因,ALB是最不稳定的内参基因,这与geNorm 的数据项一致。RPⅡ和TUB也是盐胁迫下最稳定的内参基因,EF-1α是盐胁迫下最不稳定的内参基因。热处理时,H3和50S-1063是最稳定的内参基因,ALB是最不稳定的内参基因。ALB和RPL32是昼夜节律中最稳定的内参基因,TUA是最不稳定的内参基因。所有样品的稳定性排名为:RPL32>50S-1721>PP2A>SOD>50S-1063>UBC>RPⅡ>EF-1α>TUB>HSC70>H3>ALB>GAPDH>TUA。
2.3.3Bestkeeper分析
通过qRT-PCR 直接获得所有样本的原始CT值,计算BestKeeper分析中内参基因的稳定性,得到每个内参基因的变异系数(CV)和标准偏差(SD),筛选出最稳定的基因表达[27]。最小的SD 值具有最稳定的基因表达水平。根据处理样品稳定性分析值(表3),得出ABA 处理中基因相对表达稳定性排序为HSC70>RPL32>SOD>PP2A>TUB>RPⅡ>ALB>50S-1721>50S-1063>TUA>UBC>H3>EF-1α>GAPDH,HSC70是最稳定的内参基因,GAPDH是最不稳定的内参基因。干旱胁迫下基因表达稳定性排序为SOD>RPL32>H3>UBC>TUB>50S-1721>RPⅡ>50S-1063>PP2A>GAPDH>HSC70>EF-1α>TUA>ALB。盐处理组基因表达稳定性排序为PP2A>HSC70>UBC>SOD>TUB>RPL32>H3>RPⅡ>ALB>EF-1α>GAPDH>50S-1721>50S-1063>TUA。热处理组基因表达稳定性排序为50S-1721>RPL32>SOD>50S-1063>H3>ALB>TUB>RPⅡ>GAPDH>UBC>PP2A>TUA>HSC70>EF-1α。
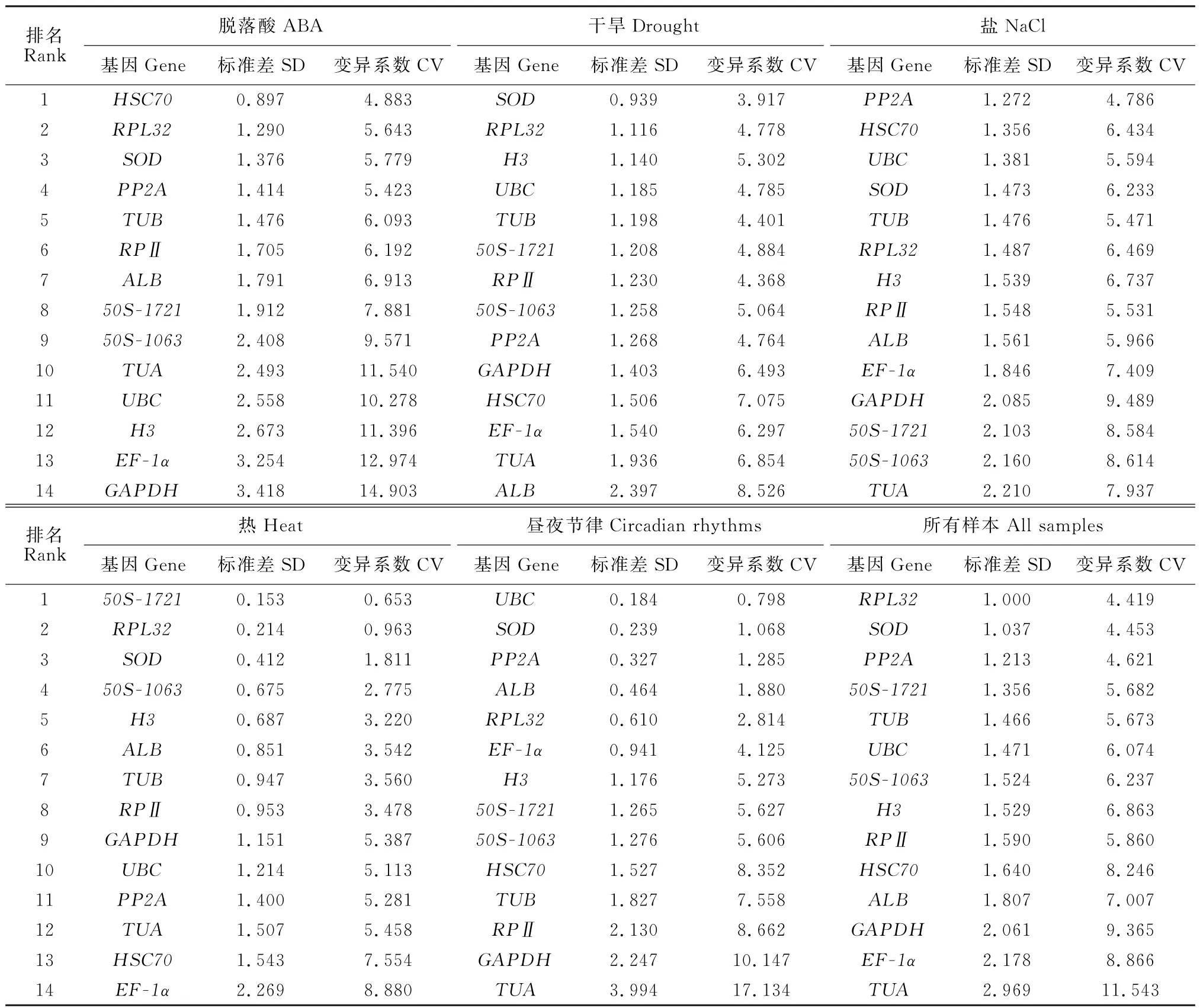
表3 利用BestKeeper算法计算梭梭非生物胁迫下候选内参基因表达稳定性Table 3 The BestKeeper algorithm was used to calculate the expression stability of candidate reference genes of H.ammodendron under abiotic stress
昼夜节律组内参基因表达稳定性排序为UBC>SOD>PP2A>ALB>RPL32>EF-1α>H3>50S-1721>50S-1063>HSC70>TUB>RPⅡ>GAPDH>TUA。在所有样本中,基因表达稳定性综合顺序为RPL32>SOD>PP2A>50S-1721>TUB>UBC>50S-1063>H3>RPⅡ>HSC70>ALB>GAPDH>EF-1α>TUA。总体而言,RPL32是相较稳定的内参基因,而TUA是较为不稳定的内参基因(表3)。
2.3.4RefFinder分析
使用geNorm、NormFinder和BestKeeper 3个软件分析了不同非生物胁迫处理下最合适的内参基因,3个软件分析的结果稍有不同。为了得到更综合的分析结果,利用RefFinder网站对数据进行综合比较分析,并通过综合分析对内参基因的稳定性进行排序。
结果表明,在ABA 和昼夜节律条件下,ALB(2.43和1.41)是最稳定的内参基因。而其他样品中,所有处理中最稳定的内参组分别是干旱处理下的RPⅡ(2.30)、盐胁迫下的TUB(2.11)、热处理下的H3(1.97)和RPL32(1.00)基因(图5)。
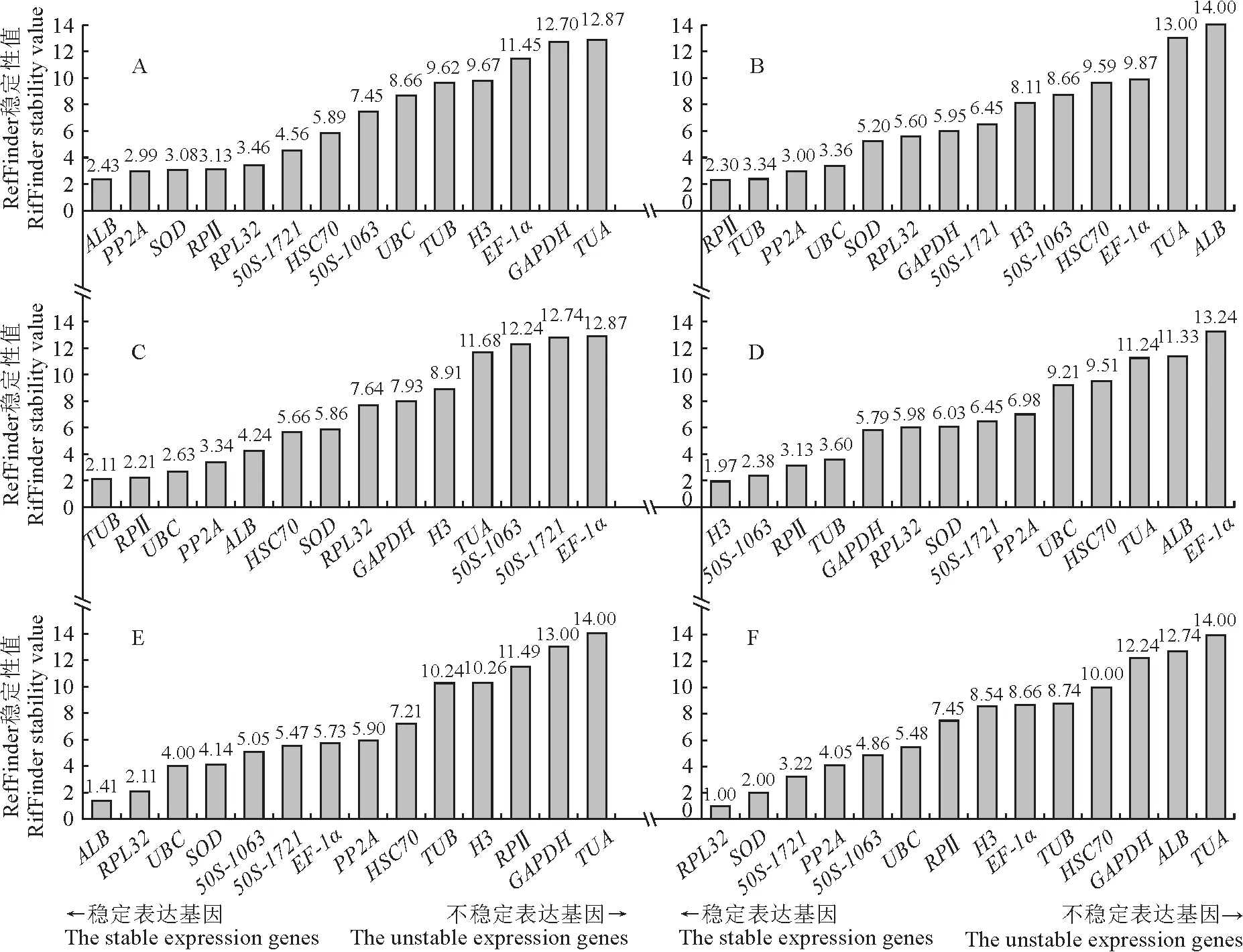
图5 RefFinder程序综合分析候选基因在不同非生物胁迫下组织表达稳定性排序A.ABA-treated group;B.Drought-treated group;C.NaCl-treated group;D.Heat-treated group;E.Circadian rhythm sampling group;F.All samples.Fig.5 Comprehensive analyses of the tissue expression stability ordering of candidate genes under different abiotic stresses by the RefFinder program
2.4 不同内参基因对试验结果的影响分析
为验证候选内参基因的有效性,研究测定不同时间NaCl处理后梭梭PEPC基因在叶片组织中的表达情况。PEPC是C4光合代谢循环核心基因,是研究植物高光效调控关键基因[28]。选择了表达最稳定的基因(SOD)和最不稳定的基因(TUA)作为内参来分析PEPC在不同处理下的表达量。使用SOD作为参考基因,PEPC在NaCl处理后的相对表达在4 h,8 h和24 h为对照的1.9,0.7,2.7倍,PEPC表达量最低水平在NaCl处理4 d后。当使用最不稳定基因TUA作为内参时,PEPC在NaCl处理4 h的表达量为对照的6.7倍,随着盐处理时间延长,表达量逐渐下降,表达趋势变化和SOD作为内参呈现出不同的变化趋势(图6)。该研究结果证实,使用不同的内参基因进行目的基因的相对定量会产生较大的差异。
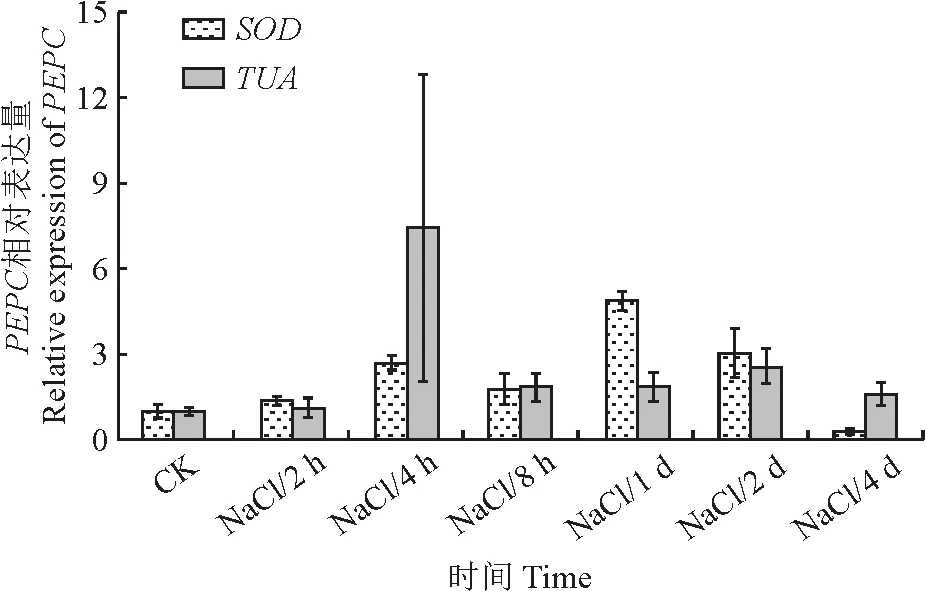
图6 使用不同的候选内参基因归一化计算梭梭PEPC 的相对表达量Fig.6 Relative expression levels of PEPC normalized by different candidate reference genes
3 讨论
qRT-PCR 是用来检测不同类型样本中基因表达水平的最有力工具之一,在生命科学及农业科学研究领域有着广泛的应用。但内参基因的表达水平和稳定性会影响目的基因定量分析的准确性[29-30]。研究表明,特定内参基因的适宜性取决于试验条件,不稳定表达的内参基因使用可能产生假阳性和偏倚结果[31-32]。因此,为了减少qRT-PCR 结果的偏差,寻找合适的内参基因校正目标基因表达水平是非常必要的。目前已对很多植物如苹果[33]、杨树[10]、人参[34]、柴胡[35]、牡丹[36]、秋石斛[37]等进行了不同组织或组织生长发育阶段内参基因筛选。本研究在查阅其他植物中常用的内参基因结合课题组梭梭转录组数据库比较和综合评价后,筛选出了14个内参候选基因,并通过不同非生物胁迫处理比较分析备选内参基因表达稳定性。14个内参基因包括常作为内参使用的GAPDH[38]、TUB[39]、EF-1α[40]等。
最合适的内参基因表达水平应受环境因素、生理和发育阶段的影响较小,在不同组织样品中均能稳定表达[41]。有研究表明,用未经验证的内参基因定量靶基因相较使用稳定表达的内参基因其表达量差异达100倍[42]。本研究也发现了类似的现象,使用稳定内参基因SOD和不稳定内参基因TUA分别校正梭梭PEPC表达,PEPC基因出现不同的表达趋势。因此,在试验中加入合适的内参基因校正目标基因是非常重要和必要的。此外在qRT-PCR实验中,一些研究选择1个内参基因来校正目的基因表达,但在某些特定试验条件下,为了防止单个基因产生的定量误差,可使用多个内参基因,这样避免不同条件对同一基因表达水平的影响[43-45]。因而,可使用2个或2个以上的内参基因同时对靶基因进行校正,能获得更准确的试验结果[46]。
此外,内参基因在不同处理条件和不同植物或组织中并不是完全稳定的,有些内参基因只有在特定条件下才能稳定表达。在藜科盐角草的研究中发现,不同氮胁迫下,TUA是组织最稳定的内参基因[47]。但在本研究中,TUA基因在所有处理样本中的表达稳定性均较差。另外,ALB很少作为植物内参基因使用,但在本研究中发现ABA 处理和昼夜节律下,ALB是最稳定的内参基因,且有研究表明在油茶果实发育中ALB可作为稳定的内参基因使用[48]。
在另一项研究中,在干旱条件下,UBQ和EF-1α是马铃薯[49]和小花南芥[50]中最稳定的内参基因,RPⅡ是柽柳最稳定的内参基因,研究结果发现干旱胁迫下,宜采用TUB和RPⅡ进行靶基因校正。在热胁迫研究中,H3常作为稳定的内参使用,本研究得到类似的结论,而Liu等[51]对黑豆热胁迫处理后分析认为HIS3和eIF4A是最适用的内参基因。在不同盐浓度处理中,PP2A和TUA5被认为是在不同组织和盐处理中最稳定的内参基因[42]。本研究中发现TUB和RPⅡ基因是盐胁迫反应中最合适的内参基因。以上研究表明植物受到生物胁迫、非生物胁迫和激素处理等会对基因的表达稳定性产生重大的影响。因此,在不同的试验条件下选择最合适的内参基因至关重要。目前,NormFinder、BestKeeper geNorm 和RefFinder是研究人员开发用于筛选样本中稳定内参基因的分析工具。但由于计算方法不同,分析结果也会有所不同[24,52]。因此,在选择不同处理、不同组织、不同发育阶段的样品内参基因时,通常会结合几种软件综合进行分析。此外,为了更好地校正靶基因,针对一些非模式植物,新内参基因的挖掘也十分重要。
近年来,新一代高通量测序技术逐步完善,使用转录组为筛选新的内参基因提供了极大便利,间接为阐明目标物种的生物学问题及相关分子机制提供了有利的参考。梭梭是中国西部荒漠区重要的木本C4植物,也是荒漠区重要的造林树种,梭梭极强的干旱抗性及荒漠适应性受到了极大的关注[53],梭梭抗性机制的分子研究也逐渐开展[54]。基于此,本研究以开发梭梭稳定内参为研究目的,通过梭梭转录组筛选14个潜在内参基因,经过不同逆境胁迫处理筛选得到相应处理下稳定的内参,为荒漠植物梭梭qRT-PCR 研究提供了标准化参考,也为今后开展梭梭分子生物学相关研究奠定基础。
4 结论
研究分析和筛选了不同胁迫处理下梭梭稳定内参基因,结果表明:
(1)ALB是昼夜节律和ABA 处理下最稳定的内参基因。
(2)在干旱胁迫和盐胁迫下,应采用TUB和RPⅡ进行靶基因校正。
(3)H3基因是热胁迫处理下最为稳定的内参基因。
(4)对各内参基因的综合稳定性排序,计算几何平均值结果表明ALB和RPL32是所有样本中最稳定的内参基因,SOD和RPL32是综合最稳定的内参基因。

