肺表面活性物质治疗新生儿肺透明膜病的效果及对炎症因子的影响
黄天乐,高德雄,麦兴江
江门市新会区第二人民医院儿科,广东江门 529199
新生儿肺透明膜病又称为新生儿呼吸道窘迫综合征(Respiratory distress syndrome, RDS),是临床儿科常见的一种呼吸系统疾病,也是导致早产儿死亡的重要原因之一[1-2]。RDS 的发病机制较为复杂,其中宫内窘迫、妊娠糖尿病等因素均是导致该疾病发生的高危因素[3],目前如何进一步提高此类患儿的救治率已成为儿科临床的重点研究方向。经鼻持续正压通气是治疗RDS 患儿的标准手段,可对患儿的临床症状和血氧饱和度起到一定的改善作用,但治疗效果并不十分理想,仍需联合其他措施来改善其临床预后[4]。研究发现,应用肺表面活性物质可降低肺泡表面张力,促进氧合,可起到治疗效果[5-6]。基于以上背景,本研究选取2017 年1 月—2023 年2 月江门市新会区第二人民医院收治的94例新生儿肺透明膜病患儿作为研究对象,探讨肺表面活性物质对新生儿肺透明膜病的治疗效果。现报道如下。
1 资料与方法
1.1 一般资料
选取本院收治的新生儿肺透明膜病患儿94 例为研究对象,采用随机数表法分为两组,各47 例。对照组给予经鼻持续正压通气治疗,观察组则在对照组基础上加用肺表面活性物质进行治疗。观察组中男24 例,女23 例;胎龄28~36 周,平均(32.17±5.23)周;出生体质量1.10~1.84 kg,平均(1.46±0.28)kg。对照组中男26 例,女21 例;胎龄28~36 周,平均(31.98±6.21)周;出生体质量1.10~1.92 kg,平均(1.54±0.31)kg。两组患儿一般资料对比,差异无统计学意义(P>0.05),具有可比性。本院医学伦理委员会已批准本研究开展。
1.2 纳入与排除标准
纳入标准:均明确诊断为RDS,并在出生后12 h内出现相关临床症状,如吸气性三凹征、呼吸困难及呻吟等;临床资料完整,家长均自愿签署知情同意书。
排除标准:合并坏死性肠炎和肺出血等其他并发症者;伴有重要脏器功能衰竭者;合并其他高危传染病者;对本研究治疗方式不耐受者。
1.3 方法
所有患儿经收治入院后给予常规治疗,包括吸氧、吸痰、生命体征监测和血氧监护等。对照组在基础上应用纽邦e360 呼吸机给予经鼻持续正压通气治疗,参数设定:氧流量:6~8 L/min,吸入氧浓度(inhaled oxygen concentration, FiO2):0.3~0.6,呼气末正压:4~5 cmH2O。观察组在对照组基础上联合肺表面活性物质[猪肺磷脂注射液(国药准字H20 181201;规格:1.5 mL∶0.12 g/瓶)]治疗,用药前先对患儿的呼吸道进行清洁,而后使用一次性注射器吸取100 mg/kg 肺表面活性物质,并将其经由气管注入至气管分叉部位,用药后使用复苏囊持续加压给氧10 min。
1.4 观察指标
1.4.1 疗效评价 参照文献[7]制定疗效评定表标准,具体如下:呼吸困难症状得到明显改善,且生命体征正常视为显效;呼吸困难等症状有所缓解,且生命体征相对平稳视为有效;不符合以上标准者均视为无效。治疗总有效率=显效率+有效率。
1.4.2 临床指标 记录两组患儿的住院时间、辅助通气时间、高压力持续时间、高吸氧分数持续时间和住院费用。
1.4.3 肺功能指标 应用肺部功能检测仪对两组患儿治疗后的肺功能指标进行检测,包括一秒用力呼气容积(forced expiratory volume inone second, FEV1)、用力肺活量(forced vital capacity, FVC)、最大呼气流量(peak expiratory flow, PEF)及第一秒用力呼气量占所有呼气量的比例(forced expiratory volume in the first second/forced vital capacity, FEV1/FVC)。
1.4.4 血清炎性因子 分别于治疗前后采集两组患儿周静脉血5 mL,经离心处理后,应用全自动生化分析仪检测其血清高敏C 反应蛋白(highsensitivity C-reactive protein, hs-CRP)和降钙素原(procalcitonin, PCT)。
1.5 统计方法
选用SPSS 20.0 统计学软件进行统计学分析。符合正态分布的计量资料以(±s)表示,行t检验;计数资料以例数(n)和率(%)表示,行χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患儿临床疗效比较
观察组治疗有效率高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组患儿治疗效果比较
2.2 两组患儿各项指标比较
观察组患儿高压力持续时间、住院时间、辅助通气时间、高吸氧分数持续时间及住院费用均明显低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患儿各项指标比较(±s)
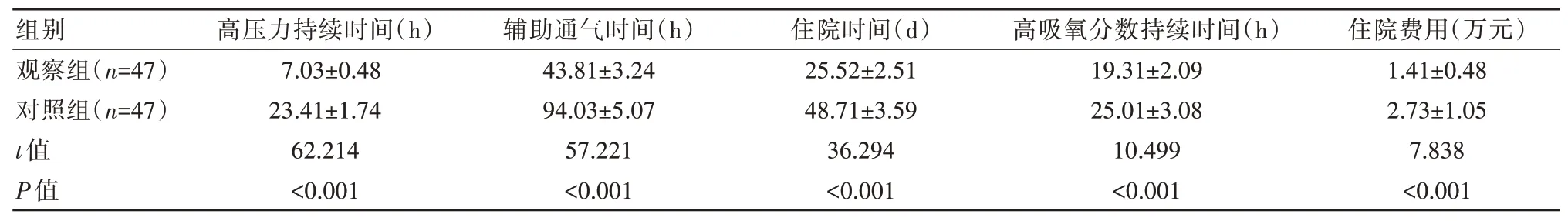
表2 两组患儿各项指标比较(±s)
?
2.3 两组患儿肺功能指标比较
治疗后,观察组患儿FVC、FEV1、PEF 及FVE1/FVC 指标均较对照组显著偏高,差异有统计学意义(P<0.05),见表3。
表3 两组患儿肺功能指标比较(±s)
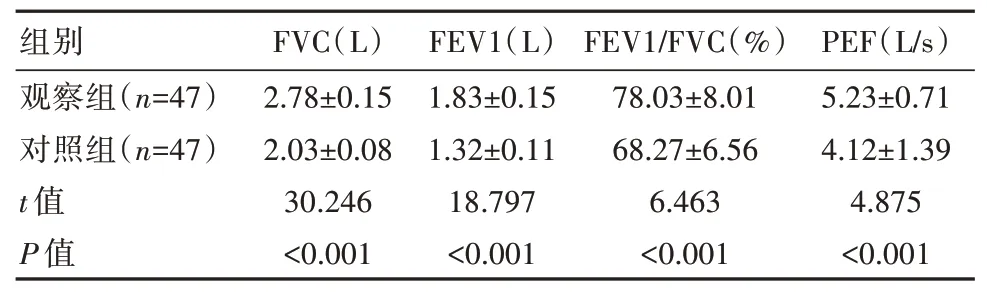
表3 两组患儿肺功能指标比较(±s)
?
2.4 两组患儿治疗前后血清炎性因子水平比较
治疗后,与对照组比较,观察组的血清PCT 和hs-CRP 水平均低,差异有统计学意义(P<0.05),见表4。
表4 两组患儿治疗前后血清炎性因子水平比较(±s)
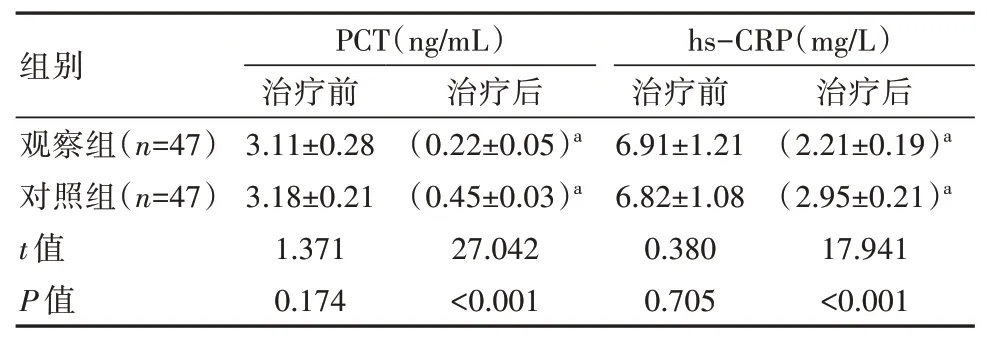
表4 两组患儿治疗前后血清炎性因子水平比较(±s)
注:与同组治疗前对比,aP<0.05。
?
3 讨论
肺泡Ⅱ型上皮细胞产生的肺表面活性物质缺乏是导致新生儿肺透明膜病的主要病理机制,随着医疗技术的发展,RDS 患儿的救治率得到了明显的提升,但仍需要积极的干预措施来改善患儿的预后。经鼻持续正压通气是目前临床治疗RDS 患儿的标准手段,可快速肺泡顺应性,改善患儿的临床症状,但其疗效的维持时间较短[8-9]。由此可见,积极寻找一种更为科学、有效的治疗方案仍具有重要的现实意义。
本研究结果显示,观察组患儿的治疗有效率较对照组显著偏高(P<0.05),提示在持续正压通气治疗的基础上联合肺表面活性物质治疗可起到协同增效的作用,这可能是因为肺表面活性物质的使用可有效防止肺泡在呼气末时的萎陷,使得肺顺应性和氧合功能明显改善,从而起到延缓疾病进展的作用[10]。研究发现,血氧浓度过高可能会导致患儿发生过渡性氧暴露损伤,阻碍疾病康复[11]。本研究中观察组患儿的住院时间、高吸氧分数持续时间、辅助通气时间及高压力持续时间等均较对照组明显缩短(P<0.05),提示肺表面活性物质的应用可起到明显促恢复作用。分析其原因在于,经鼻持续正压通气治疗可有效改善患儿的肺通气量,而在此基础上应用肺表面活性物质起到维持肺泡表面积的作用[12],确保药效充分发挥,起到提高疗效的作用。本研究中观察组患儿的肺功能指标改善效果明显优于对照组(P<0.05),再次验证肺表面活性物质的应用可提高RDS 患儿治疗效果的这一观点。
现已证实,炎症反应与RDS 疾病的发生发展过程存在密切联系,其中hs-CRP 和PCT 均为应激性急性期反应蛋白,其表达水平的持续升高,表示机体存在炎症反应,且可在一定程度上加速疾病的进展。本研究中观察组治疗后血清PCT[(0.22±0.05)ng/mL vs(0.45±0.03)ng/mL] 和hs-CRP[(2.95±0.21)mg/L vs(2.21±0.19)mg/L]水平均明显低于对照组(P<0.05),这与学者李芳芳等[13]研究中观察组治疗7 d 后血清PCT[(0.26±0.02)ng/mL vs (0.39±0.04)ng/mL]和hs-CRP[(2.39±0.23)mg/L vs (2.93±0.28)mg/L]均明显低于对照组这一结论基本相符。这表明肺泡表面活性物质的应用可减轻RDS 患儿的炎症反应,分析其原因在于肺泡表面活性物质可通过缓解组织和器官的再缺血灌注损伤来抑制内源性炎性因子的表达,起到保护机体主要脏器功能的作用。
综上所述,在新生儿肺透明膜病的治疗中可优先考虑经鼻持续正压通气联合肺表面活性物质这一治疗方案,可有效下调患儿血清中的炎性因子水平,并促进其肺功能的改善,缩短恢复进程,值得临床借鉴。

