贝莱斯芽孢杆菌ZHX-7 的分离鉴定及抑菌促生效果
李莹 宋新颖 何康 郭志青 于静 张霞
(山东省花生研究所,青岛 266100)
花生(Arachis hypogaea)在全球100 多个国家都有种植,中国、印度、尼日利亚花生产量位居前3 位[1]。花生为人们提供珍贵的食用油和蛋白质,是我国北方地区最主要的油料作物,在农业生产中占据不可或缺的位置[2]。然而,随着种植模式和气候的变化,在花生的整个生育期,花生真菌病害严重威胁花生的产量与品质,严重时减产20%以上[3]。花生白绢病(Sclerotium rolfsii)[4]和花生基腐病(Fusarium neocosmosporiellum)[5]为花生土传性真菌病害,花生网斑病(Phoma arachidicola)[6]和花生轮斑病(Alternaria alternata)[7]为花生叶部病害。目前花生病害的防治主要依赖化学药剂——杀菌剂,但其大量使用严重影响人类健康和土壤微生物系统的平衡[8]。拮抗微生物作为生防菌剂具有更好的环境友好性和可持续性[9],因此高效拮抗生防菌的筛选与应用成为研究的热点。
目前,在促进花生生长和防治花生病害方面的生防菌主要为真菌和细菌,例如联合接种缓生根瘤菌和木霉菌促进了花生生长并增加了产量[10]。黏质沙雷氏菌SerEW01 能够抑制镰刀菌菌丝的生长和孢子萌发,以及伏马毒素的积累[11]。在可控条件和大田条件下,哈茨木霉CT306 和枯草芽孢杆菌CT104均能促进花生生长和提高花生抗病性[12]。与真菌相比,生防细菌具有易培养、繁殖快等优势,因而在生防微生物中更受青睐。
从植物的根或根际分离的微生物能更好地适应该作物,并可能更好地控制病害[13]。本研究从连作花生田中分离到一株生防菌株ZHX‑7,结合形态学特征和16S rDNA、gyrB序列分析对其进行鉴定,测试其对4 种花生病原真菌的拮抗效果,并初步分析其拮抗因子,旨在为花生病害的生物防治提供菌种资源和理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 花生冠腐病菌(Aspergillus niger)、白绢病菌(Sclerotium rolfsii)、基腐病菌(Fusarium neocosmosporiellum)、网斑病菌(Phoma arachidicola)和轮斑病菌(Alternaria alternata),均由本研究室分离保存。贝莱斯芽孢杆菌(Bacillus velezensis)ZHX‑7 菌株由本研究室分离并保存在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.20374。
1.1.2 供试花生品种 本试验所用花生品种为花育33 号,由本单位培育保存。
1.1.3 供试土样 山东莱西花生连作田的病、健株根际土壤样品。
1.1.4 供试培养基 PDA 培养基、LB 培养基、选择性培养基(蛋白酶、纤维素酶和淀粉酶)的配制参考董国菊[14]的方法。
1.2 方法
1.2.1 菌株ZHX‑7 的分离与纯化 生防菌株的分离参照张霞等[1]的方法。取莱西花生连作田的病、健株根际土壤样品,加入无菌水中,充分振荡混匀,静置后对上清液进行10 倍系列稀释法,设置4 个浓度(10-2、10-3、10-4、10-5),每个浓度吸取150 μL分别涂于LB 平板上,3 次重复,置于28℃培养。待培养基上出现细菌菌落时,喷施花生冠腐病菌孢子悬浮液。培养2 d 后,选取周围出现明显抑菌圈的单菌落,在LB 平板上进行纯化培养。通过平板对峙试验[15]测定候选生防菌对冠腐病菌的拮抗效果,最终挑选了一株抑菌圈最大的菌株,命名为ZHX‑7。
1.2.2 菌株ZHX‑7 鉴定 观察ZHX‑7 在LB 平板上生长的菌落形态特征。采用细菌DNA 提取试剂盒(天根生化科技有限公司)提取ZHX‑7 基因组DNA,以此为模板进行16S rDNA(27F: 5'‑AGAGTTTGAT‑CMTGGCTCAG‑3', 1495R: 5'‑TACGGYTACCTTGT‑TACGACTT‑3')和gyrB(UP1SF: 5'‑GAAGTCATCAT‑GACCGTTCTGC‑3', UP2SR: 5'‑AGCAGGGTACGGAT‑GTGCGAGCC‑3')序列的PCR 扩增。经生工生物工程(上海)股份有限公司对PCR 产物测序,获得的序列通过GenBank 进行Blast 序列相似性分析,利用MEGA7.0 软件基于16S rDNA 和gyrB序列构建ZHX‑7 的系统发育树。
1.2.3 菌株ZHX‑7 菌悬液对4 种花生病原菌菌丝生长的抑制作用 参照张霞等[1]的方法。菌悬液的制备:挑取菌株ZHX‑7 的单菌落于20 mL 液体LB中,28℃,150 r/min 振荡培养14 h,5 000 r/min 离心10 min,弃上清,用无菌水重悬,获得OD600为0.2的菌悬液。平板对峙试验:选取新活化长势好的病原菌,打孔器打取直径为5 mm 的菌饼,在PDA 平板中央放置该病原菌的菌饼,其两侧约22 mm 处各加菌株ZHX‑7 的菌悬液10 μL,以等量无菌水作为对照,每个处理重复6 次,25℃恒温培养。测量菌落直径,采用菌丝生长速率法[16]计算抑菌率。
1.2.4 菌株ZHX‑7 无菌发酵液对4 种花生病原菌菌丝生长的抑制作用 参照1.2.3 的方法摇菌 48 h,离心收集上清液,用0.22 μm 滤膜过滤得到无菌发酵液。将无菌发酵液以稀释10 倍的比例与加热冷却至约50℃的PDA 培养基混合倒平板,在平板中央放置上述病原菌的菌饼,对照组则添加等量LB 培养基,每个处理重复6 次,25℃培养,测量菌落直径,计算抑菌率。
1.2.5 菌株ZHX‑7 挥发性气体对4 种花生病原菌菌丝生长的抑制作用 采用双皿对扣法测定挥发性气体的抑菌活性[17]。参照1.2.3 的方法制备菌株ZHX‑7 的菌悬液,用牙签于LB 培养基上划线,PDA培养基中央放置病原菌的菌饼,每个处理重复6 次,测量菌落直径,计算抑菌率。
1.2.6 次级代谢产物胞外酶的产生情况 在选择性培养基(蛋白酶、淀粉酶和纤维素酶)的平板中央分别滴加10 μL ZHX‑7 菌悬液,28℃培养,观察有无透明圈,每个处理3 个重复。
1.2.7 菌株ZHX‑7 有菌发酵液对花生生长和抗病性的影响 参照1.2.4 获得有菌发酵液,选取培养20 d,大小一致的健康花生苗,用ZHX‑7 的有菌发酵液灌根,每盆10 mL 原液,以等量LB 培养基作为对照,均稀释至60 mL。对照和处理各12 盆,每盆3 株,重复3 次。继续培养2 周后,对照和处理分别一分为二,一份取样,测定植株鲜质量和干质量(105℃杀青30 min,75℃ 烘干至恒重);另一份接种花生白绢病菌,每株花生接种10 粒布满白绢病菌的燕麦粒,侵染2 周后取样,统计花生的病情指数、死亡率。花生病情指数分级标准:0 级:无病斑;1 级:仅茎上有病斑,根系健康;2 级:茎和根系产生病斑,地上部正常;3 级:地上部出现萎蔫症状,主要表现为侧枝萎蔫或枯死;4 级:主茎出现萎蔫或枯死的症状。
1.2.8 数据分析 采用Microsoft Excel 进行数据统计,用Microsoft Office PowerPoint 作图,并用新复极差法(Duncan’s 法)进行显著性检验。
抑菌率(%)=(对照菌落增长直径-处理菌落增长直径)/对照菌落增长直径×100%
病情指数=∑(各级级值×各级病株数)/(最高级数×调查总株数)×100
死亡率(%)=死亡株数/调查总株数×100%
防治效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100%
2 结果
2.1 ZHX‑7的分离与鉴定
通过平板对峙试验筛选到9 株对花生冠腐病菌具有明显拮抗作用的生防菌株,选取抑菌圈大的1株菌株(ZHX‑7)(图1‑A)进行后续研究。在LB平板上,ZHX‑7 菌体呈淡黄色,菌落不透明,边缘不整齐(图1‑B),初步确定该菌株属于芽孢杆菌属。
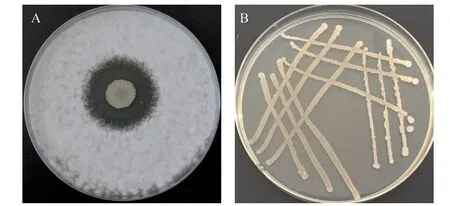
图1 ZHX-7 对冠腐病菌的拮抗效果(A)及其菌落形态(B)Fig. 1 Antagonistic effect of ZHX-7 against A. niger(A)and its colony morphology(B)
通过PCR 扩增获得ZHX‑7 的16S rDNA 和gyrB基因片段,经测序、拼接得到两个基因序列的有效长度分别为1 394 和1 079 bp,序列提交到GenBank数据库(MZ474622、MZ484688) 进行BLAST 分析比对,并基于16S rDNA 和gyrB基因序列用MEGA7.0 软件构建系统发育树,结果(图2)显示,ZHX‑7 与贝莱斯芽孢杆菌Bacillus velezensisSCGB 1聚在同一分支。综上所述,根据菌株ZHX‑7 的形态特征和16S rDNA、gyrB基因序列分析,将ZHX‑7鉴定为贝莱斯芽孢杆菌(B. velezensis)。
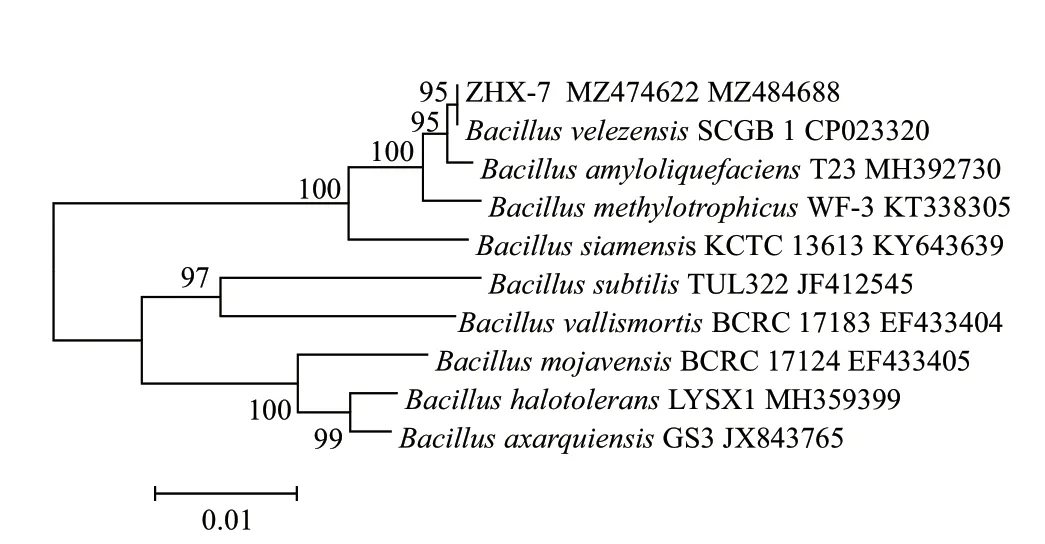
图2 基于16S rDNA 和gyrB 序列的ZHX-7 系统发育分析Fig. 2 Phylogenetic analysis of ZXH-7 based on 16S rDNA and gyrB sequences
2.2 菌株ZHX‑7菌悬液对4种花生病原真菌菌丝生长的影响
通过ZHX‑7 菌悬液对花生白绢病菌、基腐病菌、网斑病菌和轮斑病菌的平板对峙试验发现,菌株ZHX‑7 对这4 种花生病原真菌菌丝的生长均具有显著的拮抗效果(图3‑A, B),抑菌率分别为64.40%、70.37%、77.43%和65.32%(图3‑C)。
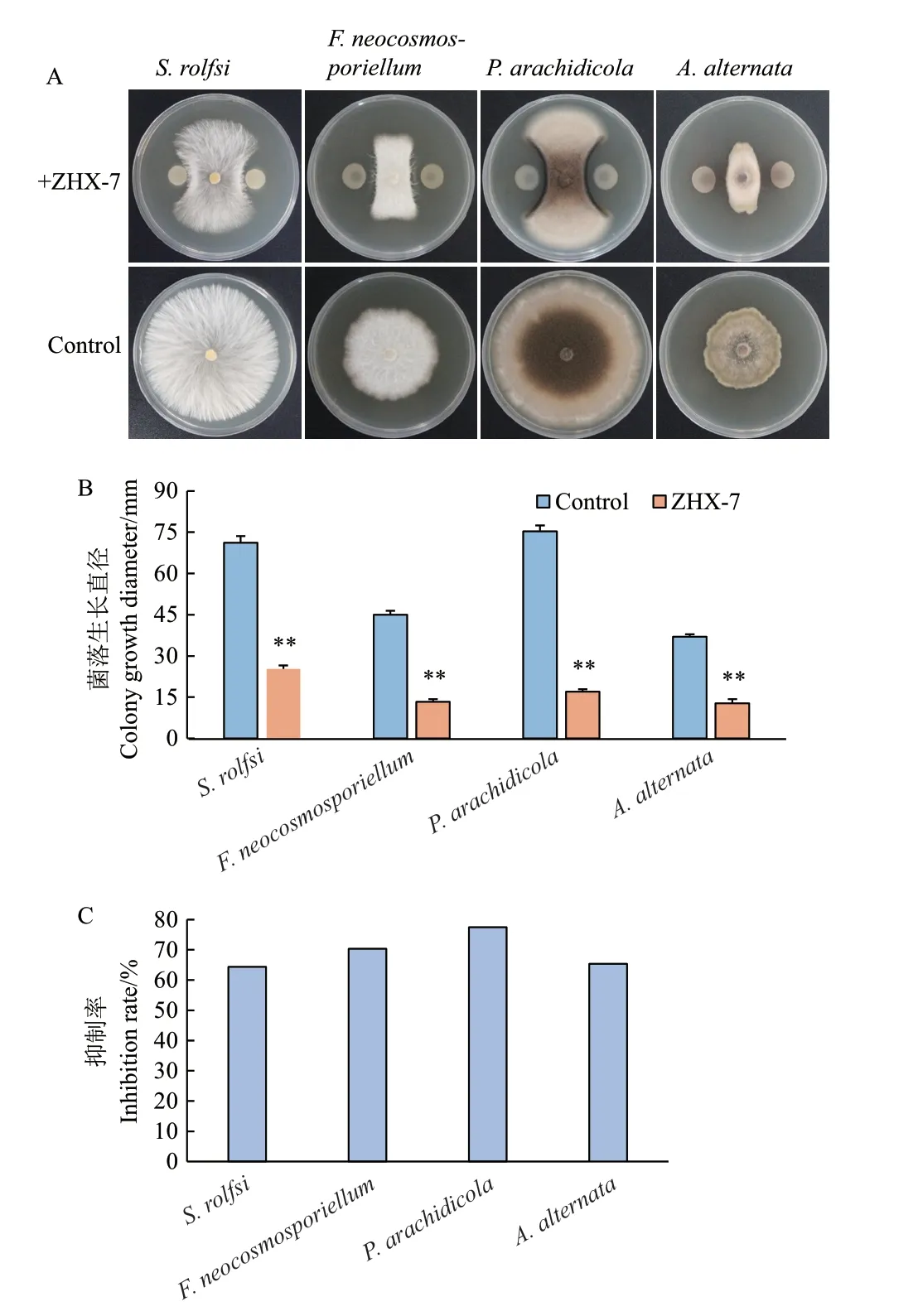
图3 ZHX-7 菌悬液对4 种病原真菌拮抗活性的测定Fig. 3 Determination of antagonistic activity of ZHX-7 bacterial suspension against four pathogens
2.3 菌株ZHX‑7发酵液对4种花生病原真菌菌丝生长的影响
根据对4 种花生病原真菌在菌株ZHX‑7 的无菌发酵液以稀释10 倍的PDA 培养基上的生长情况统计分析,同对照相比,菌株ZHX‑7 的无菌发酵液极显著的抑制了花生4 种病原真菌菌丝的生长(图4‑A, B),表现为对花生白绢病菌、基腐病菌、网斑病菌和轮斑病菌菌丝的生长抑菌率分别为67.81%、52.16%、23.52%和69.93%(图4‑C)。
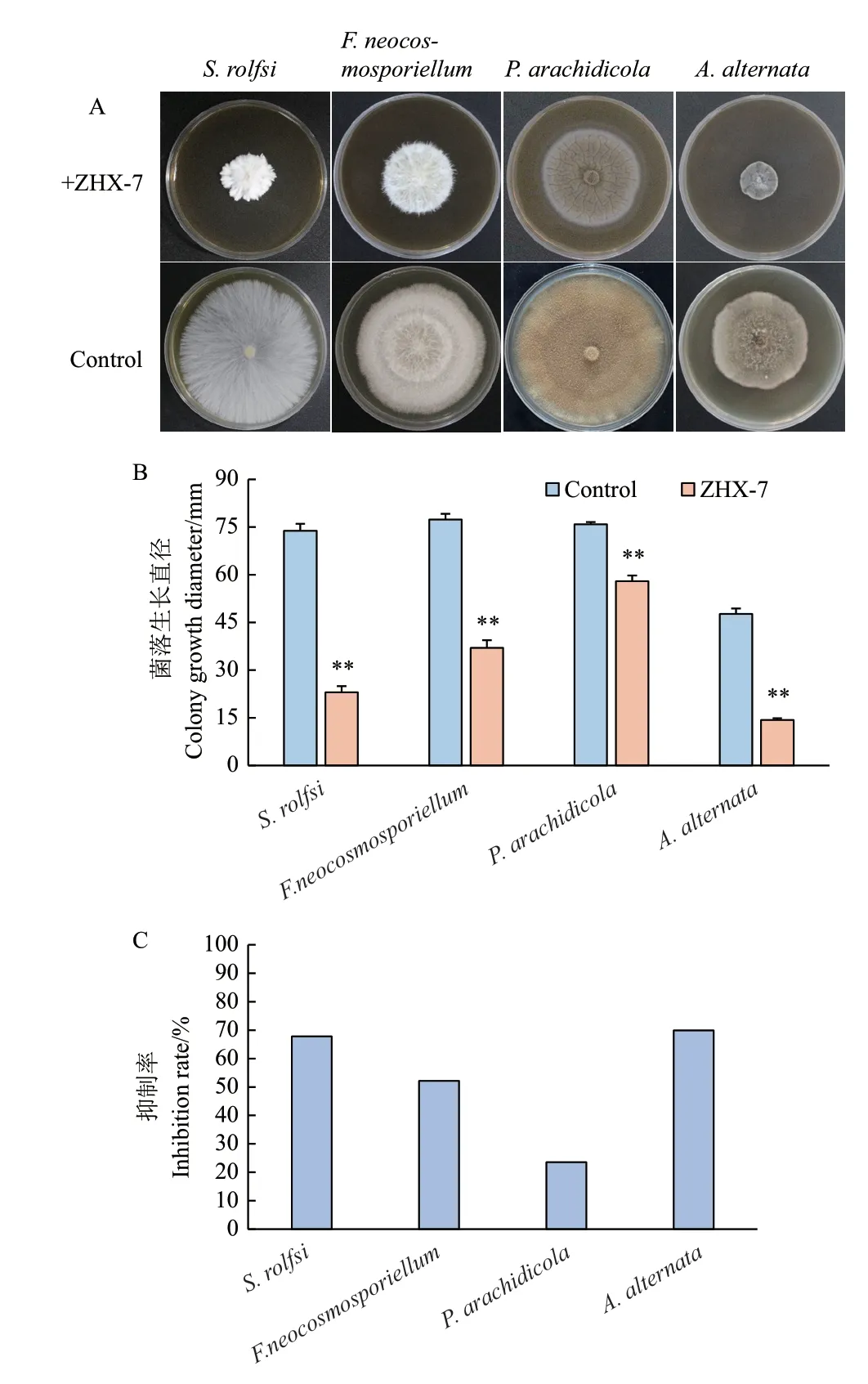
图4 ZHX-7 无菌发酵液对4 种病原真菌生长的影响Fig. 4 Effects of ZHX-7 fermentation broth on the growth of four pathogens
2.4 菌株ZHX‑7挥发性气体对4种花生病原真菌菌丝生长的影响
菌株ZHX‑7 挥发性气体对4 种病原真菌菌丝生长具有不同程度的抑制作用(图5‑A, B),对花生白绢病菌和网斑病菌的抑制效果最为明显,抑制率分别达到86.82%和81.70%,对花生基腐病菌和轮斑病菌的抑菌率分别为35.40%和44.19%(图5‑C)。

图5 ZHX-7 挥发性气体对4 种病原真菌的抑菌作用Fig. 5 Inhibitory effects of ZHX-7 volatiles against four pathogens
2.5 菌株ZHX‑7胞外酶的产生情况
通过选择性培养基测定了ZHX‑7 胞外酶的活性,结果(图6)显示,ZHX‑7 在蛋白酶、纤维素酶和淀粉酶3 种选择性培养基上均能产生明显且很大的透明圈,说明该菌株能够分泌蛋白酶、纤维素酶、淀粉酶,具备分解蛋白质,纤维素和淀粉的能力。

图6 菌株ZHX-7 次级代谢产物胞外酶的情况Fig. 6 Detection of ZHX-7 secondary metabolite extracellular enzyme activity
2.6 菌株ZHX‑7菌悬液对花生生长和白绢病抗性的影响
通过促生试验统计结果发现,经菌株ZHX‑7有菌发酵液处理的花生鲜质量、干质量分别增加31.24%、26.47%,表明菌株ZHX‑7 的有菌发酵液能够明显促进花育33 号植株的生长。此外,经菌株ZHX‑7 的有菌发酵液处理后,接种花生白绢病菌的病情指数显著降低,死亡率降低67.65%,防效达到51.76%,表明菌株ZHX‑7 的有菌发酵液能够显著提高花生对白绢病的抗性(表1)。

表1 ZHX-7 对花生生长及白绢病的防治效果Table1 Control effect of ZHX-7 on peanut growth and peanut Sclerotium blight
3 讨论
由于人们对化学农药的毒性及其对环境影响的关注,抗药病原体的发展,农药禁令的不断增加以及新农药登记数量的减少,严重影响化学防治在病害防治中的应用,而生物防治作为替代品,已被普遍认可,成为有害生物综合治理的重要工具[18]。芽孢杆菌以其生长速度快、繁殖力强、抗逆性强以及抑菌活性广等优势,被广泛用于防治植物病害[19-20]。近年来国内外对贝莱斯芽孢杆菌的研究越来越多,贝莱斯芽孢杆菌不仅对病原真菌白绢病菌[21]、黄曲霉[22]等具有拮抗活性,也能有效抑制黄瓜花叶病毒[23]以及番茄青枯病菌[24]等。
菌株ZHX‑7 的菌悬液、发酵液和挥发性气体对花生白绢病菌、基腐病菌、网斑病菌和轮斑病菌表现出不同程度的抑制作用,其中菌悬液的抑菌效果,网斑病菌 > 基腐病菌 > 轮斑病菌 > 白绢病菌;发酵液的抑菌效果,轮斑病菌 > 白绢病菌 > 基腐病菌 > 网斑病菌;挥发性气体的抑菌效果,白绢病菌 > 网斑病菌 > 轮斑病菌 > 基腐病菌。可见菌悬液、发酵液和挥发性气体对同一病原菌的抑菌效果存在差异,对不同病原菌的抑菌效果也没有规律可循,但多途径产生的抗菌物质提升了菌株ZHX‑7 的综合抑菌能力。ZHX‑7 对白绢病菌的抑制效果优于短小芽孢杆菌LX11[25]和暹罗芽孢杆菌ZHX‑10[1],对网斑病菌的抑菌效果要优于菌株BP‑1[26]。这表明,菌株ZHX‑7 抗菌谱广、抗菌途径多样、综合抑菌能力强,是一株极具生防潜力的有益细菌。
贝莱斯芽孢杆菌作为芽孢杆菌属的一个新种,能够产生具有广谱抗菌活性的次生代谢产物,例如嗜铁素、酶、挥发性有机化合物和脂肽[27-28]。ZHX‑7 能够产生纤维素酶、蛋白酶和淀粉酶,纤维素酶是多数生防菌株的重要拮抗因子。研究表明生防菌绿色木霉(Trichoderma viride)产生的纤维素酶,对抑制瓜果腐霉(Pythium aphanidermatum)的菌丝生长具有重要作用[29]。真菌细胞壁10%的组成成分为蛋白质及糖蛋白,蛋白酶可以降解细胞壁,使菌丝变形等,这些次级代谢产物可能通过破坏病原菌的细胞壁来抑制病原菌的生长。通过初步测定拮抗因子,分析菌株ZHX‑7 的生防机制,但主要拮抗物质及生防机理仍需进一步研究。
对于菌株ZHX‑7 促生作用的研究发现,其作用后花生鲜重和干重均优于对照组,表明ZHX‑7 可以促进植物的吸收,具有较好的促生作用,该促生效果与贝莱斯芽孢杆菌LDO2[22]类似,推测ZHX‑7 基因组中可能存在一系列与植物生长促进相关的基因或基因簇,包括铁载体的合成、促进生长的挥发性有机化合物和促进生长激素的产生以及营养利用等。此外,菌株ZHX‑7 有菌发酵液对白绢病的防治效果达51.76%,与贝莱斯芽孢杆菌LHSB1[21]类似。这一防治效果一方面是菌株ZHX‑7 抑制白绢病菌的生长,另一方面可能是ZHX‑7 激活植物体内的防御酶活性,诱导植物产生系统抗性,该推测还需进一步检测验证。
生防菌株ZHX‑7 的筛选鉴定与应用,为生物菌肥和生物农药的研发提供了优质的资源。后期可进一步对菌株的发酵条件进行优化,并分离鉴定发酵液途径和挥发性气体途径中抑菌活性产物的主要成分,以及探究贝莱斯芽孢杆菌ZHX‑7 是否激活植物体内的防御酶活性,诱导植物产生系统抗性,增强植物抗病能力。
4 结论
本研究从花生连作田中分离得到1 株生防菌株ZHX‑7,鉴定其为贝莱斯芽孢杆菌。ZHX‑7 对花生白绢病菌、基腐病菌、网斑病菌和轮斑病菌具有极显著的拮抗活性,能够产生纤维素酶、蛋白酶和淀粉酶等,此外还能促进花生生长,增强花生对白绢病的抗性。