生防细菌HK11-9 对黄瓜棒孢叶斑病的防病能力及其鉴定
张林林 沈虎生 杨冰 何梦菡 朴凤植 申顺善
(1. 河南农业大学植物保护学院,郑州 450002;2. 河南农业大学园艺学院,郑州 450002)
黄瓜棒孢叶斑病又名黄瓜靶斑病,是由多主棒孢霉(Corynespora cassiicola)引起的一种世界性病害,该病原菌寄主范围广,危害黄瓜(Cucumis sativusL.)、番茄(Solanum lycopersicum)和茄子(Solanum melongenaL.)等上百种蔬菜,在黄瓜上发病尤为严重,主要侵染寄主植物的叶片,形成大小不等的近圆形病斑,也可侵染根、茎、花和果实,严重时会引起落叶、落果,直至整株死亡,导致绝产[1]。目前,黄瓜棒孢叶斑病的防治以化学防治为主,常用杀菌剂有吡唑萘菌胺(isopyrazam)、氟氯醚菌唑(mefentrifluconazole)、嘧菌酯(azoxystrobin)、咪唑菌酮(fenamidone)、氟啶胺(fluazinam)等[2-4],但是化学药剂大量使用会使植物产生抗药性,引起环境污染和人畜中毒等问题,寻求绿色安全的防治手段备受关注,而生物防治是减少和替代化学农药的最有效方式之一[5]。
利用生防微生物防治植物病害在多种病害的防治上取得了良好的效果,目前已有利用生防微生物防治棒孢叶斑病的研究报道,如李新宇等[6]从30份根际土壤样品中分离筛选出10 株对黄瓜棒孢叶斑病菌平板抑制率大的菌株,其中解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ZF57 抑制效果最佳,对黄瓜棒孢叶斑病的防效达到60%左右。赵昱榕等[7]筛选的贝莱斯芽孢杆菌(B. velezensis)ZF2 具有广谱的拮抗作用,其对黄瓜棒孢叶斑病的防治效果能达到90.81%。张晓云等[8]分离的贝莱斯芽孢杆菌HMB28521 对黄瓜棒孢叶斑病的防治效果达80.5%,李翠霞[9]从20 株植物促生根际细菌中筛选出的CZGJXJ‑2 菌株对多主棒孢菌的抑菌率达到70.51%,对黄瓜棒孢叶斑病的防效达到 46.80%。另外,也有报道枯草芽孢杆菌(B. subtilis)NBF809、死亡谷芽孢杆菌(B. vallismortis)NBIF‑001 和荧光假单胞菌(Pseudomonas fluorescens)YC2140 对多主棒孢霉具有抑菌活性,能够防治番茄和烟草棒孢叶斑病[10-12]。但是,目前在生产上推广应用的防治黄瓜棒孢叶斑病的微生物制剂较为欠缺,因此,需要继续筛选优良生防菌,创制高效稳定的微生物制剂。
本研究在河南信阳鸡公山采集的金鸡菊(Coreopsis drummondiiTorr. et Gray)植物根际筛选获得黄瓜棒孢叶斑病生防细菌HK11‑9,研究该菌株对多主棒孢霉的抑菌活性,评价其对黄瓜棒孢叶斑病的防治效果,研究其在黄瓜叶部的定殖能力及对黄瓜叶部防御酶活性的影响等,探讨其生防潜力,为黄瓜棒孢叶斑病的生物防治提供具有潜力的优良生防资源。
1 材料与方法
1.1 材料
生防细菌 HK11‑9 为从河南信阳鸡公山采集的金鸡菊根际土壤分离筛选获得,采用逐步提高诱导浓度的方法获得稳定抗利福平(100 μL/mL)的菌株,并保存在‑80℃超低温冰箱。黄瓜棒孢叶斑病菌多主棒孢霉(Corynespora cassiicola)由河南农业大学植物病害生物防治研究室分离鉴定并保存。供试黄瓜品种为‘寒育6 号’(河南豫艺种业科技发展有限公司)。供试化学药剂为35%氟菌·戊唑醇悬浮剂(拜尔股份公司)。供试培养基为TSA 培养基(Tryptic Soy Broth 30 g,琼脂粉18 g,蒸馏水1 000 mL)、PDA 培养基(土豆200 g,葡萄糖20 g,琼脂粉18 g,蒸馏水1 000 mL)和PDK 培养基(Potato Dextrose Broth 20 g,蛋白胨10 g,琼脂粉18 g,蒸馏水1 000 mL)。
1.2 方法
1.2.1 HK11‑9 对多主棒孢霉菌的抑制活性测定HK11‑9 对多主棒孢霉菌丝生长的抑制活性测定采用平板对峙法。将多主棒孢霉菌饼放在PDK 培养基平板中央,在距离菌饼25 mm 处接种HK11‑9,置于28℃培养箱中培养5 d 后调查抑菌带大小。HK11‑9对多主棒孢霉孢子萌发的抑制活性测定采用悬滴法。取等量的HK11‑9 菌悬液(108CFU/mL)和多主棒孢霉分生孢子悬浮液混合均匀,取50 μL 滴到凹玻片上,置28℃恒温培养箱里保湿培养,每隔2 h 在显微镜下观察分生孢子萌发情况,每次共观察3 个视野,每个视野大概100 个分生孢子,以无菌水和多主棒孢霉分生孢子悬浮液混合作对照。
孢子萌发率/%= 萌发孢子数/调查孢子总数×100%
孢子萌发抑制效果/%=(对照萌发率-处理萌发率)/对照萌发率×100%
1.2.2 HK11‑9 对黄瓜棒孢叶斑病的防治效果测定
1.2.2.1 HK11‑9 的菌悬液、发酵液和上清液的配制 将HK11‑9 单菌落接种于5 mL 灭菌TSB 培养液中恒温振荡培养(28℃、160 r/min)16 h,然后以0.5%接种量转接至100 mL TSB 培养液中恒温摇床培养(28℃、160 r/min)56 h,得到HK11‑9 的发酵液。将发酵液离心(5 000 r/min、10 min)后用0.22μL 细菌过滤器过滤得到上清液,将离心后沉淀的菌体用无菌水配制获得浓度为108CFU/mL 的菌悬液。
1.2.2.2 多主棒孢霉孢子悬浮液的配制 将多主棒孢霉菌在PDA 培养基上培养10 d 后,加入无菌水刮取孢子,用灭菌纱布过滤,用无菌水稀释配制1×106孢子/mL 的孢子悬浮液。
1.2.2.3 HK11‑9 对黄瓜棒孢叶斑病的防治效果测定 采用离体接种和活体接种方法。将2 片真叶的黄瓜苗移栽至花盆(直径9 cm),用HK11‑9 菌悬液(108CFU/mL)进行叶面喷雾处理,表面晾干后针刺接种5 μL 黄瓜棒孢叶斑病菌孢子悬浮液(106孢子/mL)。以化学药剂和清水作对照,每个处理3 次重复,每个重复10 株。离体接种方法:将处理过的黄瓜叶片取下来,针刺接种黄瓜棒孢叶斑病菌,然后置于25℃恒温箱保湿培养,5 d 后调查棒孢叶斑病发病程度。活体接种方法:处理过的黄瓜叶部针刺接种黄瓜棒孢叶斑病菌,然后置于25-28℃育苗室培育,7 d 后调查棒孢叶斑病发病程度。另外,设HK11‑9 菌悬液、发酵液、上清液处理,以清水作对照,了解HK11‑9 不同发酵组分对黄瓜棒孢叶斑病的防治效果,黄瓜棒孢叶斑病菌的接种采用活体接种方法,每个处理3 次重复,每个重复10 株。黄瓜棒孢叶斑病发病程度调查分级标准依据病斑直径,参考翁祖信等[13]方法并略作修改,分级标准:0 级,无症状;1 级,接种点出现轻微病斑,病斑直径为小于0.2 cm;2 级,病斑直径为0.21-0.5 cm;3 级,接种点黄化明显,病斑直径为0.51-0.8 cm;4 级,病斑直径为大于0.81 cm 以上。
病情指数= Σ(各级病株数×各级代表值)/(调查总株数×最高级代表值)×100
防治效果/%=(对照病情指数-处理病情指数)/对照病情指数×100%
1.2.3 HK11‑9 在黄瓜叶部定殖量测定 选取大小均一的黄瓜苗移栽至花盆,在叶面均匀喷洒HK11‑9(108CFU/mL)菌悬液,晾干后置于25-28℃育苗室培育,培育第1、7、14 和21 天时取黄瓜叶片去掉叶脉,取1 g 叶肉研磨后用无菌水稀释一定浓度涂抹在加利福平(100 μg/mL)的TSA 培养基平板,置于28℃恒温箱内培养48 h,待形成菌落,计算菌落数并换算其在黄瓜叶片的定殖密度。设3 次重复,每个重复15 株,每个处理每次取3 个叶片。
1.2.4 黄瓜叶部防御相关酶活性的测定 选取大小均一的黄瓜苗移栽至花盆,然后在叶面均匀喷洒HK11‑9(108CFU/mL)菌悬液,晾干后叶面喷洒接种黄瓜棒孢叶斑病菌孢子悬浮液(106孢子/mL),置于25-28℃育苗室培育,培育第1、3、5 和7 天时选取第二片真叶,测苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)和过氧化物酶(POD)活性[14]。以清水处理作对照,试验设HK11‑9 菌悬液处理(HK11‑9)、接种黄瓜棒孢叶斑病菌(Cc)、HK11‑9菌悬液处理后接种黄瓜棒孢叶斑病菌(HK11‑9+Cc)和清水处理(CK)共4 个处理,每个处理3 次重复,每个重复15 株。
1.2.5 HK11‑9 的鉴定 HK11‑9 的形态特征及生理生化特性主要参考《常见细菌系统鉴定手册》,按照常规细菌学方法进行鉴定[15]。HK11‑9 的分子鉴定为分析16S rRNA 序列同源性。将HK11‑9 在TSA 培养基上培养48 h,利用试剂盒(北京华越洋生物科技有限公司)提取RNA,采用通用引物27f(5'‑AGAGTTTGATCMTGGCTCAG‑3') 和1492 r(5'‑TACGGHTACCTTACGACTT‑3')进行PCR 扩增,PCR 扩增采用50 μL 反应体系(RNA 1 μL, Primer 27f/1492r(20 pmol)各1 μL,Mix 25 μL,ddH2O 22 μL),PCR 反应条件为94℃预变性5 min;94℃变性1 min、55℃退火1 min、72℃延伸2 min,35 个循环后72℃延伸10 min。将PCR 产物送生物公司测序,测序结果利用NCBI BLAST 进行序列分析,并利用MEGA 7.0 软件构建系统发育树。
1.2.6 HK11‑9 的抑菌谱和生物学功能测定 采用平板对峙法测定HK11‑9 的抑菌谱,采用透明圈法[16]测定HK11‑9 的淀粉分解、纤维素分解、蛋白分解和产嗜铁素能力。
1.2.7 数据处理 采用Microsoft Excel 2016 和DPS软件进行数据分析,以最小显著差法(LSD)进行显著性差异(P<0.05)分析。
2 结果
2.1 HK11‑9对多主棒孢霉的抑菌活性
HK11‑9 对多主棒孢霉菌的菌丝具有抑制活性,在PDK 培养基上形成明显的抑菌带,其抑菌带大小为0.74 cm(图1)。同时,HK11‑9 对多主棒孢霉孢子萌发具有显著的抑制效果,在无菌水中培养2 h时分生孢子已经开始萌发,其萌发率为21.30%,培养6 h 时萌发率达到100%,而HK11‑9 处理的分生孢子培养8 h 都没有萌发,HK11‑9 对多主棒孢霉分生孢子萌发的抑制效果达到100%(图2)。试验结果说明,HK11‑9 菌株对多主棒孢霉的菌丝生长和孢子萌发均具有显著的抑制效果。
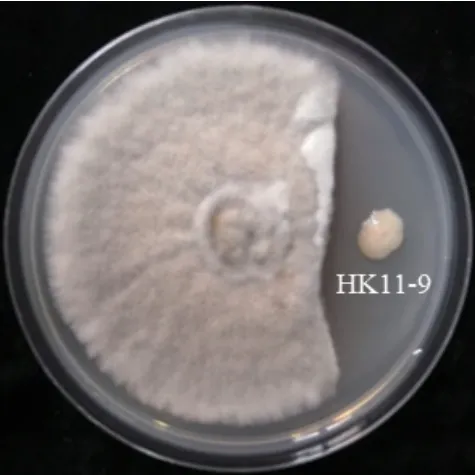
图1 HK11-9 对多主棒孢霉菌丝生长的抑制效果Fig. 1 Inhibition effect of HK11-9 against the mycelium growth of Corynespora cassiicola

图2 HK11-9 对多主棒孢霉分生孢子萌发的抑制效果Fig. 2 Inhibition effect of HK11-9 against the conidia germination of Corynespora cassiicola
2.2 HK11‑9对黄瓜棒孢叶斑病的防治效果
HK11‑9 处理对黄瓜棒孢叶斑具有显著的防治效果。在离体接种和活体接种条件下,HK11‑9 处理对黄瓜棒孢叶斑病的防治效果分别达到62.80%和67.73%,与化学药剂处理的防治效果没有差异(表1,图3)。另外,HK11‑9 的菌悬液和发酵液对黄瓜棒孢叶斑病具有明显的防治效果,其防治效果分别达到66.35%和64.80%,而上清液的防治效果不明显(表2)。说明HK11‑9 对黄瓜棒孢叶斑病的防治效果主要是对其活菌的定殖起效果。

表1 HK11-9 对黄瓜棒孢叶斑病的防治效果Table 1 Control effect of HK11-9 against the Corynespora leaf spot of cucumber

表2 HK11-9 不同发酵组分对黄瓜棒孢叶斑病的防治效果Table 2 Control effects of different components of HK11-9 against Corynespora leaf spot of cucumber

图3 HK11-9 对黄瓜棒孢叶斑病的防治效果Fig. 3 Control effect of HK11-9 against Corynespora leaf spot of cucumber
2.3 HK11‑9在黄瓜叶部的定殖量
HK11‑9 在黄瓜叶部具有稳定的定殖能力。处理第1 天时在叶部的定殖密度为1.13×104CFU/g,之后定殖密度增加,处理第7 天时增加为3.13×104CFU/g,之后定殖密度趋于稳定,处理后第21 天时定殖密度仍能达到2.73×104CFU/g(图4)。结果表明,HK11‑9 在黄瓜叶部保持稳定的定殖量,有利于其发挥作用。

图4 HK11-9 在黄瓜叶部的定殖量Fig. 4 Colonization of HK11-9 on cucumber leaves
2.4 HK11‑9处理对黄瓜叶部防御酶活性的影响
HK11‑9 处理显著影响黄瓜叶部PAL、PPO 和POD 酶活性。HK11‑9、黄瓜棒孢叶斑病菌(Cc)和HK11‑9+Cc 处理对黄瓜叶部PAL 活性的变化趋势一致,处理第1 天时,Cc、HK11‑9 和HK11‑9+Cc 处理均提高黄瓜叶部PAL 活性,其中Cc 处理提高最显著,比对照提高17.92%,而处理第7 天时,Cc 处理的黄瓜叶部PAL 活性降低,而HK11‑9+Cc 处理黄瓜叶部PAL 活性显著提高,比Cc 处理提高62.16%(图5‑A)。Cc 处理降低黄瓜叶部POD 酶活性,处理第1 天时Cc 处理的黄瓜叶部POD 活性比对照降低19.41%,而HK11‑9+Cc 处理的黄瓜叶部POD 活性均显著高于其他处理,处理第1 天时比Cc 处理提高38.76%,第7 天时仍比Cc 处理提高17.55%(图5‑B)。另外,HK11‑9、Cc 和HK11‑9+Cc 处理均影响黄瓜叶部PPO 活性,处理第1 天时,Cc 和HK11‑9+Cc 处理的黄瓜叶部PPO 活性均显著提高,分别比对照提高74.28%和128.11%,然后,Cc 处理的黄瓜叶部PPO 活性趋于下降,而HK11‑9+Cc 处理的黄瓜叶部PPO 活性均保持比较高水平,处理第7 天时,HK11‑9+Cc 处理的黄瓜叶部PPO 活性比Cc 处理提高51.06%(图5‑C)。可见,HK11‑9 处理不同程度提高黄瓜叶部防御酶活性,有利于提高黄瓜对病原菌的抗性。

图5 HK11-9 处理对黄瓜叶部防御酶活性的影响Fig. 5 Effects of HK11-9 treatment on the activities of cucumber leaf defense enzymes
2.5 HK11‑9的鉴定
HK11‑9 在TSA 培养基上产生乳白色、不透明、表面不光滑、边缘不规则的菌落(图6)。HK11‑9的菌体为直杆状、周生鞭毛、革兰氏阳性,在4-50℃范围内均能生长,最高耐盐浓度为4%,可以利用葡萄糖、蔗糖、甘油、麦芽糖、甘露醇,不能利用半乳糖、单宁酸、柠檬酸,亚硝酸盐还原反应、淀粉水解呈阳性,硝酸盐还原反应、硫化氢、明胶液化呈阴性,能进行葡萄糖氧化发酵(表3)。另外,以HK11‑9 总RNA 为模板,PCR 扩增出的16S rRNA 序列全长为1 449 bp,NCBI BLAST 比对结果与多黏类芽孢杆菌16S rRNA 序列同源性达到99%。利用MEGA 软件构建其系统发育树结果,与多黏类芽孢杆菌(Paenibacillus polymyxaHE981775.1)在一个分支,其支持度为99%(图7)。因此,根据其形态特征、生理生化特性和16S rRNA 基因序列同源性分析,将HK11‑9 鉴定为多黏类芽孢杆菌。

表3 HK11-9 的形态特征和生理生化特性Table 3 Morphological characteristics and physiological and biochemical characteristics of HK11-9

图6 HK11-9 菌落形态Fig. 6 Colony morphology of HK11-9

图7 基于16S rRNA 序列构建的HK11-9 系统发育树Fig. 7 Phylogenetic tree of HK11-9 based on 16S rRNA sequence
2.6 HK11‑9的抑菌谱及其生物学功能
除多主棒孢霉以外,HK11‑9 菌株对多种植物病原菌具有抑菌活性,其抑菌带宽度大于0.55 cm(表4,图8)。HK11‑9 菌株还具有分解淀粉、纤维素、蛋白和产嗜铁素的能力(表5,图9)。可见,HK11‑9 具有很好的生防潜力。
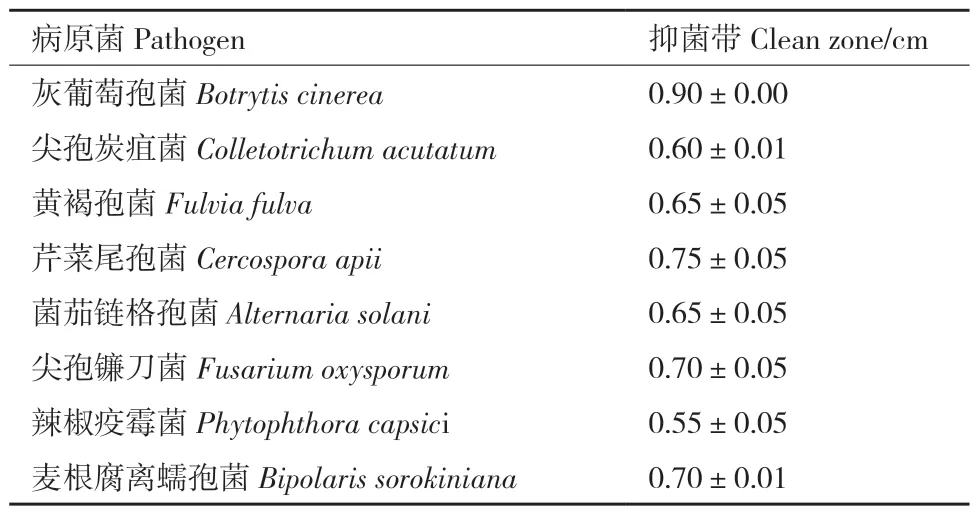
表4 HK11-9 对植物病原菌的抑菌活性Table 4 Antifungal activities of HK11-9 against plant pathogens

表5 HK11-9 的生物学功能Table 5 Biological functions of HK11-9
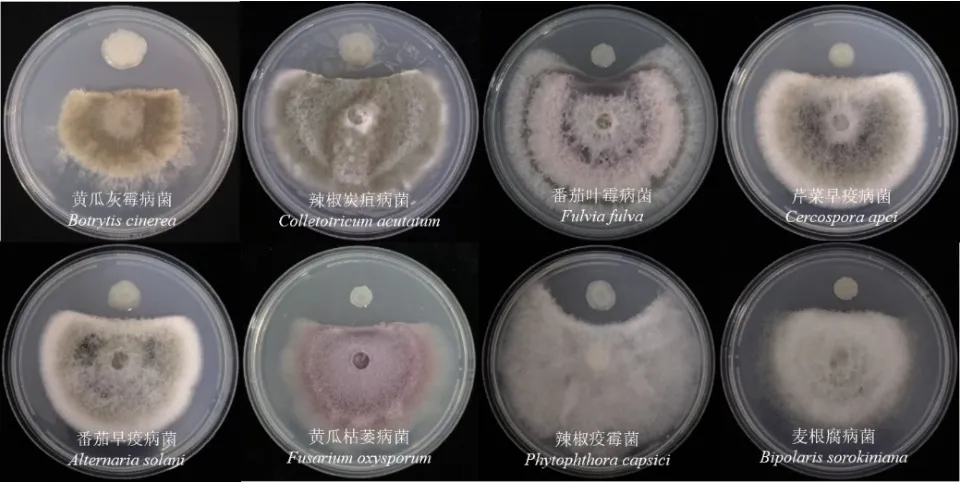
图8 HK11-9 对植物病原菌的抑菌活性Fig. 8 Antifungal activities of HK11-9 against plant pathogens
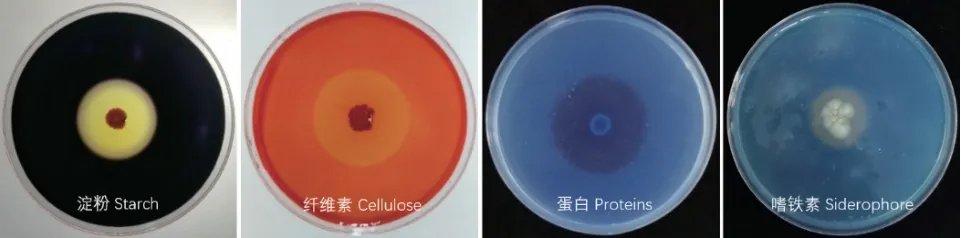
图9 HK11-9 的生物学功能Fig. 9 Biological functions of HK11-9
3 讨论
3.1 HK11‑9对黄瓜棒孢叶斑病的生防潜力
黄瓜棒孢叶斑病在黄瓜整个生育期均能引起发病,主要危害叶片,在黄瓜叶柄和茎秆上也会产生病斑。该病原菌以菌丝体、分生孢子丛或厚垣孢子随病残体在土壤中越冬,存活力较强,主要以种子带菌的方式进行远距离传播,在作物生育期间主要靠分生孢子进行再次侵染和病害的扩散蔓延[17-19]。因此,抑制病原菌的菌丝生长和孢子萌发,能够有效降低病原菌侵染和传播,达到防治病害的效果。张晓云等[8]研究报道,贝莱斯芽孢杆菌HMB28521对多主棒孢霉的抑菌率为83.6%,对黄瓜棒孢叶斑病的防治效果为80.5%;王明刚[20]报道,放线菌XN‑22 对多主棒孢霉的抑菌率为85.9%,对黄瓜棒孢叶斑病的防治效果为67.37%;郭会靖等[21]发现,拮抗菌ZL‑7 对多主棒孢霉的抑菌率为67.1%。本研究结果,HK11‑9 菌株能够抑制多主棒孢霉菌丝生长和孢子萌发,有效防治黄瓜棒孢叶斑病。多黏类芽孢杆菌(Paenibacillus polymyxa)是一类产生内生孢子来抵抗逆境的具有耐高温、耐干旱特性,在植物表面易存活和繁殖的优良生防资源[22]。已报道较多多黏类芽孢杆菌能够防治多种植物病害,如多黏类芽孢杆菌K18‑5 防治黄瓜枯萎病[23];多黏类芽孢杆菌XZ‑2 对大豆疫霉病菌、大豆炭疽病菌和大豆菌核病菌有不同程度的拮抗作用[24];多黏类芽孢杆菌APEC136 对苹果采后炭疽病和白腐病有良好的防治效果[25];多黏类芽孢杆菌DY04 对小麦赤霉病有良好的防治效果和促生效果[26];多黏类芽孢杆菌TC35 对辣椒疫病有较好的防治效果[27]。至今,尚未见到多黏类芽孢杆菌防治黄瓜棒孢叶斑病的报道。本研究鉴定结果HK11‑9 菌株为多黏类芽孢杆菌,能够产生芽孢,对尖孢镰孢菌等多种植物病原菌具有抑菌活性,能够产生嗜铁素、分解纤维素、蛋白和淀粉等作用,显示出良好的生防潜力,为黄瓜棒孢叶斑病生物防治提供了新的生防微生物资源。
3.2 HK11‑9的定殖能力
生防菌的定殖能力是生防菌能否成功控制病害的决定性因素,其定殖受很多因素的影响[28-29]。研究报道,钩状木霉菌(Trichoderma hamatum)在辣椒根际和植株中稳定定殖,并对辣椒疫病具有生物防治作用,防治效果达到53.33%[30]。蜡样芽孢杆菌(Bacillus cereus)SZ5、枯草芽孢杆菌DP10 和CCM9在棉花(Gossypium hirsutumL.)体内的定殖密度与对病害的防治效果有密切相关,在棉苗中定殖一定数量才能对棉花黄萎病产生较高的防治效果[31]。荧光假单胞菌2‑79 在小麦(Triticum aestivumL.)根部不同部位定殖量与小麦全蚀病病斑数成反比,定殖量越多病斑数量越少[32]。枯草芽孢杆菌B47 在番茄植株根和茎中定殖量达到104CFU/g 时,其对番茄青枯病的防治效果能够达到79.79%[33]。本研究中HK11‑9 菌株在黄瓜叶部稳定保持一定的定殖量,另外,HK11‑9 的菌悬液和发酵液对黄瓜棒孢叶斑病具有明显的防治效果,而其上清液对黄瓜棒孢叶斑病的防治效果不明显,推测HK11‑9 发挥其对黄瓜棒孢叶斑病的防治效果与其定殖能力有密切相关,其具体相关性有待于进一步探讨。
3.3 HK11‑9对防御酶活性的影响
大量研究表明,苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)与植物抗病过程有密切相关,是植物抗病的重要指标。PAL 是酚类物质、植保素和木质素合成的关键酶,通过苯丙烷代谢途径能够促进水杨酸、木质素和植保素及类物质的产生。PAL 活性增加能够导致水杨酸、木质素和植保素等在植物内的含量提高,进而增强抗病性。POD 是植物体内一种关键的氧化酶,是防御酶系中的重要一员,可以将酚类物质转化成木质素、植保素等,从而提高植物抗病性。PPO 广泛存在于植物中,可促进酚类物质氧化,将酚类物质氧化成对病原菌有毒的醌类物质,杀死病原菌[34]。已有较多报道,生防菌的处理能够诱导植物防御酶活性的提高,进而提高植物对病原菌的抗性,如解淀粉芽孢杆菌HRH317 能诱导玉米植株体内防御酶活性的表达而增强其系统抗性[35];芽孢杆菌Ya‑1 处理后辣椒叶片PAL、POD 和SOD 活性显著升高,从而增强植物抗辣椒枯萎病的能力[36];贝莱斯芽孢杆菌HM3‑3 可诱导植物体内POD、PPO、SOD、CAT 活性提高,抵御致病菌对植株的侵害[37];荧光假单胞菌S149 可提高寄主抗病相关防御酶活性,进而增加寄主抗病性[38]。本研究结果,经HK11‑9 处理后接种棒孢叶斑病菌,提高黄瓜叶部PAL、POD 和PPO活性,可能是因为HK11‑9 处理激发了植物体内的抗性反应,提高了黄瓜叶部防御酶活性,进而减轻黄瓜叶部棒孢叶斑病的发病程度,其具体的相关性有待于进一步研究。HK11‑9 菌株是具有较大潜力的多功能生防细菌,其具体的防病机制及实际应用推广有待进一步的探索和研究。
4 结论
从金鸡菊植物根际土壤分离筛选获得拮抗细菌HK11‑9 对黄瓜棒孢叶斑病具有良好的防治效果,其离体和活体防效分别能达到62.80%和67.73%,且在叶部有稳定的定殖能力,能提高黄瓜叶部防御酶的活性。HK11‑9 经鉴定为多黏类芽孢杆菌,具有分解淀粉、纤维素、蛋白和产嗜铁素的能力,且其抑菌谱较广,因而表明菌株 HK11‑9 在黄瓜棒孢叶斑病生物防治方面具有一定的开发和应用价值。