芍药苷转化酶G6046 的异源表达及酶活鉴定
韩潆仪 李章涵 曹学丽 裴海闰
(北京食品营养与人类健康高精尖创新中心 北京工商大学轻工科学技术学院,北京 100048)
芍药(Paeonia lactifloraPall)在中药中被广泛使用,历史悠久,安全性好[1]。“逍遥丸”和“逍遥散”是典型的含有芍药的中草药制剂,是治疗抑郁症类疾病的处方药[2-3]。芍药的干根具有减轻疼痛、补血和调理月经的药理活性[4]。芍药苷是一种植物源水溶性单萜类糖苷,是芍药的重要成分之一,对心脑血管系统尤其是在糖尿病相关的大血管并发症方面有保护作用[5-6]。此外,研究表明,芍药苷通过抑制小鼠海马小胶质细胞,激活神经元FGF‑2/FGFR1 信号,实现神经保护和抗抑郁作用[7]。因此,芍药苷有可能是治疗帕金森、阿尔茨海默病[8-10]、抗凋亡[11]、抗炎[12]、抗氧化[13]和抗抑郁活性[7,14-15]的重要候选药物。
生物利用度低是许多具有药理作用的天然化合物的共同限制[16]。芍药苷主要从芍药中提取,口服给药后,直接吸收的很少,生物利用度较低[17]。芍药苷静脉给药后主要以原型从肾脏排泄,离体肝灌流结果显示它几乎不能被代谢[18]。芍药苷在血浆中的动力学参数也表明,它很少能在肺、肝和肠壁中转化和吸收[19]。有研究表明,芍药苷主要由肠道菌群代谢,其药理作用可能通过芍药苷代谢物产生[20]。然而,由于芍药苷的生物利用度低和药理机制未被揭示,导致其临床适用性受到很大限制[18,21]。最近有研究显示,肠道微生物酶的降解可能是芍药苷生物利用度低的主要原因之一[14]。此外,关于芍药苷及其他活性成分在大鼠胃肠道菌群中的吸收和转化的研究表明,芍药苷在大鼠盲肠和结肠中24 h 内被完全转化[22]。这些结果证实了肠道菌群会代谢芍药苷,并且芍药苷可能对肠道微生物菌群同样有调节作用,从而有助于缓解抑郁症[14]。因此,研究芍药苷的代谢产物及其肠道细菌的代谢作用对深入了解其药理机制具有重要意义。
一些微生物酶具有相对的底物特异性。它们通常催化某一个特定的化学键类型或是具有立体结构特异性的反应。由于微生物代谢产物与哺乳动物代谢产物的相似性,微生物转化已被用作研究某些药物或天然产物在哺乳动物体内代谢的有效辅助方法[23-24]。有研究表明,微生物可以转化芍药苷,如短刺小克银汉霉(Cunningham blakesleeana)(AS 3.970)[25-26],但至今没有详细的机制报道。
本课题组前期通过蛋白质质谱和转录组学分析鉴定,在短刺小克银汉霉中确定了一个芍药苷转化酶G6046(paeoniflorin converting enzyme, GenBank:OP856858.1),此酶可以将芍药苷转化为其他代谢产物,相关研究成果已发表[27]。使用软件PSIPRED 4.0[28]和Phyre2[29]预测了G6046 的跨膜区、信号肽、二级结构及三级结构,分析预测模型结果发现,N 端第42-57 个氨基酸的区域为跨膜蛋白区。因此,前期研究还对基因N 端1-246 bp 碱基序列进行截断,命名为G6046‑NΔ82,再将目的基因G6046‑NΔ82 和载体pET‑22b 进行连接,成功构建了G6046‑NΔ82‑22b[27]。为了验证此载体表达出的G6046 截断是否具有芍药苷的转化活性,本研究在大肠杆菌(Escherichia coli)中表达、纯化了G6046 蛋白的NΔ82 截断,并在体外对其酶活性进行了评估。结果证实G6046 蛋白确实可以将芍药苷转化为多种代谢产物,且经过纯化及条件优化后,可以大大提高了芍药苷的转化效率。这可能为研究芍药苷的微生物代谢提供了一条线索。
1 材料与方法
1.1 材料
1.1.1 试剂与材料 氨苄青霉素(Amp)、异丙基-β-D‑硫代半乳糖苷(IPTG)、苯甲磺酰氟(PMSF)、5×蛋白上样缓冲液和Tris:北京索莱宝科技有限公司;咪唑:赛默飞世尔科技有限公司;甘油、乙酸乙酯、正丁醇、乙醇和甲醇(分析纯),上海麦克林生化科技有限公司;NaCl、HCl 和NaOH(分析纯):中国医药集团有限公司;甲醇(色谱纯),美国Fisher Scientific 公司;芍药苷标准品:上海源晔生物科技有限公司;Ni‑NTA 镍柱:美国GE Healthcare 公司;Bradford:天根生化科技有限公司;胰蛋白胨和酵母提取物:英国 OXOID 公司。
1.1.2 菌株与培养基 大肠杆菌BL21(DE3)感受态细胞:北京全式金生物技术有限公司;G6046‑NΔ82‑22b 重组质粒为本实验室前期构建[27]。LB 液体培养基(g/L):胰蛋白胨10、NaCl 10、酵母提取物5;LB 固体培养基(g/L): 胰蛋白胨10、NaCl 10、酵母提取物5、琼脂15;Amp 抗性液体LB 培养基(g/L):胰蛋白胨10、NaCl 10、酵母提取物5、100 mg/L Amp。Amp 抗性固体LB 培养基(g/L):胰蛋白胨10、NaCl 10、酵母提取物5、琼脂15、100 mg/L Amp。
1.1.3 仪器与设备 电子分析天平:美国Denver 公司;高效液相色谱仪(HPLC):Agilent 1260,美国Agilent 科技有限公司;恒温金属浴和恒温磁力搅拌器:英国OXOID 公司;小型台式离心机:北京索莱宝科技有限公司;高速冷冻离心机、恒温振荡培养箱和微量核酸蛋白检测仪:Thermo Scientific 公司;高压蒸汽灭菌锅:日本松下公司;超净工作台:北京化工厂;超声波细胞破碎仪:上海沪析实业有限公司;超速离心机:日本日立公司。
1.2 方法
1.2.1 重组载体G6046‑NΔ82‑22b 在大肠杆菌中的诱导表达 将已经构建成功的G6046‑NΔ82‑22b 重组质粒转入大肠杆菌BL21(DE3)中,诱导表达G6046目的蛋白。首先将冻存的大肠杆菌感受态细胞BL21(DE3)(100 μL)在冰上融化5-10 min 后,加入重组质粒(1 μL),于冰上放置30 min。将混合液于42℃水浴中热激60 s,随后立即在冰上冷激2 min。向冷激后的混合液中加入LB 液体培养基900 μL 后,放置于37℃,150 r/min 振荡培养45 min,离心2 min(1 000 ×g),弃上清(管内剩余大约100 μL LB 液体培养基)。振荡混合均后将混合液均匀涂布在Amp抗性的LB 固体培养基上。37℃培养过夜后,挑取一个单克隆菌落,接种至100 mL LB 液体培养基(100 μg/mL Amp),37℃,180 r/min,培养12 h 作为种子液。向1 L 的LB 液体培养基中接种种子液30-50 mL,37℃,160 r/min 培养至OD600=0.8 时,加入IPTG 使终浓度为0.5 mmol/L 进行诱导表达。继续在一定温度(37℃、20℃、16℃)条件下分别培养4 h、12 h或者20 h,离心(4℃,8 000 r/min,15 min),弃上清,收集菌体并储存于‑40℃以备进一步使用。
1.2.2 芍药苷转化酶G6046 的提取 将5 g 菌体重悬于50 mL 裂解缓冲液(50 mmol/L Tris,pH 8.5,300 mmol/L NaCl,10%甘油),加入500 μL PMSF(0.01 mol/L)。将涡旋均匀的菌悬液置于冰上,超声破碎45 min(超声3 s,停9 s,功率120 W),超声后的菌液于4℃,16 000 r/min 离心1 h。分别收集上清和沉淀,取少许沉淀于1.5 mL 离心管中,溶于30 μL裂解缓冲液(图1‑A 中P),4℃留存备用。取30 μL上清(图1‑A 中S),4℃留存备用。
1.2.3 芍药苷转化酶G6046 的纯化 Ni‑NTA 柱冲洗平衡后将上一步中收集的蛋白上清液于4℃层析柜中流经Ni‑NTA 柱,收集30 μL 流出液(Ft),4℃留存备用。使用2 倍柱体积的裂解缓冲液冲洗Ni‑NTA 柱,收集30 μL 流出液(W1),4℃留存备用。使用2 倍柱体积的20 mmol/L 咪唑溶液冲洗Ni‑NTA柱,收集30 μL 流出液(W2),4℃留存备用。使用50 mL 浓度为200 mmol/L 咪唑溶液洗脱目的蛋白,收集洗脱液,取30 μL(E),4℃留存备用。蛋白纯化完成后,使用3 倍柱体积的去离子水冲洗Ni‑NTA柱,冲洗后将Ni‑NTA 柱保存于20%乙醇中,存放于4℃层析实验冷柜备用。用Bradford 法测定洗脱的G6046 蛋白的浓度,用SDS‑PAGE 评估目标蛋白的纯度。
1.2.4 芍药苷转化反应 将纯化后的G6046 芍药苷转化酶转入超滤管中,经高速冷冻离心机(3 000r/min,4℃)超滤浓缩,再加入裂解缓冲液继续超滤,此步骤重复3 次以去除咪唑,最后浓缩至1 mL。使用微量核酸蛋白检测仪检测蛋白浓度,计算蛋白含量。用裂解缓冲液稀释至原体积(相当于原浓度蛋白溶液),按酶∶芍药苷=1∶1(mg/mg)的比例添加芍药苷,即为芍药苷反应液。置于室温下反应,第0、24、48、72、96 小时分别取50 μL 反应液,按反应液∶甲醇 = 1∶6 的比例加入甲醇(色谱级),使酶失活。待蛋白沉淀后离心,尽可能完全去除沉淀,吸取上清液过0.22 μm 滤膜,进行HPLC 检测。
1.2.5 生物转化活性的HPLC 分析 向2 mL 离心管中加入1 mL 裂解缓冲液(pH 8.5),1 mg 芍药苷,待溶解后加入浓度为1 mg/mL 的纯G6046 蛋白溶液,每24 h 取反应液50 μL 检测,连续监测反应96 h。使用Agilent ZORBAX SB‑C18 色谱柱(150 mm×4.6mm, 5 μm)进行HPLC 分析以检测芍药苷和转化产物的浓度。HPLC 流动相为甲醇(A)和0.2%磷酸水(B)(A∶B = 30∶70);检测波长为230 nm;流速为1 mL/min;洗脱时间为15 min;柱温30℃;进样量10 μL。G6046 比酶活被定义为在25℃条件下,每1 h 转化1 μmol 芍药苷所需酶量。
1.2.6 pH 的优化 调节裂解缓冲液至不同pH(7.0、8.0、9.0、10.0),取40 μL G6046 酶液(1 mg/mL),加入960 μL 不同pH 的裂解缓冲液,25℃下预保温30 min 后分别加入1 mg 芍药苷底物,经HPLC 检测反应初始芍药苷含量后立即放入25℃金属浴中进行反应。于1 h、2 h、3 h 取样50 μL,按反应液∶甲醇 = 1∶6 的比例加入甲醇(色谱级)。待蛋白沉淀后离心,去除沉淀,吸取上清液过滤膜(0.22 μm),通过HPLC 检测芍药苷反应量,检测方法同1.2.5。
1.2.7 反应温度的优化 优化反应pH 后,选取芍药苷转化酶G6046 反应最适pH,在经Ni‑NTA 柱纯化后的目的蛋白在超滤浓缩后使用最适pH 裂解缓冲液稀释至原体积,取6 个离心管,分别加入1 mL酶液,保存于15℃、25℃、35℃、45℃、55℃和65℃金属浴30 min 后每管中加入1 mg 芍药苷,利用HPLC 检测反应初始芍药苷含量。检测后立即保存在相应温度的金属浴中进行反应,每1 h 测定芍药苷的含量。按反应液∶甲醇 = 1∶6 的比例加入甲醇(色谱级)。待蛋白沉淀后离心,去除沉淀,吸取上清液过滤膜(0.22 μm),通过HPLC 检测第0、1、2、3、10、16、24 小时的芍药苷反应量,检测方法同1.2.5。
2 结果
2.1 重组大肠杆菌诱导表达条件的优化
由图1‑A 可知,G6046‑NΔ82‑22b 蛋白部分为包涵体形式存在于沉淀中,但也有部分蛋白在上清中表达。不同诱导条件下的蛋白含量结果如图1‑B,16℃,诱导24 h 产酶量最高,达到5.34 mg/g。因此在后续优化转化反应实验时均选用此条件诱导目的蛋白的表达。
2.2 不同反应条件对芍药苷转化酶G6046活性的影响
2.2.1 pH 对芍药苷转化酶G6046 活性的影响 在不同pH(7.0、8.0、9.0、10.0)条件下芍药苷转化酶G6046 的pH‑酶活曲线如图2 所示。在pH 9.0 时,第1 小时转化量为0.246 mg(2.35%),到第3 小时芍药苷转化量为1.327 mg(12.67%),芍药苷转化率最高,如图2 所示。由此可以计算得知,在25℃,pH 9.0 条件下G6046 比酶活为4.22 U/mg。因此,芍药苷转化酶G6046 反应最适pH 为9.0。
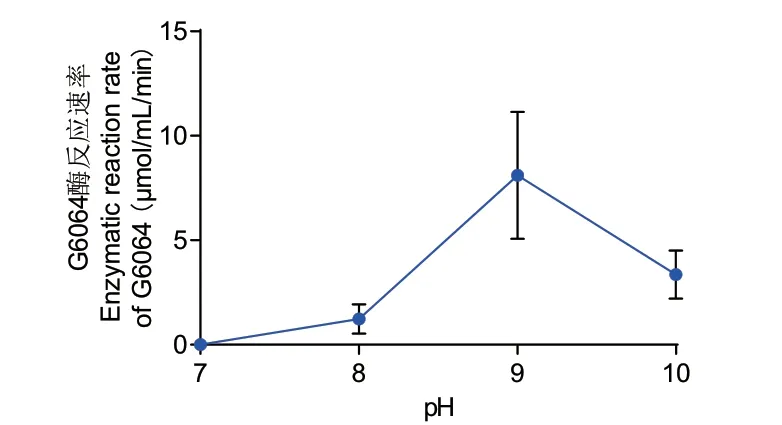
图2 芍药苷转化酶G6046 的pH-酶活曲线Fig. 2 pH-enzyme activity curve of paeoniflorin converting enzyme G6046
2.2.2 温度对芍药苷转化酶G6046 活性的影响 由于芍药苷转化酶G6046 反应最适pH 为9.0,因此选用pH 9.0 的裂解缓冲液为反应环境来优化反应温度。扣除空白对照后得到不同温度-酶反应速度曲线如图3 所示,由结果可知,酶反应曲线在约3 h 内保持线性关系,随着时间的延长,曲线趋于平缓,反应速率逐渐降低。
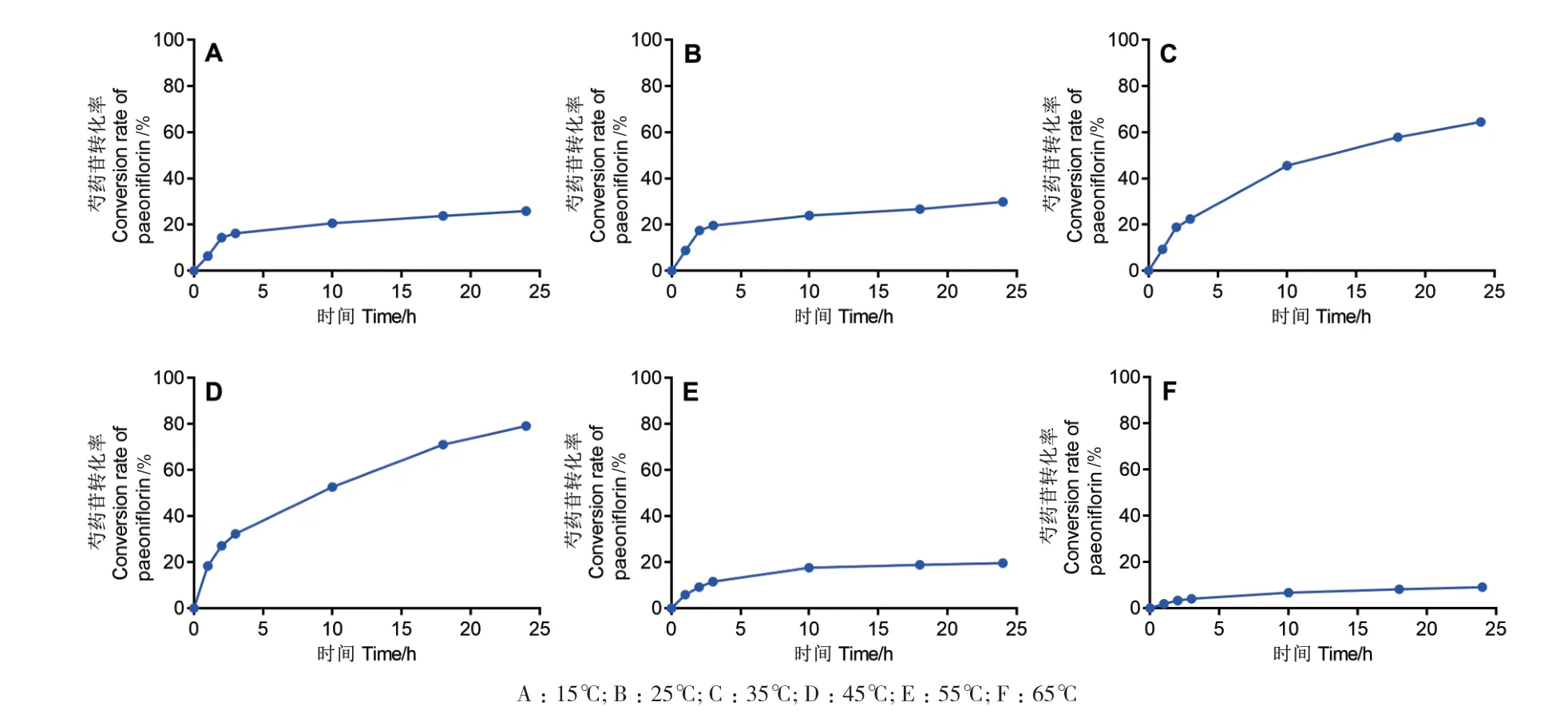
图3 芍药苷转化酶G6046 在pH 9.0,不同温度条件下酶反应曲线Fig. 3 Enzyme reaction curves of paeoniflorin converting enzyme G6046 at pH 9.0 and different temperatures
取前3 h 呈线性关系的部分绘制pH 9.0 条件下不同温度G6046 反应模型(图4‑A)。由图可知,在45℃条件下,前3 h 酶反应曲线斜率最高,酶活最强,酶反应线性关系为y=10.57x。取各温度下前3 h 呈线性关系部分绘制温度-酶活曲线图(图4‑B)。由图可知,在pH 为9.0,温度为45℃时,芍药苷转化率最高,第1小时芍药苷转化量为1.107 mg(10.57%),第3 小时芍药苷转化量为3.320 mg(31.71%),由此可以计算得知,在45℃,pH 9.0 条件下G6046 比酶活为14.56 U/mg。因此,芍药苷转化酶G6046 反应最适pH 为9.0;最适温度为45℃。后续实验中G6046 转化芍药苷条件选用pH 9.0,温度45℃。
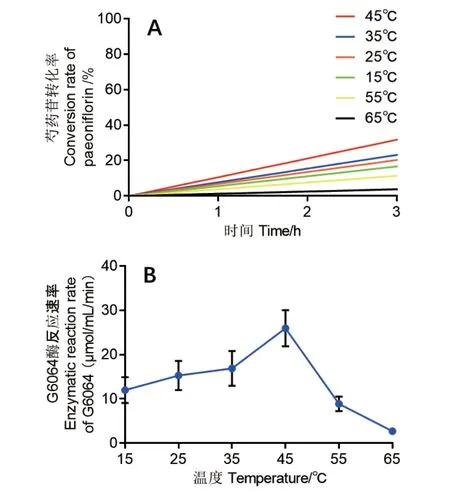
图4 G6046 在不同温度下反应曲线Fig. 4 G6046 reaction curves at different temperatures
2.3 芍药苷转化反应结果
芍药苷标准品液相色谱图(图5‑A)中芍药苷出峰时间为6.747 min;芍药苷转化酶G6046 与芍药苷在原反应条件(pH 8.0;25℃;酶-芍药苷 = 1∶10,mg/mg)下反应96 h 的液相色谱图(图5‑B)中芍药苷出峰时间为6.762 min。如图5‑B 结果显示,芍药苷的峰面积随着反应时间的延长而逐渐降低,并随之产生3 种新的物质,且这3 种新物质峰面积随时间的延长而增加,出峰时间分别为2.963 min、4.247 min、10.684 min。由此可以说明G6046 可以将芍药苷转化为3 种新的物质,这3 种物质在后续的研究中已经得到了鉴定[27]。
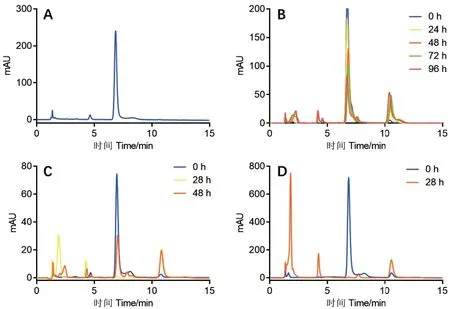
图5 芍药苷和不同条件下芍药苷转化反应后的HPLC 色谱图Fig. 5 HPLC analysis of paeoniflorin and paeoniflorin after conversion reaction under different conditions
前2.2.1 得出最佳反应pH 为9.0,在此pH 条件下,25℃,加入芍药苷(酶-芍药苷 = 1∶10,mg/mg)连续反应48 h,结果如图5‑C 所示。由图可知,随着反应时间的延长,芍药苷的含量明显的减少,3种反应产物随之明显增多。与芍药苷标准品(图5‑A)对比发现,在反应48 h 后,反应液中的芍药苷几乎被反应完全。对比原反应条件(图5‑B),转化反应速度得到了明显的提高。
在2.2.2 中得到最适pH 和温度条件下(pH 9.0;45℃),按酶-芍药苷(1∶10,mg/mg)的比例加入芍药苷进行反应。反应开始的0 h 与反应进行到28 h 时得到HPLC 结果如图5‑D 所示。与芍药苷标准品(图5‑A)对比可以看出,芍药苷的含量明显的减少,3 种产物含量明显增加。并且在反应28 h 后,反应液中的芍药苷已经反应完全。对比原反应条件(图5‑B)和仅优化pH 的反应条件(图5‑C),转化反应速度得到进一步提高。
在最适pH 和温度条件下(pH 9.0;45℃)扩大酶与芍药苷的比例,由最初的酶-芍药苷(1∶10,mg/mg)扩大到酶-芍药苷(1∶20,mg/mg),反应36 h,取50 μL 反应液处理后(处理方法同1.2.5)得到HPLC 色谱图(图6)。由图6 可知,在反应36 h 后反应液中的芍药苷已经反应完全,且仍可以生成同样的3 种主要产物。证明在优化后的反应条件下,可以将G6046 与芍药苷的比例扩大到1∶20(mg/mg),适当延长反应时间仍可以反应完全。因此本研究后续选用pH 9.0,45℃,G6046‑芍药苷(1∶20,mg/mg)进行反应,以期能够获得更多的反应产物,以进行下一步的产物纯化及鉴定。反应体系逐步扩大如图7 所示。
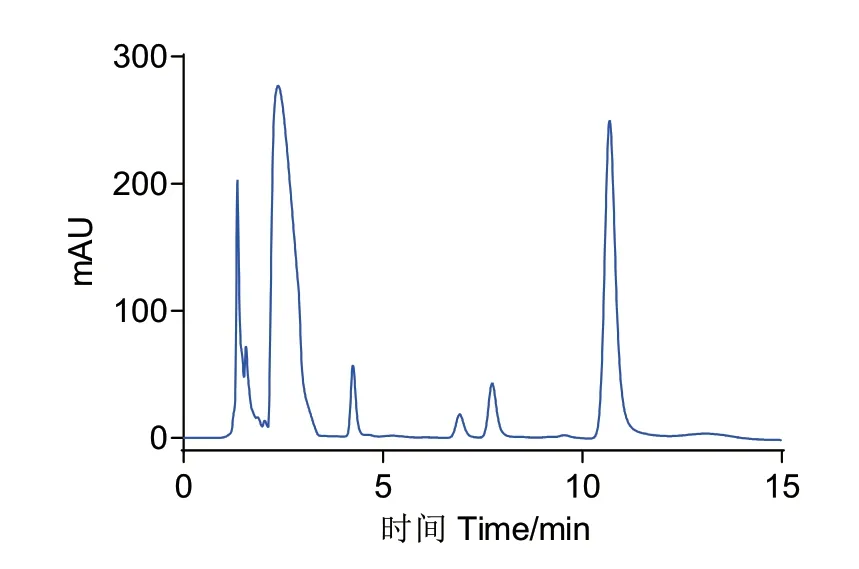
图6 G6046 转化芍药苷36 h 后HPLC 检测图Fig. 6 HPLC analysis of 36 h conversion of paeoniflorin by G6046
图7 G6046-芍药苷反应体系逐步放大示意图Fig. 7 Schematic of G6046-paeoniflorin reaction system by step-by-step amplification
3 讨论
本研究在确定了短刺小克银汉霉中一个芍药苷转化酶G6046 的基础上,对该酶基因中选定的功能片段进行截取,再将目的基因G6046‑NΔ82 和载体pET‑22b 进行连接,成功构建了G6046‑NΔ82‑22b。为了进一步探究G6046 截断是否具有芍药苷的转化活性以及对其酶活力的评估,必须选用合适的宿主来完成构建载体的表达和纯化。
3.1 芍药苷转化酶G6046的表达纯化
大肠杆菌E. coli因为其遗传背景清楚、培养成本低、生长迅速等特点,成为如今最常用的外源重组蛋白表达的宿主[30-32]。而影响大肠杆菌表达系统产率的主要因素有表达载体的选择和合适表达蛋白质的菌种的选择。适用于蛋白质表达的载体种类繁多,应用最多的是pET 系列,能在大肠杆菌中高效且高产表达蛋白,在诱导表达几小时后,目标蛋白产量可占总蛋白的50%以上。根据所使用表达载体的特点,目标基因密码子的组成等因素选择特定的表达宿主菌,而BL‑21 菌种缺乏内生性蛋白酶ompT、ompP 和Lon protease,因此能防止产出的目标蛋白质被降解。本研究选用大肠杆菌作为宿主进行诱导表达,利用pET 系列的载体,可以将外源目的基因克隆到载体中,转入大肠杆菌BL21(DE3)中,可以获得纯度较高、具有一定产量的并且带有6 个His 标签的蛋白,便于后续的纯化[33-34]。通过前期的研究发现,重组的芍药苷转化酶诱导后以包涵体的形式表达,因此进行了一系列的截断设计[27],发现G6046‑NΔ82‑22b 可以表达一部分蛋白在上清液中。为了提高诱导表达的效率,本研究在不同诱导条件(诱导温度和诱导时间)下诱导目的蛋白折叠表达,结果可知,在温度降低,时间延长后,每克菌体产酶量呈递增趋势,在16℃,诱导24 h 条件下产酶量最高,达到5.34 mg/g。这是因为较高温度下,虽然细菌的生长速率较高,同时也会导致代谢产物积累,从而抑制细菌生长和目的蛋白的表达。此外,低温条件下,虽然不利于大肠杆菌的生长,但是可以使蛋白的合成速率降低,在更温和的条件下形成正确的折叠,促进蛋白的可溶性表达,更有利于蛋白溶解在上清中。因此选用16℃,诱导24 h 来诱导目的蛋白的表达。
3.2 芍药苷转化酶G6046的最适酶活条件
酶特异性催化化学反应的能力称为该酶的酶活力,可以用在一定条件下,酶所催化其特异性化学反应的速度来表示。因此,通常用单位时间内底物的减少量或单一产物的增加量来表示酶反应速度。酶催化反应中,pH、温度、离子强度、抑制剂、激活剂或酶本身的部分失活等都会对催化反应造成影响。本研究克隆表达的是芍药苷转化酶的截断,在N 端截去了82 个氨基酸,因此首先考察截断后表达出的酶是否具有活性,结果可知,芍药苷的含量随着反应时间的延长而逐渐降低,并伴随3 种新产物的生成,且新生成产物的含量随时间的延长而增加,由此可以说明构建的G6046 具有酶活性,可以将芍药苷转化为新的物质。在这些影响酶活的因素中,pH 和温度是对催化反应影响较大的两个因素[35-36],因此在优化G6046 催化芍药苷转化反应中着重研究反应液pH 和温度对催化反应速度的影响,主要从pH 和温度两个方面进行优化。在分别尝试pH 7.0、8.0、9.0、10.0 后发现,G6046 在pH 9.0 的条件下酶活性最高,比酶活为4.22 U/mg。且优化pH 后,芍药苷转化反应可以在48 h 后基本反应完全,对比原条件(图5‑B,pH 8.0;25℃;96 h)可以看出,底物利用率得到了有效的提高,并且反应速度得到了明显提升。优化反应液pH 后,进而优化了反应温度。挑选出6 组不同温度,相同pH(9.0)进行对比试验,在15℃、25℃、35℃、45℃、55℃、65℃的不同条件下,45℃时反应最快,酶活性最高,比酶活为14.56 U/mg。对比原反应条件和优化pH 后的反应结果,优化pH 和温度后,在28 h 后芍药苷可以反应完全,酶反应速度得到了进一步提高。
当前,我国中草药资源面临日益紧缺的现状,同时也面对药材生物利用率低、浪费严重等问题。不仅限制了其临床应用,更是影响着我国中药产业的可持续发展。本课题通过研究短刺小克银汉霉中可以转化芍药苷的G6046 蛋白,将G6046 相关基因克隆并进行外源蛋白的诱导表达、优化酶催化反应条件以及扩大酶反应体系等,证实了G6046 蛋白确实可以将芍药苷转化为多种代谢产物,大大提高了芍药苷的转化效率,可能会提高芍药苷的生物利用率;反应体系的扩大也为进一步鉴定产物结构和构效关系研究提供了基础。本研究可能为研究芍药苷的微生物代谢提供了一条线索,为改善中草药的生物利用度提供了新策略。
4 结论
本研究通过对重组载体G6046‑NΔ82‑22b 在大肠杆菌BL21(DE3)中的转化和诱导表达实现了芍药苷转化酶G6046 的表达和纯化。通过优化该转化酶的酶促反应的条件,发现pH 9.0,45℃条件下,酶活性最高,比酶活为14.56 U/mg,且底物可以反应完全。通过扩大酶反应体系,将反应规模从G6046‑底物(1∶1;mg/mg)扩大到G6046‑底物(1∶20;mg/mg),使得转化产物产量得到显著提升,为分离芍药苷转化产物,进一步研究转化产物结构及芍药苷在体内的代谢机制奠定了基础。