菠菜PSY 基因家族的鉴定与表达分析
任丽 乔舒婷 葛晨辉 魏梓桐 徐晨曦
(1. 上海师范大学生命科学学院,上海 200234;2. 上海师范大学植物种质资源开发协同创新中心,上海 200234)
类胡萝卜素(carotenoids)是一类重要的天然色素的总称,由所有光合生物(包括植物、细菌、藻类)和一些非光合细菌、真菌合成[1-2],是天然产物中最大的家族之一,迄今已分类出850 多种不同的化合物[3]。植物中,类胡萝卜素存在于各种类型的质体内,可使植物的花、果实或根部呈现出鲜艳的色彩[4]。在叶绿体富集的组织中,类胡萝卜素可以作为光合作用的辅助色素,扩大光吸收范围,并能通过能量淬灭和自由基排除来使植物细胞免受光氧化和热应激的损伤[5-7],对植物的生长和发育具有调节作用。此外,类胡萝卜素还为植物重要激素脱落酸(ABA)和独脚金内酯(SL)的生物合成提供前体[8-9]。对人体健康来说,类胡萝卜素及其分解代谢产物是人类饮食中不可或缺的组成部分,可在人体内转化为人体所必需的维生素A,有助于降低与衰老相关的疾病风险[10]。但是人类自身无法合成类胡萝卜素,需要通过食物摄取和转化来获得[11]。常见的膳食类胡萝卜素有α-胡萝卜素、β-胡萝卜素、β-隐黄质、叶黄素、番茄红素和玉米黄质等。菠菜和羽衣甘蓝(Brassica oleraceaL. var.acephalaD.C.)等深绿色叶菜类蔬菜的叶黄素和玉米黄质含量最高,每克预制食品可含有75-150 μg[12]。
菠菜(Spinacia oleraceaL.)是苋科藜亚科菠菜属一年生草本植物,是世界重要的绿叶菜类蔬菜作物之一,主要种植于中国、美国、土耳其和日本,其中中国产量占世界的91%。菠菜营养丰富,味道鲜美,是绿叶菜中类胡萝卜素含量最高的蔬菜[13]。不同菠菜种质资源间,类胡萝卜素含量存在显著差异[14]。
类胡萝卜素几乎在所有的质体中都是从头合成的,在植物细胞的叶绿体和有色体中含量丰富[4]。植物中,类胡萝卜素的酶促反应发生在质体膜上,并由核编码酶介导[15]。该合成途径首先是由异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)在牻牛儿基牻牛儿基焦磷酸合酶(GGPPS)催化下缩合形成牻牛儿基牻牛儿基焦磷酸(GGPP)[16]。GGPP 在八氢番茄红素合酶(PSY)的催化下生成无色的15‑顺式八氢番茄红素,这一步骤是类胡萝卜素生物合成的主要限速步骤[17]。15‑顺式八氢番茄红素进而在八氢番茄红素脱氢酶(PDS)、ζ-胡萝卜素异构酶(Z‑ISO)、ζ-胡萝卜素脱氢酶(ZDS)和类胡萝卜素异构酶(CRTISO)的连续修饰下形成全反式番茄红素,接着全反式番茄红素通过1 个或2 个环化酶催化为β-胡萝卜素或α-胡萝卜素[18]。随后在羟化酶和环氧酶的羟基化和环氧化作用下产生叶黄素和玉米黄质[19]。而玉米黄质在玉米黄质环氧化酶(ZEP)催化下生成了紫黄质[20]。
PSY 是一类小家族基因,除了在部分藻类(绿藻和微胞藻)中存在PSY I 和PSY II 两个家族外,其他藻类和高等植物中仅保留了PSY I 家族[21]。大多数植物中含有2-3 个旁系同源基因,但模式植物拟南芥(Arabidopsis thalianaL.)[22]中只有1 个PSY基因,水稻(Oryza sativaL.)[23]、玉米(Zea maysL.)[24]、番茄(Solanum LycopersicumL.)[25]和小麦(Triticum aestivumL.)[26]中均含有3 个PSY 基因,而菠菜中共鉴定出4 个PSY 基因。尽管已经对很多植物的PSY 基因进行了相关研究,但菠菜PSY 基因研究却少有报道,本研究为后续对菠菜PSY 基因功能特性的深入研究奠定基础。
1 材料与方法
1.1 材料
本试验所用菠菜‘KS4’‘US362’均为上海师范大学植物种质资源开发中心保存的自交系材料,其中‘KS4’为类胡萝卜素高积累型栽培种材料,‘US362’为类胡萝卜素低积累型野生种材料。菠菜种子经过浸种1 d 后,播于72 孔育苗穴盘中,培养基质为草炭土与珍珠岩等比例混合。置于人工气候室培养,光照9 h,黑暗15 h,温度约为20℃,湿度约为70%。播种后30 d 将菠菜幼苗移栽入塑料花盆中,六叶一心期时进行不同处理。
1.2 方法
1.2.1 菠菜PSY 基因家族的鉴定 从拟南芥(Arabidopsis thaliana)、 甜菜(Beta vulgaris) 和烟草(Nicotiana tabacum)基因组数据库中获得该物种类胡萝卜素合成代谢相关基因的序列,在菠菜(Spinacia olerace)基因组数据库(http://www.spinachbase.org/)中进行全基因组 BLAST 分析得到菠菜类胡萝卜素合成代谢相关蛋白的同源基因序列。结 合SMART(http://smart.embl heidelberg.de/) 和PROSITE(https://prosite.expasy.org/)的保守结构域基序分析,从菠菜基因组中鉴定获得菠菜PSY 候选基因。利用ProtParam 在线软件(https://web.expasy.org/protparam/)估算菠菜PSY 蛋白序列的分子量(Mw)、理论等电点(pI)、GRAVY 和不稳定性指数。通过Wolfpsort 在线工具(https://wolfpsort.hgc.jp/)进行PSY 蛋白的亚细胞定位预测。
1.2.2 菠菜PSY 基因保守结构域、保守基序及基因结构分析 依据菠菜数据库SpinachBase(http://www.spinachbase.org/)中的基因组序列和注释信息,通过GSDS 2.0 在线网站(http://gsds.gao‑lab. org/)对PSY 基因的内含子、外显子及保守结构域进行可视化分析。利用NCBI 数据库(https://www.ncbi.nlm.nih.gov/)获取拟南芥、甜菜、番茄和水稻PSY 基因的蛋白序列,并通过在线网络服务器MEME(https://meme‑suite.org/meme/tools/meme)识别PSY 蛋白中所包含的保守基序。
1.2.3 多序列比对和系统发育分析 使用ClustalX v.1.83(默认参数)对菠菜、甜菜、拟南芥、番茄、水稻5 个物种PSY 蛋白序列进行多重序列比较,使用MEGA 7 将比对后的序列构建NJ 树,步长检验值设为1 000,之后导出进化树文件,利用TBtools 软件进行绘制。
1.2.4 菠菜PSY 基因顺式作用元件预测 利用TBtools 软件从基因组数据中提取菠菜PSY 基因起始密码子上游2 000 bp 的序列,并使用PlantCARE数 据 库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对得到的序列进行顺式作用元件预测,预测结果通过TBtools 进行可视化。
1.2.5 菠菜总类胡萝卜素含量测定 在菠菜六叶一心期时,连带叶柄2 cm 处剪下其第二和第三对真叶,使用冷冻干燥机(‑20℃,10 Pa)冻干处理,48 h 后取出样品密封放置在‑80℃冰箱中保存待测。将样品加液氮磨至粉碎后取1.0 g 干样粉末,加入10 mL丙酮没过样品,水浴超声15 min;冷冻离心10 min,过滤收集上清液,反复提取至样品无色;合并所有上清液,35℃旋转蒸发;以1 mL 甲醇溶解,过0.22μm 滤膜,进行HPLC 检测。每个样品3 次重复,上述过程在暗环境中进行。
1.2.6 实时荧光定量PCR 分析和相关性分析 采取菠菜根、茎、叶、叶柄、薹叶、薹叶柄6 个组织部位的材料,使用TRIzol 法提取菠菜各个组织的RNA。利用TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒将提取的RNA 反转录成cDNA,于‑20℃保存备用。使用DBI®Bioscience BestarTMqPCR Master Mix(SYBR Green)试剂盒在Applied Biosystems 7500 Real Time PCR 仪器上进行实时荧光定量PCR。定量引物通过NCBI网站设计后,由生工生物工程(上海)股份有限公司合成(表1)。以菠菜18S为内参,以2-ΔΔCt法计算基因相对表达量,使用Excel、GraphPad Prism 8.0 进行数据分析和作图。将播种后30 d 的菠菜幼苗为供试材料,以白光为对照组,不同比例的红蓝光R1B3 和R3B1 为处理组,分别取处理24 h 和12d 的叶片提取RNA 并进行基因相对表达分析,方法同上。
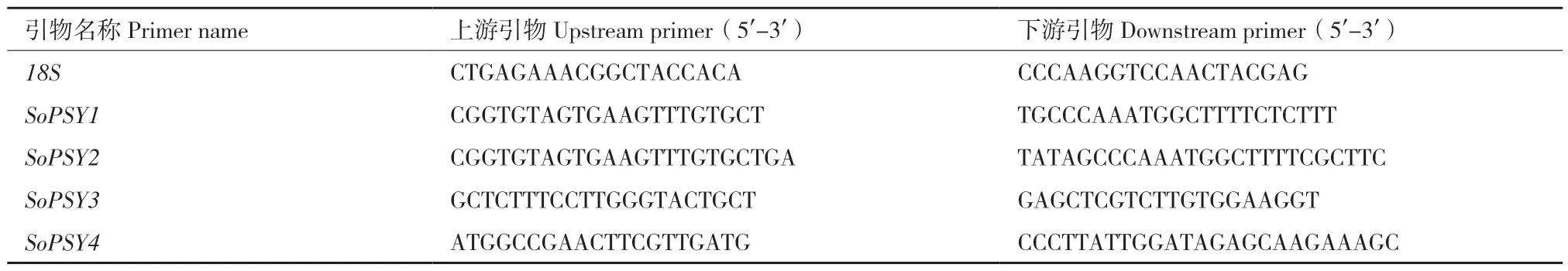
表1 实时荧光定量PCR 引物Table 1 Primers used for quantitative real-time PCR
2 结果
2.1 菠菜PSY基因家族鉴定及理化性质分析
本研究从菠菜基因组中共鉴定出4 个编码PSY蛋白保守结构域的基因, 其蛋白的理化性质分析结果如表2 所示,菠菜PSY 蛋白的氨基酸数在351-418 之间, 相对分子质量范围为40-47 kD,理论等电点8.89-9.17。PSY 蛋白总平均疏水性为负值,属亲水性蛋白。通过对菠菜PSY 蛋白的亚细胞定位预测发现,4 个PSY 均定位于叶绿体。
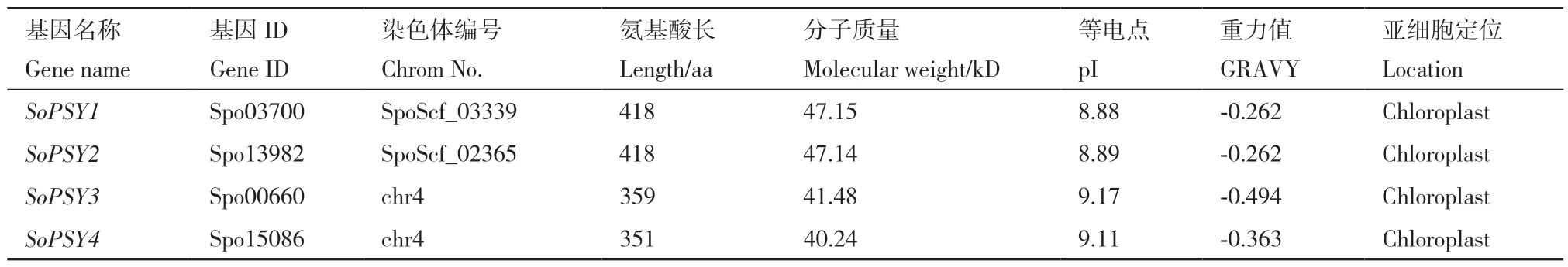
表2 菠菜PSY 基因家族的鉴定及理化性质Table 2 Identification and characteristic features of PSY gene family in spinach
2.2 菠菜PSY基因结构及蛋白保守基序
菠菜PSY 基因家族不同成员的基因结构具有差异性(图1)。利用GSDS 2.0 在线工具进行基因结构分析表明,除PSY3基因具有5 个外显子外,其他3个基因具有6 个外显子结构,外显子长度介于50-426 bp;内含子长度变化与外显子相似,介于79-514 bp。
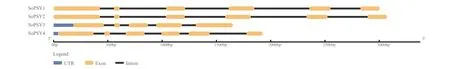
图1 菠菜PSY 基因结构分析Fig. 1 Gene structure analysis of PSY in spinach
SQS_PSY 是PSY 和角鲨烯合酶(squalene syn‑thase, SQS)共有的保守结构域。由保守结构域分析可知(图2),菠菜PSY 均含有SQS_PSY 保守结构域。保守基序结果显示(图2),菠菜PSY 家族成员至少具有6 个Motif 基序。SoPSY1 和SoPSY2 的保守基序一致,SoPSY4 的保守基序相比较于SoPSY1、SoPSY2 和SoPSY3,缺少了Motif 5。Motif1、2、3、4、5、6 组成了菠菜PSY 基因家族的典型保守区域,其中Motif 2 具有活性位点DXXXD(DELVD),并且该结构域在4 个PSY 蛋白中高度保守。
2.3 菠菜PSY基因家族系统进化分析
将鉴定到的4 个菠菜 PSY 蛋白序列,以及通过NCBI 数据库获取的PSY 同源基因AtPSY(AAA32836)、OsPSY1(AAS18307)、OsPSY2(AK073290)、OsPSY3(DQ356431)、SlPSY1(ABM45873)、SlPSY2(ABU40771)、SlPSY3(XP_004228928.1)、BvPSY(XP_ 010675231.1) 和BvPSY(KMT13325.1)的蛋白序列,以邻接法构建系统进化树,进一步探究菠菜和模式植物间PSY 蛋白的进化关系。结果(图2)表明,水稻PSY2 和PSY3 的进化分支与其他双子叶植物平行演化,但水稻PSY1 与双子叶植物聚为一支;番茄PSY1 和PSY2 保守的聚为一支,菠菜PSY1 和PSY2 与同为苋科的甜菜聚为一支但二者遗传距离更近;番茄PSY3、菠菜PSY3 和PSY4 形成相对独立的进化分支。
2.4 启动子顺式作用元件预测
为分析菠菜PSY 基因的上游调控因子,提取4个SoPSY 基因起始密码子上游2 000 bp 的基因组序列,并利用PlantCARE 数据库进行顺式作用元件查询。结果(图3)表明,菠菜PSY 基因含有多种环境和激素响应相关元件,其中参与光响应的顺式调控元件和脱落酸响应元件最多。除SoPSY3仅含有5个光响应元件外,其余3 个PSY 基因启动子序列均含有13-15 个光响应元件,如G‑Box、Box 4、GT1‑motif 和LAMP‑element 等,表明该基因可能受光诱导表达或调控。此外,在PSY 基因启动子序列中还鉴定出一些低温胁迫调控元件LTR、与干旱胁迫相关的MBS 作用元件和厌氧诱导必需顺式作用元件ARE,表明该基因参与的生理变化影响菠菜非生物胁迫的响应。
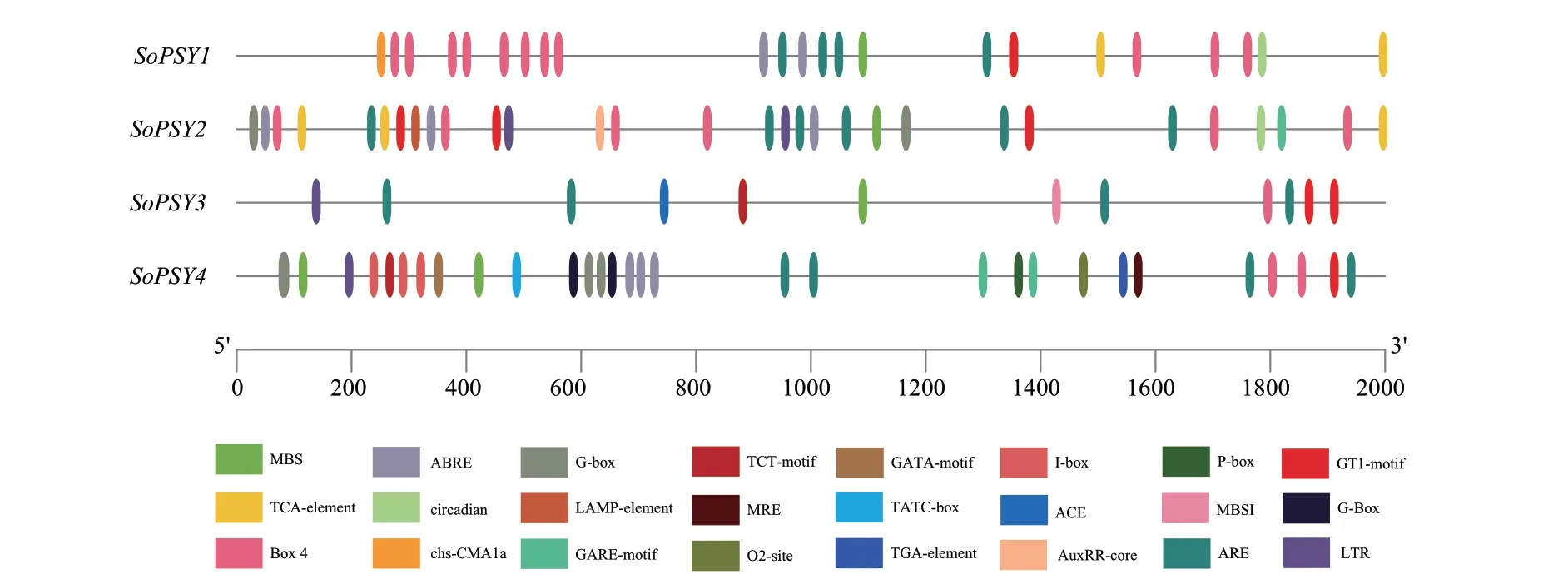
图3 菠菜PSY 基因启动子区域顺式调节元件分析Fig. 3 Characterization of cis-acting regulatory elements in the promoter region of spinach PSY genes
2.5 菠菜PSY基因组织特异性分析
为进一步分析SoPSY 基因的生物学功能,利用RT‑qPCR 检测方法,在菠菜不同组织中检测SoPSY基因的表达水平。结果(图4)显示,菠菜PSY 在地上部和地下部组织器官中表达水平具有显著的差异,SoPSY4在根中高水平表达,显著高于地上部分各组织器官;其余3 个PSY 基因在叶片中高水平表达,营养叶和薹叶中表达最高,其次是薹叶柄、短缩茎和叶柄,在根中表达量最低。此外,4 个基因中SoPSY2叶的相对表达量最高,约是其余基因叶的1.2-45 倍;SoPSY3薹叶的相对表达量最高,约是其余基因薹叶的1.7-57 倍。
2.6 菠菜PSY基因响应红蓝光比例变化的表达模式分析
基于PSY 启动子中分布的大量光响应元件,为进一步分析PSY 基因可能的生物学功能,以白光为对照组,不同比例的LED 红蓝光R1B3 和R3B1 处理的菠菜幼苗叶片为供试材料,利用RT‑qPCR 方法,检测野生型材料‘US362’和栽培型材料‘KS4’中SoPSY 响应不同光质处理的表达水平变化。结果表明(图5,图6),不同基因型菠菜中,不同SoPSY 基因响应红蓝光比例变化的表达模式具有差异性。
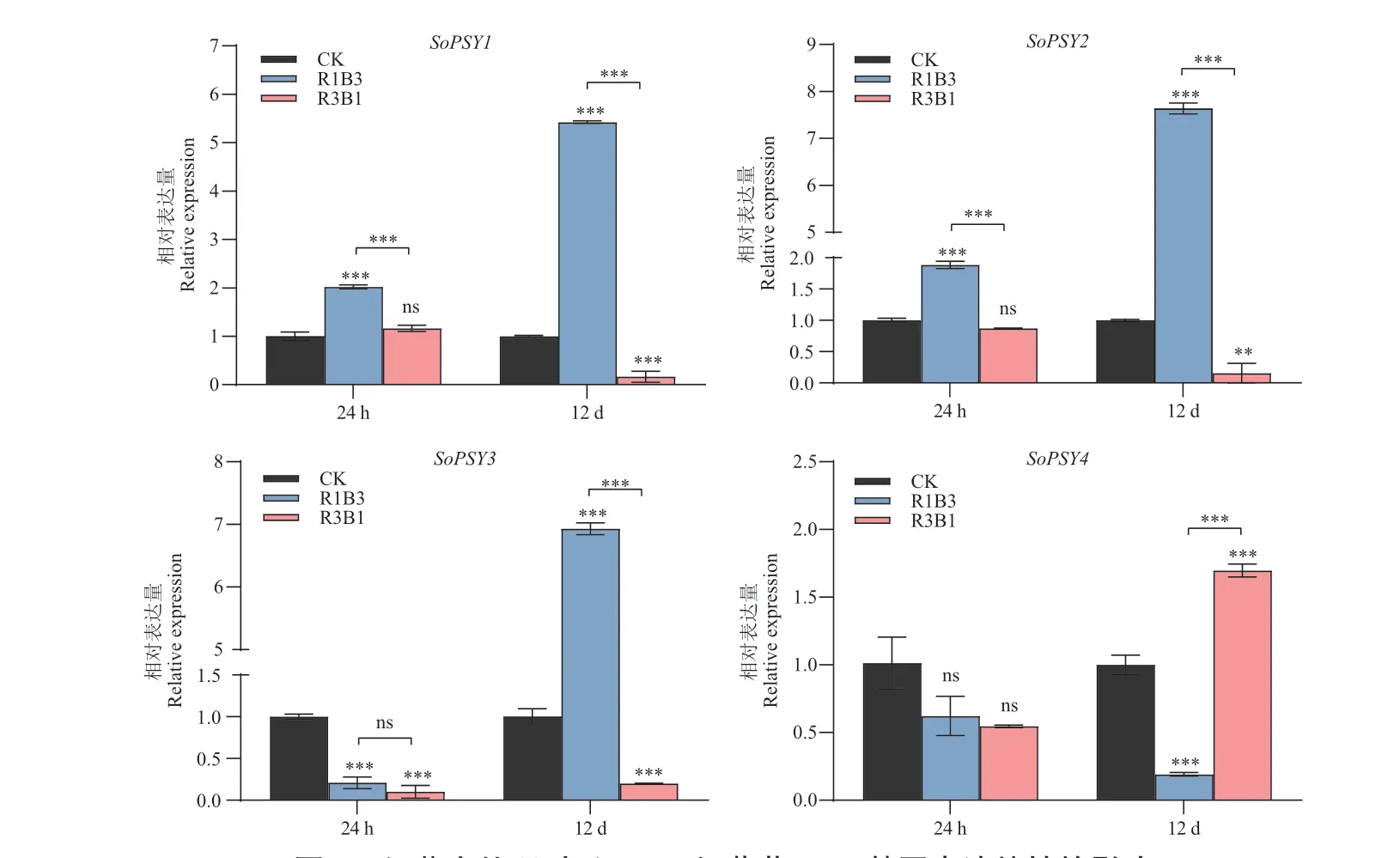
图5 红蓝光处理对‘US362’菠菜PSY 基因表达特性的影响Fig. 5 Effects of red and blue light treatment on the expression characteristics of PSY genes in ‘US362’ spinach
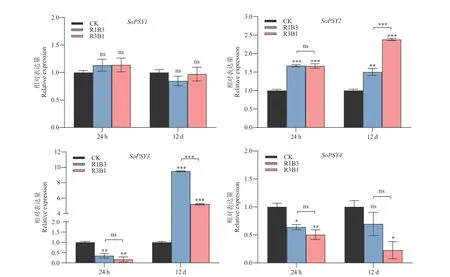
图6 红蓝光处理对‘KS4’菠菜PSY 基因表达特性的影响Fig. 6 Effects of red and blue light treatment on the expression characteristics of PSY gene in ‘KS4’ spinach
在野生类型菠菜中(图5),处理24 h 和12 d,SoPSY1和SoPSY2基因响应不同红/蓝光的表达模式一致,SoPSY3在24 h 处理下,受红/蓝光诱导表达显著下调,但R3B1 和R1B3 处理组间表达水平无显著差异;12 d 处理条件下,SoPSY3受R1B3 诱导表达显著上调,R3B1 使其表达水平显著低于白光对照组。SoPSY4在红/蓝光处理24 h 时与SoPSY3的表达模式相似,但各处理条件下SoPSY4的表达水平无显著差异;与SoPSY3不同,处理12 d 时SoPSY4的表达水平受R3B1 诱导显著上调表达,而R3B1 处理使其表达水平显著低于对照组。
在栽培型菠菜‘KS4’中(图6),红蓝光处理24 h 下,处理组SoPSY3和SoPSY4基因的表达水平均不同程度低于对照组,且R3B1 处理下的表达量低于R1B3 处理组;相反,SoPSY1和SoPSY2基因与对照组相比表达上调。处理12 d 时,4 个基因的表达呈现不同的响应模式,经红/蓝光诱导后,SoPSY2和SoPSY3基因的表达量显著升高且处理组间表达水平具有显著差异;SoPSY4相比白光表达下调,而SoPSY1的表达水平与对照相比无明显变化。上述结果表明,菠菜PSY 不同的表达模式可能与其基因启动子区域中存在不同的光反应元件有关。
2.7 光质处理下菠菜类胡萝卜素积累与PSY基因表达分析
为进一步探究菠菜PSY 基因表达量与类胡萝卜素积累的关系,对不同比例的LED 红蓝光R1B3、R3B1 处理24 h 和12 d 的菠菜幼苗叶片分别进行总类胡萝卜素含量的测定。结果(图7)显示。处理24 h 后,野生型与栽培型菠菜响应红蓝光比例变化的总类胡萝卜素含量均显著低于白光对照。不同之处在于,‘US362’受R1B3 诱导的总含量低于R3B1处理下的含量;而‘KS4’中相反,处理组R3B1 的总类胡萝卜素含量显著低于处理组R1B3 的含量。结果表明,24 h 短时间处理对‘US362’和‘KS4’总类胡萝卜素的积累影响大,不同基因型材料的类胡萝卜素积累对红蓝光比例的敏感性不同。红/蓝光处理12 d 后,KS4 菠菜对照组总类胡萝卜素的含量为299.79 μg/g DW,分别是处理组R1B3、R3B1的2.21 倍和1.86 倍;在‘US362’中,R1B3、R3B1处理对其含量均未产生显著性影响。结果表明,在12 d 长时间处理下,植物材料中光条件影响的类胡萝卜素积累趋于稳定,栽培型菠菜‘KS4’受光条件影响的类胡萝卜素积累变化趋势与野生类型菠菜‘US362’不同。
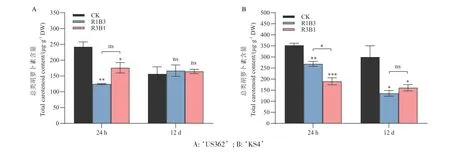
图7 红蓝光处理下菠菜总类胡萝卜素含量变化Fig. 7 Changes of total carotenoid content in spinach under red and blue light treatment
利用不同比例的LED 红蓝光R1B3、R3B1 处理后类胡萝卜素含量的变化与4 个SoPSY 基因的相对表达水平作相关性分析(表3)。处理24 h 后,野生类型菠菜‘US362’的R1B3 处理组总类胡萝卜含量的下降与SoPSY2和SoPSY3基因相对表达水平正相关,R3B1 处理组总类胡萝卜含量的下降与SoPSY1基因相对表达水平呈显著负相关,与SoPSY3正相关。处理12 d 后总类胡萝卜素含量趋于稳定,野生类型菠菜‘US362’中各试验组间的总类胡萝卜素含量差异不显著,R1B3 处理组SoPSY2、SoPSY3和SoPSY4基因相对表达水平与含量变化正相关,其中SoPSY2呈显著正相关,R3B1 处理组总类胡萝卜含量变化与SoPSY1和SoPSY3基因相对表达水平负相关;栽培型菠菜‘KS4’中,R1B3 和R3B1 处理组的总类胡萝卜素含量显著低于白光对照组,R1B3 处理组SoPSY1和SoPSY2基因相对表达水平与含量变化呈正相关,R3B1 处理组含量变化与SoPSY1相对表达水平呈负相关。上述结果表明,SoPSY1、SoPSY2和SoPSY3基因的相对表达水平与处理组总类胡萝卜素含量变化的相关性极强,这与它们均具有绿色组织表达特异性相一致。
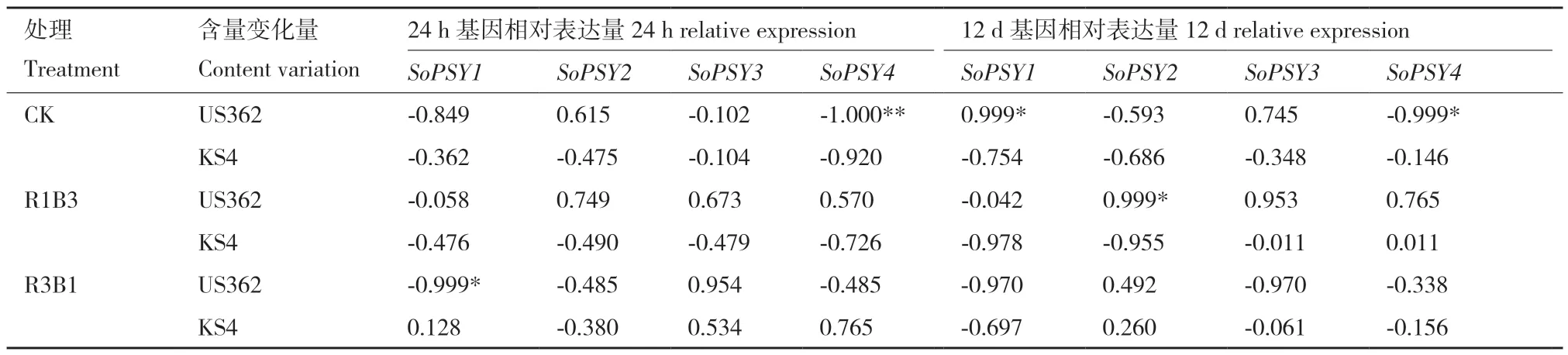
表3 红蓝光处理下菠菜总类胡萝卜素含量变化与PSY 基因相对表达量的相关性分析Table 3 Correlation analysis of total carotenoid content and PSY gene relative expression in spinach under red and blue light treatment
3 讨论
3.1 菠菜PSY家族基因分析
本研究通过全基因组筛选在菠菜中鉴定了PSY家族基因,发现菠菜PSY 有4 个家族成员,水稻[23]、玉米[24]和番茄[25]中均含有3 个PSY 基因,模式植物拟南芥中仅有1 个PSY 基因[22],表明植物界PSY 蛋白是一类保守且在不同物种间存在一定功能差异。通过对不同物种的PSY 家族的基因结构、功能域和进化树等分析发现,菠菜的4 个PSY 蛋白均具有该家族蛋白高度保守的活性位点DXXXD,该位点是判别PSY 基因所编码的蛋白是否具有酶活力的重要依据,在苹果(Malus pumilaMill.)[27]、油菜(Brassica napusL.)[28]、辣椒(Capsicum annuumL.)[29]等物种的PSY 蛋白中也存在同样的活性位点。进化分析上,菠菜SoPSY1 和 SoPSY2 与其他植物PSY 蛋白具有高度保守性,而SoPSY3 和 SoPSY4 形成独立的进化分支,表明菠菜的4 个PSY 虽然都具有八氢番茄红素合酶的保守结构但其功能可能不同。
3.2 菠菜PSY基因具有组织表达特异性
4 个PSY 基因的表达模式分析表明,SoPSY1、SoPSY2、SoPSY3在叶片中高水平表达,而SoPSY4在根中的表达水平显著高于其他组织,这一表达特征与水稻PSY 表达模式相似,OsPSY1和OsPSY2启动子中存在大量光响应元件并在绿色组织中参与光合作用,而高盐或干旱胁迫诱导OsPSY3在根系中表达[23],故推测SoPSY1、SoPSY2、SoPSY3可能在绿色组织中发挥功能参与光合作用等,SoPSY4可能具有不同的作用途径和功能。
3.3 菠菜PSY1、PSY2和PSY3的表达水平与总类胡萝卜素含量变化密切相关
不同组织表达特异性的PSY 催化类胡萝卜素合成的能力不同,绿色组织特异性表达的PSY 的高表达水平对地上部分类胡萝卜素积累具有主要贡献[30]。本研究设置了R1B3 和R3B1 两个光处理条件,栽培类型和野生类型菠菜中4 个SoPSYs 基因的响应模式不同,其中SoPSY1基因的表达在栽培型菠菜中不受给定光条件影响,SoPSY2基因的表达模式在两种类型菠菜中相反,SoPSY3基因在两种类型菠菜中的表达模式一致,而且它们的相对表达水平与总类胡萝卜素含量变化密切相关。SoPSY1、SoPSY2和SoPSY3基因的表达在类胡萝卜素低积累型的‘US362’中受R1B3 处理诱导,说明蓝光更有效地提高其类胡萝卜素生物合成基因的转录水平,但在导致更高代谢产物水平的转录后步骤中,可能存在其他影响因素。已有的报道中也观察到蓝光下生物合成基因的转录水平较高,如在单色光蓝色LED 下,提高了白菜芽(Brassica campestrisL.)的PSY、PDS、βLCY、εLCY、CYP97A3、CYP97C1、βOHASE1、ZEP、VDE和CCD4基因的转录水平,而与白光相比,单色红光降低了这些基因的表达水平[31]。这可能与红光下,光敏色素互作因子PHYTOCHROME‑INTERACTING FACTOR1(PIF1)抑制了PSY 基因的表达有关,在拟南芥[32]中也存在这种现象。
尽管影响菠菜类胡萝卜素积累的核心调控因素和分子机制有待进一步研究,但本研究开展对菠菜八氢番茄红素合成酶家族基因的生物信息学分析、表达特征及其与总类胡萝卜素含量积累关系的探索,为菠菜PSY 基因的功能研究提供了新的视角,并且也为基于PSY 基因开发富含类胡萝卜素菠菜的分子设计育种奠定了理论基础。
4 结论
本研究在菠菜基因组中共鉴定到4 个PSY 基因,它们在进化过程中高度保守。SoPSY1、SoPSY2、SoPSY3基因在绿色组织中表达水平显著高于其他组织,SoPSY4具有根组织表达特异性。菠菜类胡萝卜素含量在R1B3 和R3B1 处理后均下降;不同基因型菠菜中,各SoPSY 基因响应红蓝光比例变化的表达模式具有差异性,SoPSY1、SoPSY2和SoPSY3的相对表达水平与总类胡萝卜素含量变化密切相关。