黄瓜内果皮汁液对种子萌发的影响
杨艳 莫雨杏 周祎 陈惠明 肖浪涛 王若仲
(1. 湖南农业大学生物科学技术学院植物激素与生长发育湖南省重点实验室,长沙 410128;2. 岭南师范学院生命科学与技术学院,湛江524048;3. 湖南省农业科学院蔬菜研究所,长沙 410125)
黄瓜(Cucumis sativusL.)为葫芦科一年生蔓生或攀援草本植物,生长周期短,一年两种。我国主要以种植华南型黄瓜为主,但华南型黄瓜果实在高温高湿环境下易发生胎萌(vivipary, VP),即种子在果实内易萌发,胎萌的种子可严重影响制种产量和品质[1-3],给农业生产带来重大损失。胎萌黄瓜果实内部汁液含量很少,未胎萌的存在大量汁液,生产上收瓜时常用其汁液浸泡种子防止萌发,但其抑制机制尚不清楚。因此,研究黄瓜内果皮汁液影响种子萌发并探明其影响机制,对基于黄瓜来源的种子萌发抑制剂研发具有重要意义。
胚外部因素可影响种子气体交换、水分吸收、胚中化学成分释放和化学成分代谢等过程,进而影响萌发[4-5]。种子外部的种皮和果皮可影响种子吸水、呼吸等过程[6-7];滇重楼(Paris polyphylla Smithvar. yunnanensis(Franch.)Hand.‑Mazz.)种皮可抑制种子萌发[8];黄花蒿(Artemisia annuaL.)叶对狗尾巴草(Setaria viridis(L.)Beauv.)种子萌发具有明显抑制作用[9]。除了这些固体因素可影响种子萌发,植物自身液体也可影响种子萌发。例如,银杏(Ginkgo bilobaL.)外种皮汁液高浓度时可降低可溶性糖和可溶性蛋白含量,进而抑制小麦(Triticum aestivumL.)种子萌发[10];西洋参(Panax quinquefoliusL.)果汁可有效抑制种子萌发[11];20-30 g/L 香葱(Allium cepiformeG. Don)水浸提液可促进草莓种子萌发[12];少花龙葵(Solanum americanumMill.)果汁原液抑制小白菜(Brassica campestrisL. ssp.chinensisMakino var.communisTsen et Lee)种子萌发,稀释20-50 倍后其抑制作用才解除[13];西瓜(Citrullus lanatus(Thunb.)Matsum. & Nakai)汁可抑制其瓜籽萌发[14]。番茄(Solanum lycopersicumL.)、石榴(Punica granatumL.)、芒果(Mangifera indicaL.)、杨桃(Averrhoa carambolaL.)、柠檬(Citrus×limon(Linnaeus)Osbeck)、葡萄(Vitis viniferaL.)等汁液浓度高于8%时,番茄种子萌发率降低,当浓度低于8%时,这些汁液均能显著提高番茄种子的萌发率;而苹果(Malus pumilaMill.)和李子(Prunus salicinaLindl.)果汁浓度高于8%则能很好地促进番茄种子萌发[15]。显然,这些胚外部位存在影响种子萌发的化学成分。此外,植物激素脱落酸(abscisic acid,ABA)和赤霉素(gibberellins,GAs)在调控种子萌发过程中发挥着重要作用[16-17]。在植物果皮、种皮、叶和汁液等部位均存在植物激素ABA 和GAs。研究表明,ABA 具有抑制种子萌发的作用[18],ABA 合成基因NCED1和NCED2和信号转导基因CsPYL2、CsPP2C2和CsSnRK2以及代谢基因CsCYP707As等均与种子萌发相关[19-20]。经研究证实,黄瓜叶片水浸提液对其种子萌发具有抑制作用,且浸提液浓度越高抑制作用越明显[21]。
黄瓜内果皮汁液在种子萌发方面的功效及机制鲜有报道,且大部分研究在胚外因素影响种子萌发方面主要简单分析一些发芽速度、整齐度等指标,较少涉及与ABA 相关基因方面的复杂分析。
本研究以难胎萌黄瓜(M‑H)内果皮汁液处理易胎萌黄瓜(C‑L)种子,测定和分析种子萌发过程中相关生理生化指标的变化,探究汁液对黄瓜种子萌发的影响及其机制,同时为基于黄瓜来源的种子萌发抑制剂研发提供一定的理论依据。
1 材料与方法
1.1 材料
难胎萌(M‑H)和易胎萌(C‑L)黄瓜品种由湖南省蔬菜研究所陈惠明研究员提供,2021 年种植于湖南农业大学植物激素与生长发育湖南省重点实验室智能大棚。
取样方法:分别采摘授粉后第40 和50 天黄瓜果实各5 个,纵向剖开果实后分别收集内果皮汁液、种子各3 份,重复3 次取样;汁液经液氮处理后‑80℃保存备用,鲜种子去掉外部黏液质后进行萌发试验,剩余种子风干后‑4℃储存备用。
1.2 方法
1.2.1 种子萌发试验
1.2.1.1 汁液对种子萌发的影响 取175 g M‑H 汁液4 000 r/min 离心5 min,其中50 g 上清液加蒸馏水稀释成质量分数为50%的培养液,剩余的100 g 上清液直接培养C‑L 种子。种子萌发率统计时间分别为20 和25 h,每个处理5 次重复,每个重复50 粒种子,均置于30℃恒温培养箱中。
式中,S:供试种子总数;N:萌发种子总数。
1.2.1.2 汁液提取液对种子萌发的影响 20 g 质量分数为100%的上清液经95%乙醇提取3 次,乙醇相浸膏再依次通过石油醚、乙酸乙酯、正丁醇萃取3 次后,分别得到石油醚相浸膏1.81 g、乙酸乙酯相浸膏1.49 g、正丁醇相浸膏2.15 g,余下水相浸膏10 g,最后各浸膏加蒸馏水稀释成质量分数为3%的培养液。各培养液分别处理C‑L 种子。种子萌发率统计时间分别为16、21 和26 h,每个处理3 次重复,每个重复30 粒种子,均置于30℃恒温培养箱中。
1.2.2 汁液化学成分分析 分别称取C‑L、M‑H 黏液质和汁液55 mg,黏液质经液氮研磨并冷冻干燥成白色粉末,2 个样品分别加入5 mL 甲醇于20℃超声提取30 min,4 000 r/min 离心10 min,取上清液真空浓缩干燥,100% HPLC 甲醇复溶,过0.22 μm 有机膜并于4℃保存备用。使用安捷伦6550 四极杆飞行时间质谱仪对其进行化学成分分析。进样条件:正离子模式,进样量2 μL,流动相:A(0.1% Fa‑H2O)、B(acetonitrile),流速:0.3 mL/min,进样时间35min,分析条件见表1。
1.2.3 可溶性糖含量的测定 选取20 mg 新鲜种子磨碎,加入5 mL 蒸馏水并水浴60 min,4 000 r/min离心5 min,取上清液,残渣经热水洗涤数次,离心合并上清液并定容至刻度线,取100 μL 样品提取液,采用蒽酮比色法测定可溶性糖含量[22]。
1.2.4 植物激素ABA 和GA 含量测定 采用植物激素与生长发育湖南省重点实验室建立的高效液相色谱法(HPLC 法)测定ABA 和GA 含量。取保存于‑80℃质量分数为100%汁液和蒸馏水处理的种子加入液氮迅速研磨至粉末状,编号,分别称取粉末状样品200 和100 mg,重复3 次;80%甲醇4℃超声,混匀后置于4℃浸提12 h,重复浸提一次并合并上清液,真空浓缩干燥后备用,根据内标法定量。
1.2.5 基因表达分析 选取质量分数为100%汁液和蒸馏水处理的种子对ABA 合成基因、信号转导基因、代谢基因等生化指标进行分析。在NCBI 数据库中下载黄瓜ABA 合成基因CsNCED1(LOC1012‑14535)和CsNCED2(LOC101219505)、信号转导基因CsPYL2(LOC101214314)、CsPP2C2,参考玉米和拟南芥基因CYP707A1、SnRK2并运用DNAMAN的序列比对功能,在黄瓜中分析克隆到与玉米或拟南芥高度同源的基因片段序列,利用Primer 5.0 设计长度在18-22 bp 的qPCR 扩增引物(表2)。

表2 相关基因及qPCR 引物Table 2 Related genes and qPCR primers
取质量分数为100%汁液和蒸馏水处理5、10、15、20 和25 h 后的种子,利用RNA 提取试剂盒(Trans ZolTM Up Plus RNA Kit)提取其总RNA。RNA 浓度经多功能酶标仪(Tecan‑Spark)检测后,使用反转录试剂盒(全式金公司)反转录合成cDNA,以黄瓜Actin为内参基因(AB010922.1),以合成的cDNA 为模板,利用qPCR(BIO‑RAD T100TMT hermal cycler) 检测基因CsNCED1、CsNCED2、CsYP707A1、CsPYL2、CsPP2C2、CsSnRK2的表达情况。反应条件为95℃ 30 s;95℃ 5 s,60℃ 30 s,45 个循环。采用2-ΔΔCt方法计算各目的基因的相对表达量。每个基因的表达反应重复3次。反应体系如表3所示。

表3 反应体系Table 3 Reaction system
1.2.6 数据统计与分析 采用Origin 和Excel 2010软件进行作图和制表。
2 结果
2.1 黄瓜胎萌性状观察
分别从授粉后不同时期的C‑L、M‑H 植株上摘取新鲜黄瓜,纵向剖开后观察其内部种子萌发情况。C‑L 黄瓜果实授粉35 d 后胎萌情况轻,将瓜内未萌发的种子取出后,置于无水状态下12 h 后大量萌发(图1‑F);C‑L 黄瓜果实授粉50 d 后胎萌情况严重,内果皮汁液大量减少,瓜内种子已全部萌发,部分高达5.80 cm 长的绿色幼苗突破外果皮(图1‑A-B和图1‑E)。M‑H 果实种子未出现胎萌现象,在授粉50 d后其内部仍存在大量汁液(图1‑C-D)。由此可见,难胎萌的M‑H 果实内部汁液可能存在抑制种子萌发的化学成分,因此后续将其汁液作为处理用的材料。
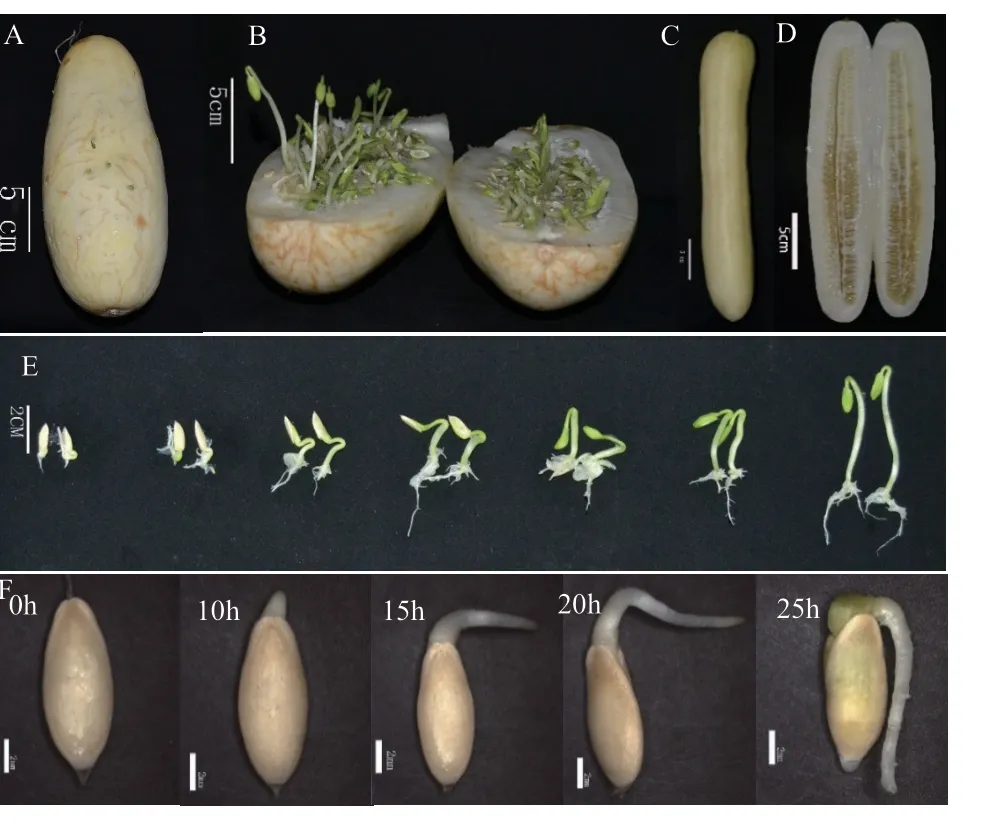
图1 黄瓜果实胎萌表型Fig. 1 Viviparous phenotypes of cucumber fruits
2.2 汁液对黄瓜种子萌发的影响
为探究M‑H 汁液是否抑制C‑L 种子萌发,分别选取不同质量分数的M‑H 汁液处理C‑L 种子。质量分数为50%汁液在20 h 对种子的抑制率为73%,比对照高23%;质量分数为100%的汁液完全抑制种子萌发,抑制率一直为100%;同时种子胚根长度随着汁液质量分数变高而变短(图2 和图3)。
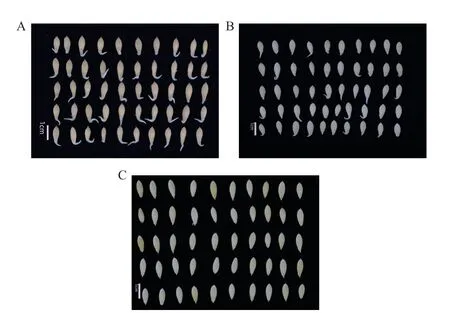
图2 汁液处理的黄瓜种子萌发表型Fig. 2 Germination phenotypes of cucumber seeds treated with juice
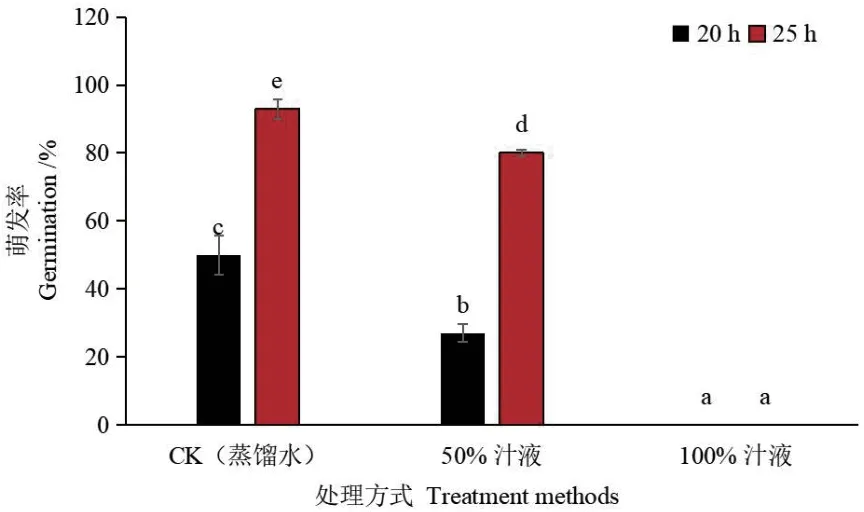
图3 汁液处理的黄瓜种子萌发率Fig. 3 Germination rate of cucumber seeds treated with juice
2.3 汁液提取液对黄瓜种子萌发的影响
为进一步确证汁液中是否存在抑制种子萌发的化学成分,使用质量分数均为3%汁液提取液处理C‑L 种子(图4 和图5),乙醇相、正丁醇相化学成分在种子整个萌发过程中均呈现抑制作用。乙醇相16、21 和26 h 抑制率分别比对照高3.34%、11.11%和12.22%;乙醇相16、21 和26 h 抑制率分别比乙酸乙酯相高17.78%、14.44% 和11.11%。正丁醇相16、21 和26 h 抑制率分别比对照高47.23%、46.67%和47.77%;正丁醇相16、21 和26 h 抑制率分别比乙酸乙酯相高61.67%、50%和46.33%。乙酸乙酯相化学成分在种子萌发16 h 呈现促进作用,萌发率比对照高14.44%,21 和26 h 萌发率与对照差异不明显。石油醚相和水相在整个萌发过程中对种子萌发影响较小。可见,黄瓜内果皮汁液中存在抑种子萌发的化学成分。

图4 汁液提取液处理的黄瓜种子萌发表型Fig. 4 Germination phenotypes of cucumber seeds treated with the extracts of juice
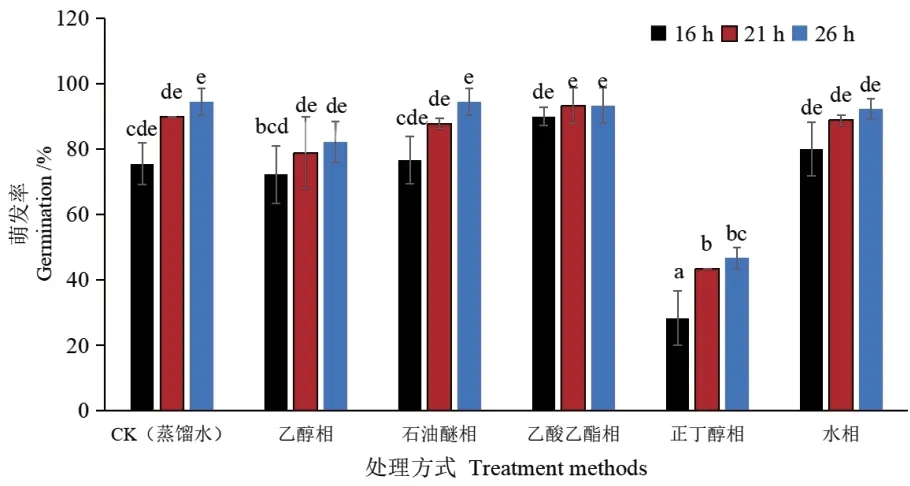
图5 汁液提取液处理的黄瓜种子萌发率Fig. 5 Germination rates of cucumber seeds treated with the extracts of juice
2.4 汁液化学成分分析
汁液经UPLC‑Q‑TOF‑MS 分析后共得到32 个化合物(图6 和表4),主要为有机酸、氨基酸、醇类、醛类、酮类和醚类等,其中棕榈酸、肉豆蔻酸、柠檬酸、组氨酸等均可影响种子萌发。
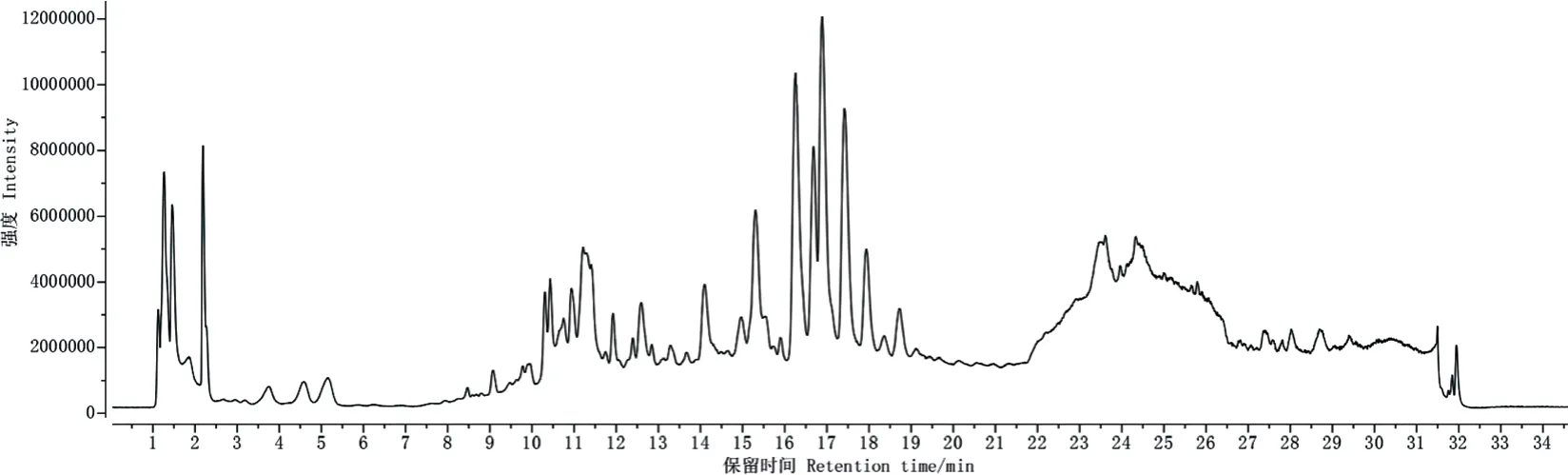
图6 汁液提取液LC-Q-TOF-MS 检测的正离子模式总离子流图Fig. 6 Total ion chromatogram of positive ion mode detected by LC-Q-TOF-MS of juice extract
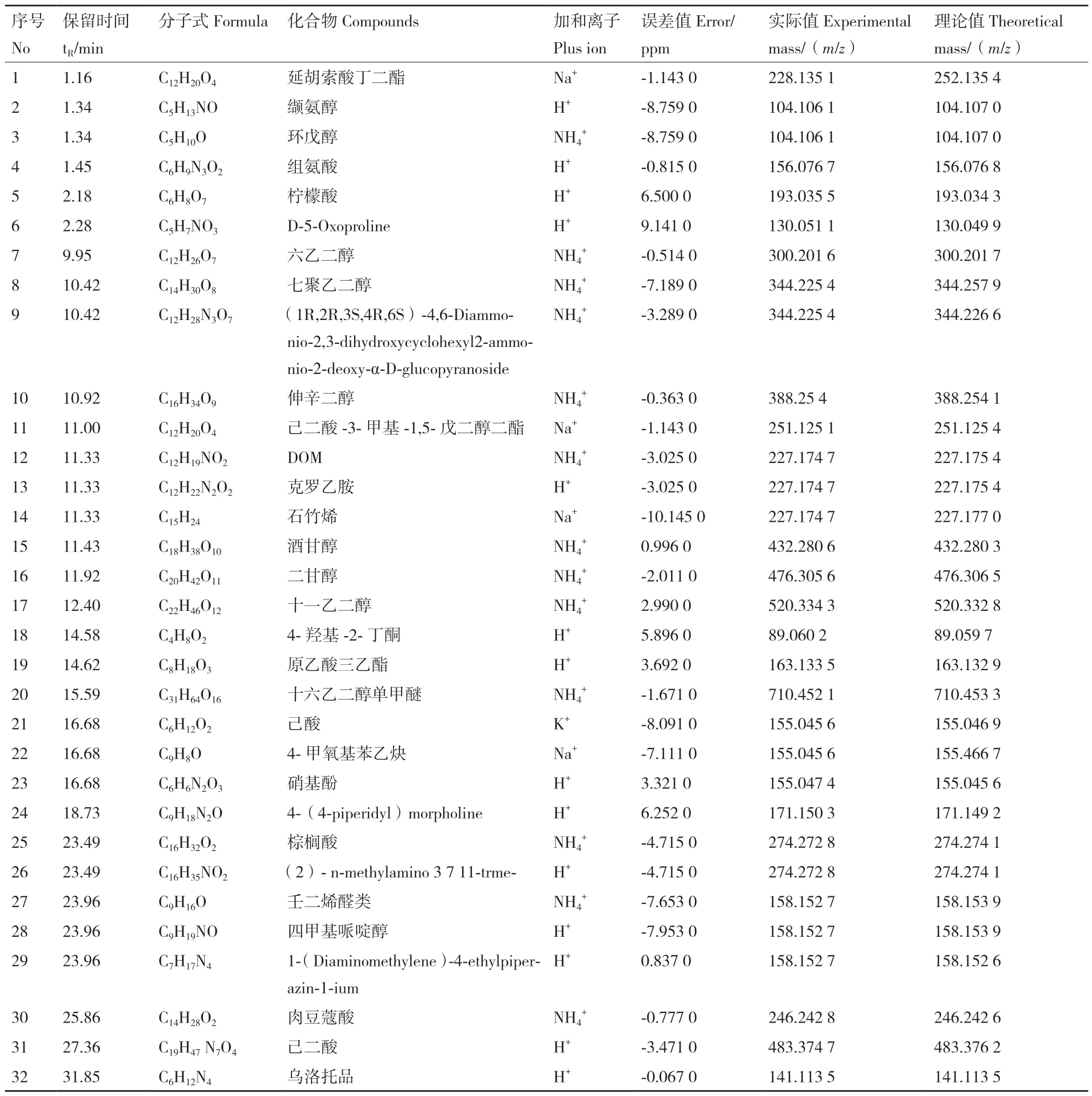
表4 汁液化学成分Table 4 Compounds of juice
2.5 汁液处理下黄瓜种子生理指标的变化
2.5.1 可溶性糖含量的变化 质量分数为100%汁液处理的干种子吸胀至10 h 可溶性糖含量下降至4.21%,比对照(蒸馏水)减少0.43%;萌发15-25 h,其可溶性糖含量比对照高但变化不大。对照种子可溶性糖含量变化明显,种子吸胀至5 h 其可溶性糖含量减少至4.28%,10 h 较15 h 增加0.29%,15 h较10 h 减少0.87%,20 h 较15 h 增加0.1%,25 h 较20 h 减少0.29%(图7)。可见,汁液处理的种子在萌发过程中可溶性糖代谢不活跃。
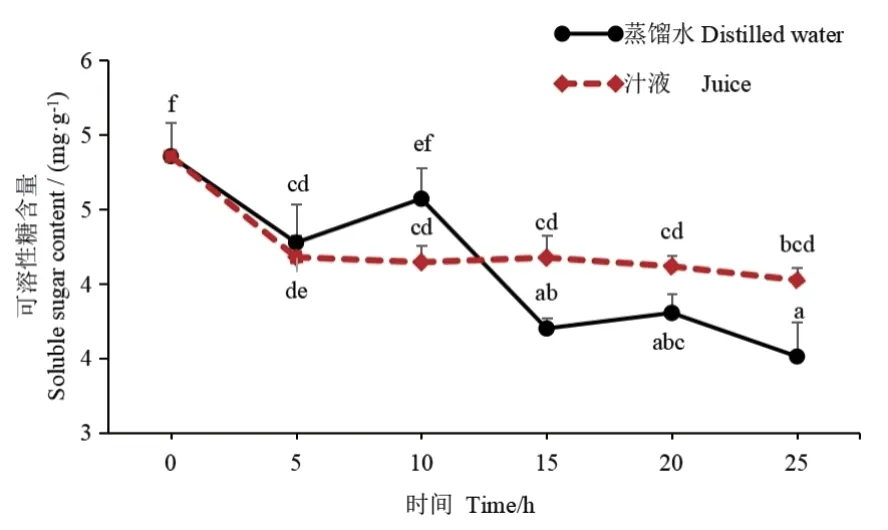
图7 黄瓜种子萌发过程中可溶性糖含量变化Fig. 7 Changes of soluble sugar contents in cucumber seeds during germination
2.5.2 ABA 和GA3含量的变化 种子萌发后2 个处理的ABA 含量均减少,但质量分数为100%汁液处理的种子萌发5-25 h ABA 含量均比对照(蒸馏水)高,其含量分别增加了96.39%、22.67%、73.49%、94.85%和13.59%(图8‑A)。汁液处理的种子在吸胀0-10 h,GA3含量分别比对照低12.83%和22.23%,15-25 h 时,其GA3含量分别比对照高32.27%和43.57%(图8‑B)。通过比较ABA 和GA3的含量(图8‑C),结果表明,汁液处理的种子0-20 h ABA/GA3均显著高于对照,分别为125%、58.21%、73.14%和47.12%。说明质量分数为100%汁液处理的种子未萌发可能是由较高的ABA/GA3造成的。
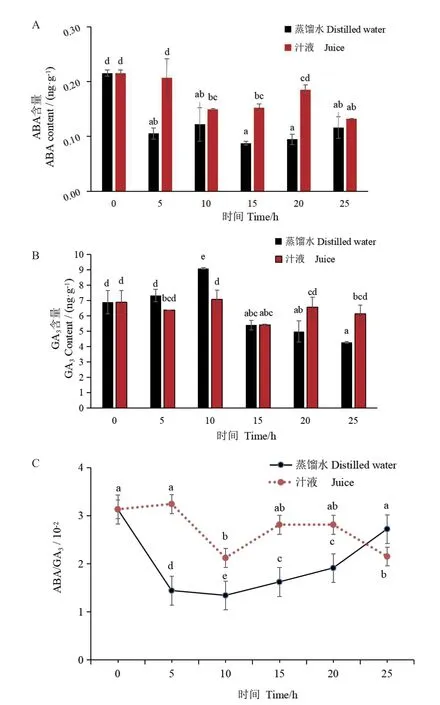
图8 黄瓜种子萌发过程中ABA 和GA3 的含量Fig. 8 ABA and GA3 contents in cucumber seeds during germination
2.6 汁液处理下黄瓜种子ABA相关基因的变化
2.6.1 ABA 合成基因表达量的变化 质量分数100%汁液处理的黄瓜种子ABA 含量较高,但是否与其合成酶基因CsNCED1和CsNCED2存在联系尚不清楚。种子萌发过程中CsNCED1和CsNCED2表达量总体呈下降趋势,但在汁液和对照(蒸馏水)中存在差异。汁液处理的种子在10 和15 hCsNCED1表达量分别比对照显著增加1.19 倍和2.65 倍(图9‑A)。汁液和对照处理的种子CsNCED2在吸胀0-5 h 表达量均减少且降到最低;5-10 h 两个处理的CsNCED2表达量增加;15-25 h 汁液处理的CsNCED2表达量分别比对照显著增加5.28、2.11 和4.35 倍(图9‑B)。可见,汁液处理的种子ABA 含量上升与CsNCED1和CsNCED2表达量增加有关。
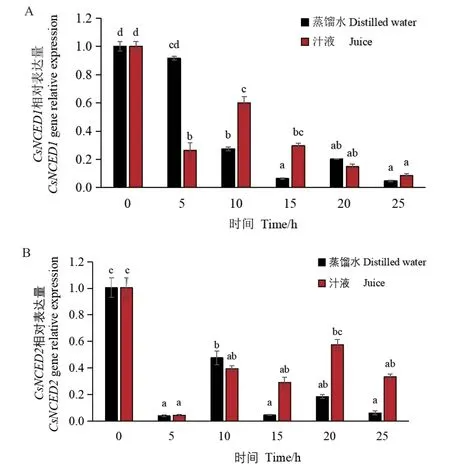
图9 黄瓜种子萌发过程中ABA 合成基因的相对表达量Fig. 9 Relative expressions of ABA synthesis genes during cucumber seed germination
2.6.2 ABA 代谢及信号转导途径基因表达量的变化 为探究汁液如何调节ABA 代谢进而影响黄瓜种子萌发,进一步分析比较了在萌发过程中,汁液处理和对照(蒸馏水)处理的种子ABA 信号转导及代谢途径基因的表达差异。结果显示,汁液处理的种子ABA 信号转导基因CsPYL2、CsPP2C2、CsSnRK2和代谢基因CsYP707A1的表达量均呈先上升后下降的趋势,且均在20 h 表达量最高。种子萌发5 h 和15-25 h 时,CsYP707A1表达量分别比对照显著增加9.42、0.77、4.91 和2.70 倍,10 h 时较对照降低63.73%(图10‑A);5-25 h 时,汁液处理的CsPYL2表达量分别比对照显著增加0.79、2.68、4.78、15.98和3.86 倍(图10‑B);10-25 h 时CsPP2C2表达量分别比对照显著增加1.11、0.61、3.58 和1.71 倍(图10‑C);10-25 h 时CsSnRK2表达量分别比对照显著增加2.09、3.33、11.47 和4.02 倍(图10‑D)。结果表明,汁液可诱导ABA 代谢及信号转导途径基因表达上调。
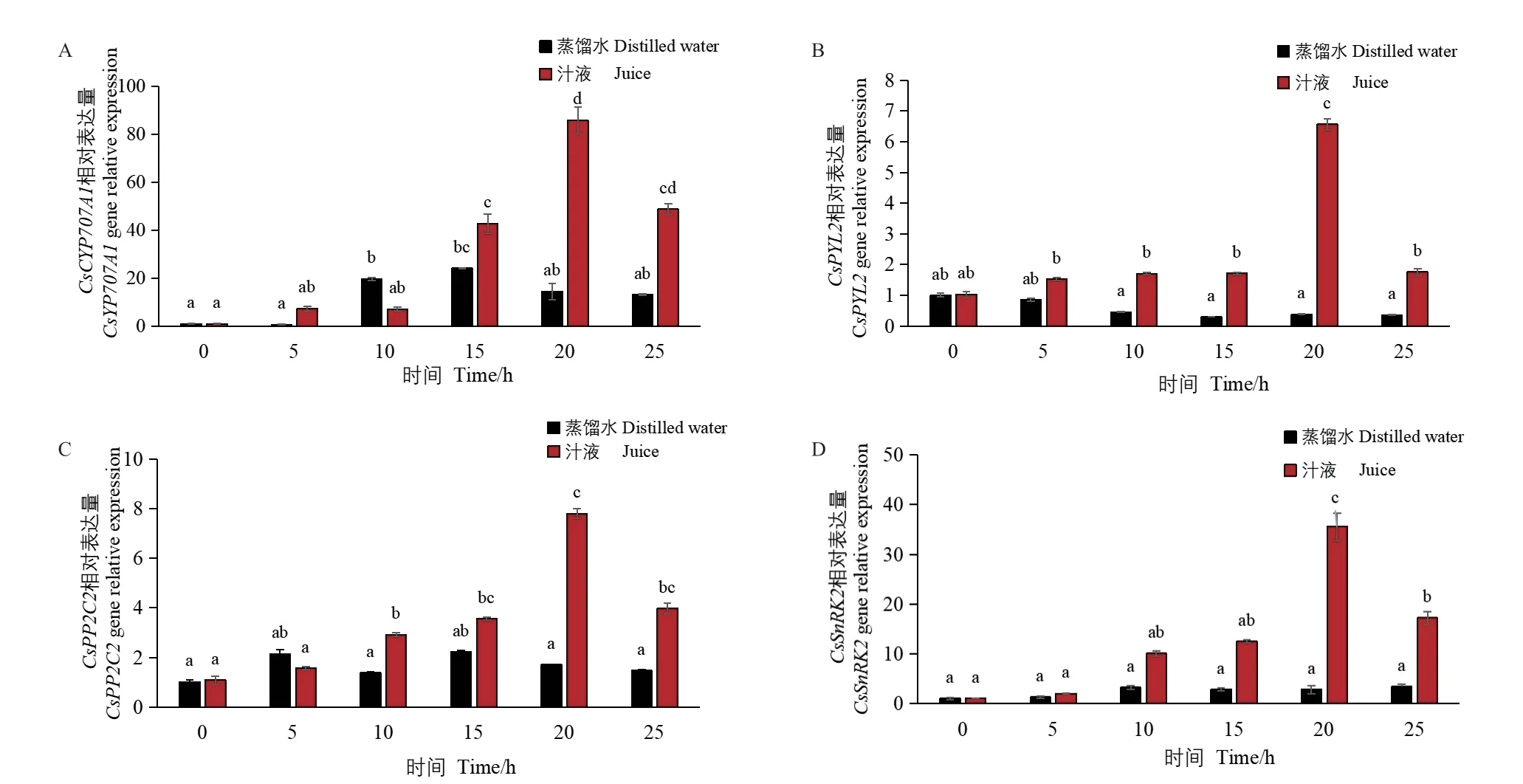
图10 黄瓜种子萌发过程中ABA 代谢及信号转导途径基因相对表达量Fig. 10 Relative expressions of ABA metabolism and signaling pathway genes during cucumber seed germination
3 讨论
3.1 汁液处理下黄瓜种子萌发的生理差异分析
C‑L 种子通过M‑H 汁液处理后,其萌发率均较对照低,且抑制作用随着质量分数升高而变强,这和肉桂酸抑制‘定豌10 号’种子萌发且抑制作用随着其浓度上升而变强的结果一致[23],也证明黄瓜内果皮汁液可有效抑制黄瓜种子萌发。可溶性糖为种子萌发提供主要能量,其变化趋势可反映种子在生长发育过程中的活性情况[24]。当汁液质量分数为100%时,其处理的种子萌发率一直维持为零,可溶性糖含量在吸胀0-10 h 时均比对照低,后期变化较小,对照种子在整个萌发过程中可溶性糖含量变化较大,原因是种子吸胀前8 h 为快速吸水期,此时可溶性糖的转化已被启动,蔗糖需要转化为葡萄糖、果糖等单糖为萌发提供能量[25],而汁液处理的种子在同时期并未出现相同的趋势。此外,汁液经不同化学试剂提取后,乙醇相、正丁醇相在种子整个萌发过程中都呈现抑制作用,尤其正丁醇相抑制作用最强,这和Barh 等[15]研究结果一致。由此可见,汁液中的一些化学成分可能阻碍可溶性糖发生转化,使种子不能利用正常形式的单糖提供能量,从而不能顺利萌发。
3.2 汁液化学成分影响种子萌发
化感物质是指植物自身产生并且能够影响周围其他植物生长发育过程的一类化学成分,其主要应用于杂草防治和种子萌发方面。化感物质因化感作用所产生,主要为次生代谢物,汁液中存在的肉豆蔻酸、棕榈酸、柠檬酸均为典型的化感物质[26],它们均对种子萌发具有抑制作用[27-28]。此外,隶属氨基酸的组氨酸也可影响种子萌发,番茄种子在较低浓度组氨酸处理下可提高种子萌发率[29]。当然,汁液中还存在一些其他有机酸类,例如己酸、己二酸等,它们在种子萌发方面的功效尚待探究。种子经汁液处理后萌发率显著降低,这可能与肉豆蔻酸、棕榈酸、柠檬酸等化学成分有关。
3.3 汁液处理下植物激素ABA相关基因表达分析
种子萌发过程中ABA 含量增加与其合成、信号转导及分解代谢途径基因有着密切的关系。汁液处理的黄瓜种子ABA 含量比对照高且呈先下降后上升再下降的趋势,这和王慰亲[30]、胡琦娟[31]和Frey 等[32]研究结果一致。NCED1和NCED2是控制ABA 生物合成的关键基因,这两个基因的表达量在种子萌发过程中出现上升趋势,证明黄瓜种子中ABA 含量增加与这两个基因表达上调有关。ABA信号转导途径基因CsPYL2、CsPP2C2、CsSnRK2表达量增加,这和干旱条件下黄瓜幼苗ABA 信号转导途径基因CsPYL2、CsPP2C2、CsSnRK2表达上调和ABA 大量增加的结果一致[33],这说明ABA 含量增加与这3 个信号转导基因表达量增加有关。此外,汁液处理后ABA 代谢基因CsCYP707A1表达量增加,这与CsCYP707A1、AtCYP707A2在种子萌发过程中被外源ABA 诱导促使其表达上调[20,34]和拟南芥(Arabidopsis thaliana(L.)Heynh.)种子吸胀24 h 后CYP707A1表达量增加[35]的研究结果相似。CYP707A2主要负责种子休眠释放和萌发过程中ABA 降解,虽然CYP707A1也参与种子中ABA 的分解代谢,然而它在打破休眠中的作用很小[36]。基于这些研究,本文表明汁液处理的种子CsCYP707A1表达量虽高,但其编码的酶不足以分解汁液诱导增加的ABA,因此种子并未萌发。此外,ABA 合成基因CsNCED2与代谢基因CsCYP707A1和信号转导基因CsPYL2、CsPP2C2、CsSnRK2有着一致的表达趋势,说明CsNCED2与这4个基因关系密切。大麦(Hordeum vulgareL.)HvNCED2在ABA 生物合成和防止采前发芽方面比HvNCED1发挥更重要的作用[36],本研究所用材料为易胎萌黄瓜品种种子,CsNCED2可能与HvNCED2发挥相似的作用。由此可见,高浓度汁液处理种子可上调ABA 合成、代谢及信号转导途径基因的表达,进而促进ABA 合成和抑制种子萌发。
4 结论
难胎萌黄瓜(M‑H)内果皮汁液及其乙醇和正丁醇提取液均抑制易胎萌黄瓜(C‑L)种子萌发。在M‑H 内果皮汁液中鉴定到4 种影响种子萌发的化学成分:肉豆蔻酸、棕榈酸、柠檬酸和组氨酸,它们可能促使ABA 合成基因CsNCED2及信号转导基因CsPYL2、CsPP2C2、CsSnRK2表达量增加,进而提高ABA 含量,同时阻碍可溶性糖代谢,从而有效降低C‑L 种子萌发率。