52 个马铃薯遗传多样性分析及SSR 分子身份证构建
安苗 王彤彤 付逸婷 夏俊俊 彭锁堂,2 段永红
(1. 山西农业大学农学院,晋中 030600;2. 山西蓬勃农业科技股份有限公司,大同 037000)
马铃薯(Solanum tuberosumL.)是世界四大主要粮食作物之一,在全世界约162 个国家和地区均有种植。马铃薯富含丰富的营养成分,包括多种维生素及钙、钾等微量元素,且容易被消化,功能齐全,被称赞为“第二面包”。中国是世界上最大的马铃薯生产国[1-2],至今为止,种植历史约为400 多年,新中国成立以来至2017 年,我国育成马铃薯品种622 个,其中国家审定约65 个,明显落后马铃薯育种先进国家[3]。此外,我国育成的马铃薯品种亲缘关系近,表现出较相似的形态特征,难以通过形态标记准确鉴别。在当前马铃薯生产中,存在“同名异品种”“同品种异名”的现象,因此,如何对马铃薯种质资源进行精确、快速的鉴别,并选择优良的杂交组合来培育新品种,是亟需解决的难题[4]。
近年来,随着生物技术的发展,DNA 分子标记技术的诞生给作物遗传育种带来了新的机遇[5-6]。分子标记技术具有检测手段简便、扩增结果稳定、多态性丰富及快速高效等优点,克服了环境及不同生长阶段差异的影响,能够有效提高育种效率[7-8]。其中SSR 分子标记(simple sequence repeats,简单重复序列)作为第二代标记技术,具有共显性、位点特异性和可重复性高等特点,被国际植物新品种保护联合会(UPOV)认定为鉴定植物品种的最强手段[9]。SSR 分子标记已经成功应用于花生(Arachis hypogaeaL.)[10]、黄瓜(Cucumis sativusL.)[11]和甜瓜(Cucumis meloL.)[12]等植物的纯合子鉴定和单倍体鉴定。Tiwari 等[13]使用14 个SSR 引物分析野生马铃薯物种的等位基因变异,检测到82 个多态性SSR 标记。de Haan 等[14]利用15 对SSR 引物对900多份秘鲁地方品种和100 多个外来种质进行比较,检测到173 个等位位点,其中2 个群体共有129 个等位位点,占总数的74.60%。Sharma 等[15]采用SRAP、SNP 标记,并结合SSR DNA 分子标记技术,对40 多个马铃薯品种进行多态性分析,结果显示3种标记均可区分40 多个品种。段艳凤[16]、王鹏等[17]、王若秋等[2]、高玉坤等[18]对马铃薯品种(系)的遗传多样性进行了SSR 标记分析,并构建了相应马铃薯品种(系)的DNA 分子身份证。刘春雷[19]利用EST‑SSR 引物分析了44 份马铃薯品种资源的亲缘关系,并构建指纹图谱。山西是我国马铃薯的主产区,晋北地区是山西马铃薯的主要种植地,引进、筛选不同的马铃薯品种(系),助力当地马铃薯产业的发展,但对其遗传背景不明晰,影响了马铃薯新品种选育的进程。
为明确山西主要种植及推广的马铃薯品种(系)的亲缘关系,对其遗传多样性进行评价,明晰其遗传背景。本研究采用SSR 分子标记,分析52 份马铃薯种质(系)间的DNA 水平的遗传差异,明确其亲缘关系的远近,并筛选特异性引物构建马铃薯的分子身份证,为马铃薯种质资源的亲缘关系分析、分类鉴定以及育种材料的选择提供依据。
1 材料与方法
1.1 材料
选用52 个马铃薯品种(系),均由山西蓬勃农业科技股份有限公司生产,材料信息见表1,于2022 年6 月1 日种植在山西省大同市左云县北十里村马铃薯脱毒种薯示范基地(112°34' E, 39°44' N),海拔1 295 m,无霜期125 d。马铃薯以高垄种植的方式播种,株距45 cm,行距60 cm。

表1 供试马铃薯品种(系)Table 1 Potato varieties(line)in the research
1.2 方法
1.2.1 马铃薯基因组DNA 提取 摘取马铃薯幼嫩叶片,用改良的CTAB 法提取基因组DNA[20],0.8%琼脂糖凝胶电泳检测DNA 质量,使用核酸蛋白检测仪测定DNA 浓度,之后将样品DNA 稀释为50ng/μL,置于‑20℃冰箱保存,备用。
1.2.2 马铃薯SSR 标记分析 本试验选用25 对SSR引物,来源于相关文献[8,21-26]使用的引物,由上海生工生物工程股份有限公司合成,其引物序列见表2。

表2 SSR 引物名称和序列Table 2 SSR primers name and sequences
SSR‑PCR 扩增体系:体系总容量为10 μL,含1 μL 样品DNA(50 ng/μL),5 μL Mix,上游和下游引物各1 μL,ddH2O 2 μL。
扩增程序: 94℃预变性5 min;94℃变性30 s,55℃退火45 s,72℃延伸90 s,5 个循环;95℃变性30 s,53℃退火45 s,72℃延伸90 s,72℃延伸10 min,35 个循环;4℃反应终止,自动保存。以50 bp DNA Ladder Marker 作为分子量标记,产物经8%聚丙烯酰胺凝胶电泳分析,恒压170 V,电泳2 h,用银染法显色后,放在凝胶观察灯上进行观察并拍照记录[27]。
1.2.3 数据分析 电泳结束后采取人工读带方式,按照“0/1”赋值法进行SSR 多态性条带统计,在扩增位点中,清晰可见、可重复的条带用“1”表示,在同一位点上,缺失或弱带标记为“0”。根据基因组DNA 片段大小依次记录,将数据输入Excel 2010软件构建“0、1”二进制模型。计算各引物扩增的总条带数、多态性条带数。
通过PIC 值(polymorphism information content)对引物多态性进行评估。计算公式为:PICi=1-∑Pij2,Pij表示标记i 的第j 个等位基因的频率[28]。
利用POPGENE version 1.31 软件计算观测等位基因数(Na)、有效等位基因数(Ne)、Nei's 遗传多样性指数(H)、Shannon's 信息指数(I);利用NTSYS pc version 2.00e 软件,通过Qualitiative data模块计算参试材料间的遗传相似系数,SASYS 模块以非加权配对算术平均法(UPGMA)对品种(系)进行聚类分析[29-30],Tree plot 模块绘制树状聚类图,根据不同SSR 标记对条带的结果依次排序,采用二维码技术(https://cli.im/)将材料基本信息(包括名称、统一编号、来源地、字符串DNA)转化为可扫描的二维码,即二维码DNA 分子身份证。
2 结果
2.1 马铃薯SSR引物多态性分析
本试验前期从25 对SSR 引物中筛选出16 对具有较高多态性且条带清晰的引物,多态引物比率为64.54%。16 对多态性SSR 引物共检测到217 个等位位点,平均每对引物检测位点13.56 个,引物C59 检测出的位点数最高为26 个,引物C3 检测到的位点最低为4 个;多态位点百分数介于28.57%-100.00%之间,均值是64.71%,引物C59 检测到的多态位点最高为100.00%,引物STM1016 最低为28.57%;观测等位基因数(Na)介于1.50-2.00 之间,平均数为1.96;有效等位基因数为(Ne)介于1.07-1.38,平均为1.21;Nei's 遗传多样性指数(H)介于0.06-0.24,平均为0.14;Shannon's(I)在0.13-0.39之间,平均为0.24。多态性引物检测位点信息见表3,引物C59 对马铃薯品种(系)的扩增结果见图1。引物多态性信息含量(PIC)介于0.02-0.30,平均为0.15。其中,引物C3 的PIC值最高,S151 的PIC值最低。16 对引物中有1 对引物为中度多态位点(0.25 ≤PIC≤0.50)[31]。

图1 引物C59 对马铃薯基因组DNA 的扩增结果Fig. 1 Amplification results of genomic DNA of potato with primer C59
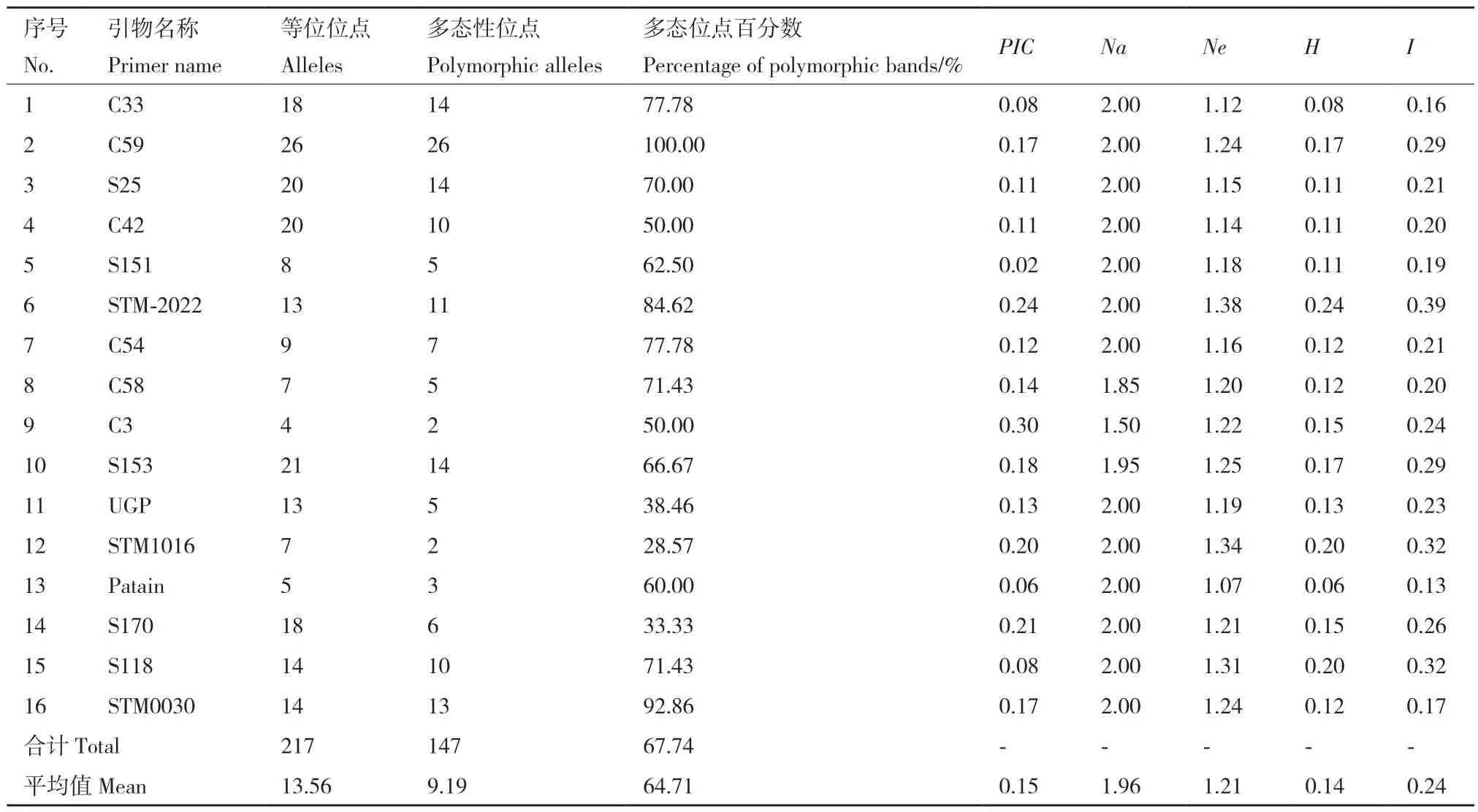
表3 SSR 引物扩增结果Table 3 Amplification results of polymorphic SSR primers
2.2 SSR引物多态性参数相关分析
由表4 可得,有效等位基因数(Ne)与Nei's遗传多样性指数(H)、Shannon's 信息指数(I)均呈极显著正相关(P<0.01),相关系数分别为0.961、0.903;Nei's 遗传多样性指数(H)与Shannon's 信息指数(I)也呈极显著正相关(P<0.01),相关系数为0.982;引物的多态性信息含量(PIC)与观测等位基因数(Na)、有效等位基因数(Ne)、Nei's遗传多样性指数(H)、Shannon's 信息指数(I)均呈显著正相关(P<0.05),相关系数依次为:0.571、0.558、0.586、0.542。表明有效等位基因数(Ne)、引物的多态性信息含量(PIC)可以作为评价不同品种(系)马铃薯遗传多样性的参数。
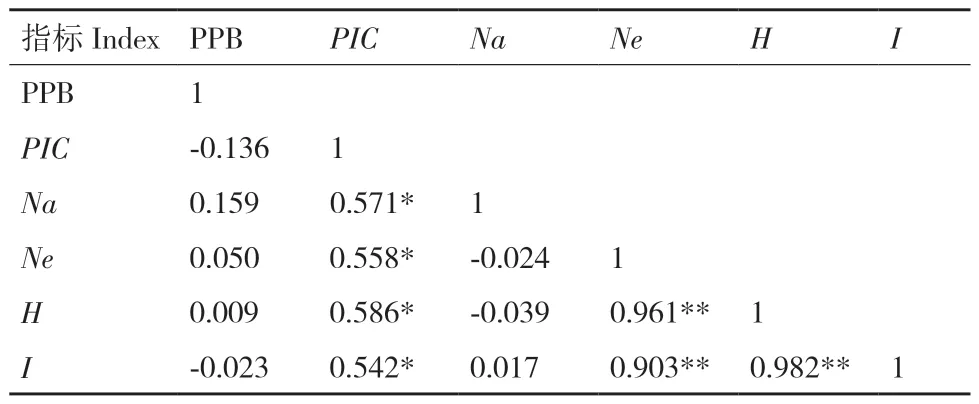
表4 各参数的相关性分析Table 4 Correlation analysis of each parameter
2.3 马铃薯亲缘关系聚类分析
经分析,52 个马铃薯品种(系)间遗传相似系数范围是0.01-0.91,变幅为0.89。其中‘东农310’和‘克新25’、‘陇薯20 号’和‘北方016’的遗传相似系数最高,为0.91,表明两者的遗传距离最小;‘北方016’和‘石薯1 号’、‘北方016’和‘石薯3 号’遗传相似系数最低,均为0.01,说明他们之间的遗传距离最大。聚类分析得到52 份供试材料间的遗传关系(图2)。
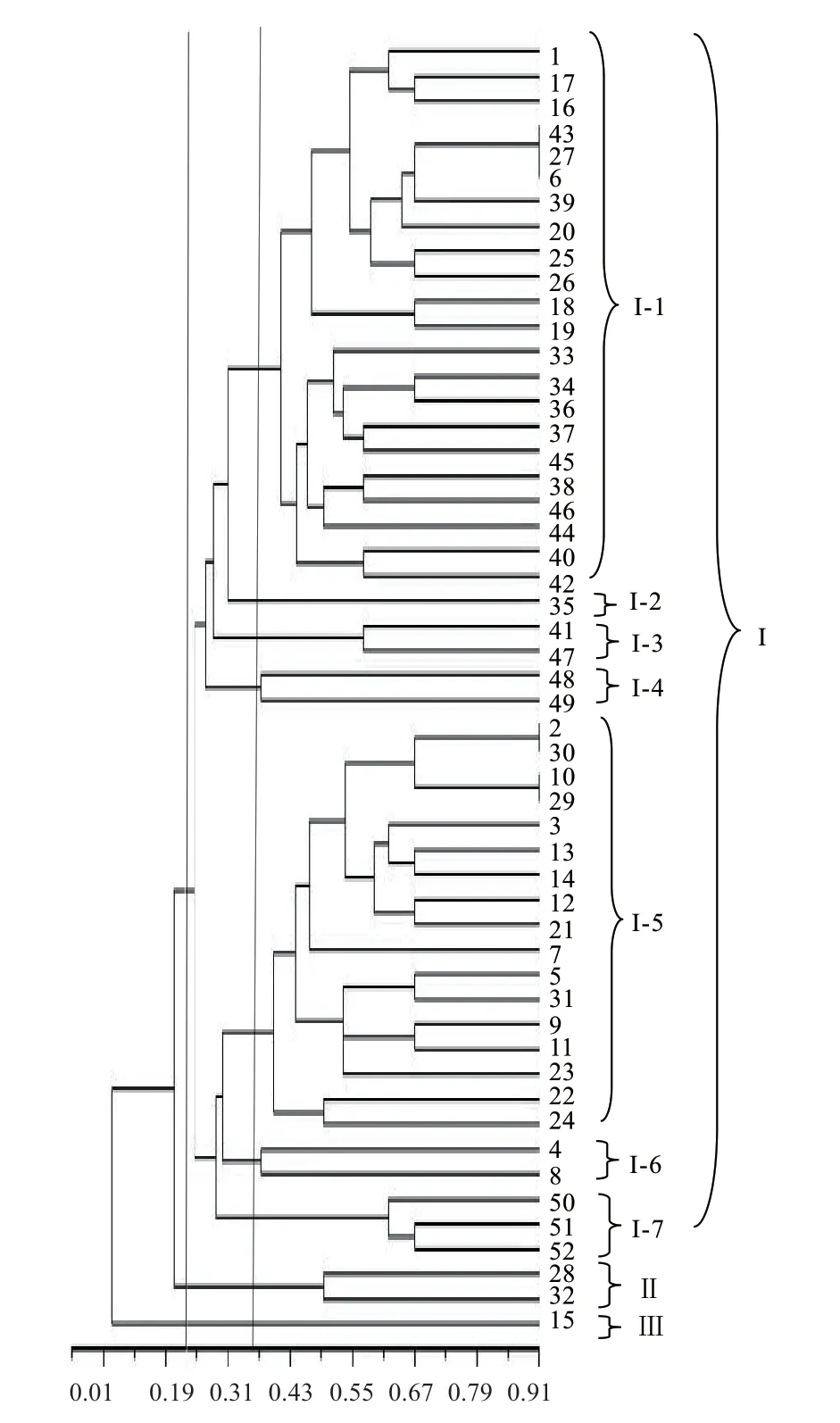
图2 基于SSR 标记的52 份马铃薯品种(系)聚类图Fig. 2 Clustering diagram of 52 potato varieties(lines)based on SSR marker
在遗传相似系数为0.23 处,可将52 份品种(系)分为3 大类。类群I 所含的材料最多,包括49 个品种(系),其中,46 个是北方品种(系),3 个是国外引进品种(系);类群II 包括2 个品种,‘北方016’和‘晋薯16 号’,其特点是干物质含量高、薯皮黄色;类群III 仅包括‘晋薯15 号’。在遗传相似系数0.36 处,类群I 又可以分为7 个亚类。第1 亚类含有21 个品种(系),均为抗性较强的品种(系),其中包括‘民丰红’‘雪川红’‘黑金刚’‘紫玫瑰’,均为彩色马铃薯,‘V7’‘荷兰806’为国外引进品种,‘蓬勃2 号’‘蓬勃1 号’‘大同里外黄’为地理来源相同的品种,‘青薯10 号’和‘V9’由青海省农林科学院选育而成。第2 亚类含有1 个品种‘石薯3 号’;第3 亚类包括‘中加2 号’与‘紫玫瑰’,均为中晚熟品种,抗病性强;第4 亚类也含有2 个品种为‘丽薯6 号’‘冀张薯12 号’,薯皮薯肉均为白皮白肉,中晚熟品种;第5 亚类有17 个品种(系),其中‘陇薯’系列的3 个材料(‘陇薯7 号’‘陇薯10 号’‘陇薯20 号’)、‘京张薯’系列的2 个材料(‘京张薯1号’‘京张薯3 号’)、‘中薯’系列的2 个材料(‘中薯306’‘中薯9 号’)、‘冀张薯’系列的2 个材料(‘冀张薯8 号’‘228’)、本溪市的2 个材料(‘476’‘石薯6 号’),根据地理来源划分在一个亚类;第6 亚类含有‘陇薯14 号’和‘青薯9 号’,其薯型均为椭圆形、浅芽眼;第7 亚类包括‘克新13’‘荷兰13’‘冀张薯12 号’,花冠均淡紫色。
2.4 不同品种(系)马铃薯指纹图谱构建
采用16 对多态性引物对52 个马铃薯品种(系)进行DNA 指纹图谱分析,引物C33、S25、S151 对马铃薯品种(系)的PCR 扩增结果的电泳条带见图3。在所选的16 对多态性引物中任何一对引物都只能区分部分品种。对16 对多态性SSR 引物的扩增谱带进行统计分析,综合考虑引物的SSR 多态条带比率(PPB)、PIC值大小和条带统计的难易程度,筛选出引物C59、C33、S25 和S151,共4 对引物可构建52 个品种(系)的指纹图谱。C59 扩增出的条带大小分别为180、170 和160 bp(图1);S25 扩增出的条带大小分别为180、170、160 和150 bp(图3‑A);C33 扩增出的条带大小分别为170、160、155和150 bp(图3‑B);S151 扩增出的条带大小分别为120、110、100、90 和85 bp(图3‑C)。利用4 对引物可以将马铃薯品种(系)正确区分,将每份材料对应的扩增结果转化为二进制“0/1”代码,得到每个品系独立的唯一编码,构成52 份马铃薯材料的“数字化指纹图谱”(表5)。
2.5 马铃薯品种(系)的分子身份证
使用在线二维码生成器展示52 个品种的实验结果,图4 中每个QR 编码图对应一个品种,编码的信息包括指纹图谱及SSR 电泳标记等信息,在生产中,可用于日常的品种鉴别和亲本选择,极大地提高生产效率,方便查看各品种的遗传信息。
3 讨论
3.1 马铃薯种质资源的遗传多样性
通过对种质资源进行亲缘关系分析、遗传多样性评价,能够了解种质资源的变异水平、遗传结构和背景,可为种质资源的开发、利用以及创新提供研究基础[31]。本研究利用SSR 标记分析马铃薯种质资源的遗传多样性,16 对多态性引物共扩增出217个条带,平均多态性位点百分率达64.71%,此结果低于张招娟等[32]的研究结果(96.60%),与高玉坤等[18]的研究结果(65.77%)相近。平均多态性百分率的高低可能与研究材料、选用引物及选用引物的数量相关。
3.2 马铃薯种质资源的聚类分析
本研究利用NTSYS pc version2.00e 软件进行聚类分析,将52 份马铃薯种质资源划分为3 个类群。其中类群I 最大,包含49 个品种(系),占总研究材料的94.23%,其中,46 个是北方品种(系),3 个是国外引进品种(系)为‘V9’‘V7’‘荷兰806’,均适宜晋北地区种植。46 个北方品种(系)未与类群II、类群III 聚为一类,即大类的划分上未按照地理来源进行聚类。但类群I 中的第5 亚类‘陇薯’系列、‘冀张薯’系列、‘石薯’系列、‘中薯’系列的研究材料,按照地理来源进行聚类被划分在同一类群。张海雯等[9]采用SSR 标记对62 份马铃薯材料进行遗传多样性研究发现,来源地相同的品种大多聚类为一个分支或距离较近的两组中,与本研究结果一致。同时发现,由相同育种单位山西农业大学高寒区作物研究所选育的‘晋薯16 号’与‘晋薯15 号’并没有聚为一类,‘晋薯16’以‘NL94014’作母本,用‘9333‑11’为父本配置杂交组合,通过有性杂交选育而成,‘晋薯15’以母本‘9341‑14’与父本‘9324‑2’杂交后定向选育,二者所采用的骨干亲本材料有差异,选育品种的目标性状不同,因而亲缘关系较远,未聚为一类。可能也与本研究中SSR 标记引物不多,检测位点有限有关。
3.3 马铃薯种质资源SSR分子身份证的构建
随着马铃薯主粮化进程的推进,马铃薯育种品种逐年增加,导致一些品种混淆,出现“同名异物”“同物异名”的现象。在分子标记的基础上利用二维码技术生成品种的分子身份证[33-34],可有效地解决马铃薯鉴定的难题,有利于马铃薯种质资源的鉴定以及溯源,有利于保护相关的知识产权。近年来,茶树[Camellia sinensis(L.)O. Kuntze.][35]、苹果(Malus pumilaMill.)[36]、 大豆[Glycine max(L.)Merr.][37]、小麦(Triticum aestivumL.)[38]等作物都在SSR 分子标记的基础上,构建了分子身份证。本研究中任何一对引物均无法区分52 个马铃薯品种(系),根据PIC值以及条带统计的难易程度,逐一加入引物对,对材料进行比较鉴定,直到把52 个供试材料区分开为止。依据利用尽量少的引物来区分品种原则,选择了C59、C33、S25、S151 共4 对引物构建了52 个马铃薯品种(系)的数字化指纹图谱。管俊娇等[39]也运用了SSR 标记技术对22 对引物所形成的电泳图谱进行分析发现,4 对引物的扩增结果组合起来能将22 份青花菜种质资源区分开。刘文林等[40]也运用了SSR 标记技术对23 对引物所形成的电泳图谱进行分析,构建了63 份马铃薯种质资源的分子身份证。程林涛等[41]同样运用此方法构建了80 份草地早熟禾种质的字符串、二维码和二维码分子身份证。本研究选用4 对多态性SSR 引物构建了52 个马铃薯品种(系)的数字化指纹图谱以及对应的分子身份证,可用于马铃薯种质资源的鉴定与溯源。
4 结论
本研究从25 对SSR 引物中筛选出多态性丰富、稳定性好的16 对引物,并对52 份马铃薯品种(系)进行SSR 扩增分析,共检测到147 个多态性条带,引物平均多态条带比率为64.71%。基于最少引物鉴定最多种质的原则。利用C59、S25、C33、S151 共4 对引物组合,构建了52 个马铃薯品种(系)的数字化指纹图谱以及分子身份证,可用于马铃薯种质资源的鉴定与溯源。