陆地棉与瑟伯氏棉远缘杂交后代性状鉴定与遗传分析
候林慧 郑赟 荣二花 吴玉香
(山西农业大学农学院,太谷 030801)
棉花俗称“白色黄金”,是世界上最重要的纺织纤维作物,是纺织工业的重要原料,也是重要的油料作物[1]。中国是世界上最大的棉花生产国和消费国,自1949 年以来培育的优质陆地棉品种为棉花生产作出了巨大贡献[2]。棉花栽培种经过长期的定向培育和定向驯化,遗传基础逐渐狭窄,使棉花栽培种容易受到生物和非生物胁迫。棉属野生种由于环境差异和长期自然选择,形成丰富的遗传多样性,具有许多优良性状,如抗病虫、抗寒、耐干旱、耐盐碱等[3-4],成为可被棉花育种应用的优质种质资源。利用野生棉种在栽培棉基因库中注入新的遗传变异,以保护其抵御农业环境的挑战[5]。棉属野生种瑟伯氏棉具有很强的抗虫性,还具有抗寒性和抗黄萎病的特性,能经受‑8℃- ‑6℃的低温,瑟伯氏棉潜在的优良纤维特性是纤维高强力的来源[6]。通过远缘杂交将野生棉的优良基因转移到陆地棉中创制优异种质材料,是拓宽陆地棉遗传基础的有效途径。
21 世纪初,野生棉优良的种质资源已经得到了我国科研工作者的关注。潘家驹等[7]认为野生种瑟伯氏棉可作为黄萎病的理想抗原,瑟伯氏棉对黄萎病具有高抗性。梁理民等[8]通过陆地棉与斯特提棉的远缘杂交,培育出抗病的新品种秦远4 号。李爱国等[9]通过海×瑟×陆杂交,成功合成三元杂种一代,并通过多代的选育成功选育出新品种冀棉24号。Cai 等[10]通过对瑟伯氏棉进行冷胁迫,探讨了瑟伯氏棉的抗寒机制和新的抗寒调控网络,为创造抗寒性的棉花种质资源奠定了基础。Gan 等[11]通过荧光原位杂交对瑟伯氏棉和它的姐妹种以及四倍体栽培种海岛棉进行染色体核型分析,为进一步研究D 组棉种的细胞遗传学和基因组学提供了一个新方向。
陆地棉产量高、抗逆性强,但由于长期的种植,遗传基础狭窄,国内外对陆地棉与瑟伯氏棉的远缘杂交报道较少,由于瑟伯氏棉的抗寒性、抗病性等优势,将这些抗逆性的优良基因通过远缘杂交导入栽培棉陆地棉中,对提高棉花的抗性和拓宽遗传基础至关重要。
本研究选用中棉所16 号陆地棉为母本,瑟伯氏作父本进行远缘杂交,合成F1并对其加倍,成功合成人工异源六倍体,对其进行形态学、细胞学等观察,并对其进行生理生化和SSR 分子标记鉴定,筛选出育性稳定且综合农艺性状优良的异源六倍体。
1 材料与方法
1.1 材料
母本陆地棉品种中棉所16 来源于中国农业科学院棉花研究所,父本野生瑟伯氏棉来源于国家种质三亚野生棉圃。具体信息见表1。

表1 研究材料基本信息Table 1 Basic information of research materials
1.2 方法
1.2.1 试验设计 陆地棉作母本P1,野生瑟伯氏棉作父本P2,进行远缘杂交,获得三倍体杂种F1,对F1幼苗进行多倍体诱变得到M0代植株,将M0代植株所得种子播种得到M1代(AADDCC)植株,对4个不同世代P1、P2、F1和M1进行比较鉴定。所用材料均以盆栽的方式保存于山西农业大学农学院温室。
1.2.2 远缘杂交 早上6:00 左右,将母本陆地棉未开放的花去雄,套上蜡管待用,上午9:00 以后,用父本瑟伯氏棉的花粉给去雄的母本陆地棉授粉,继续套上蜡管,滴加25 mg/L 赤霉素保铃。
1.2.3 多倍体诱变 将种子在培养皿中育苗,待幼苗的种皮脱落,放入广口瓶培养,待子叶展开之时,将0.2%的秋水仙碱凝胶包裹在幼苗的生长点,盖上透明罩,保证凝胶水分不流失,48 h 后清除凝胶,冲洗干净,继续培养,保证幼苗健康生长。
1.2.4 形态学鉴定 对长势较好的父母本和杂种F1以及诱变后的异源六倍体植株进行形态观察,并拍照,包括花、叶片和植株。进入花期之后,对各世代的花进行比较,对各世代的花瓣、苞叶的大小、柱头的长短以及花药的数量进行比较。棉花进入蕾期后,对各世代无虫害、病害,健康的叶片进行叶长、叶宽和叶面积的测量,同时进行颜色和形状的比较,从形态学的角度对各世代进行比较鉴定。
1.2.5 细胞学观察
(1)气孔保卫细胞和叶绿体数测定。取不同世代生长良好的叶片洗净,切取主叶脉周围1 cm×1cm 大小叶片浸于卡诺氏固定液(无水乙醇∶冰乙酸=3∶1)中脱色10 h 以上;将脱色后的叶片用蒸馏水清洗几次,取2 mm×2 mm 置于载玻片上,下表皮朝上,用1%的I2‑KI 溶液(2 滴)染色2-5 min,盖上盖玻片;分别在显微镜10×40 倍和10×100 倍下统计气孔密度(每个世代各取10 个不同视野),以及测量气孔长度和统计叶绿体数(每个世代各取30 个气孔作为重复)。
(2)花粉母细胞减数分裂及花粉粒统计。在不同世代的开花期,取长3-5 cm 的花蕾,放入卡诺氏固定液(无水乙醇∶冰乙酸=3∶1)之中,12 h 之后将其转移到酒精中,观察时将花蕾置于干净的滤纸上,用干净的解剖针取4-6 个花药置于干净载玻片上,用卡宝品红染液(2 滴)进行染色,用解剖针将花粉母细胞挤出,将肉眼可见的杂质去除,盖上盖玻片,在酒精灯上微热,将其固定,最后用滤纸覆盖染色区域,轻压吸去多余的染液。镜检,观察不同世代的减数分裂行为,统计多分体和花粉粒的数量,共统计600 个花粉母细胞。
1.2.6 生理生化指标鉴定 取生长状况良好、均一的亲本、杂种和多倍体植株第五节位的叶片,重复3 次。用愈创木酚显色法测定过氧化物酶(peroxidase,POD)活性,氮蓝四唑(nitro‑blue tetrazolium, NBT)光化还原比色法测定超氧化物歧化酶(superoxide dismutase, SOD)活性,紫外吸收法测定过氧化氢酶(catalase, CAT)活性,参照Nakano 等[12]方法测定抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性,硫代巴比妥酸比色法(thiobarbituric acid, TBA)测定丙二醛(malondialdehyde, MDA)含量,考马斯亮蓝G‑250 染色法[13]测定可溶性蛋白含量。
1.2.7 SSR 分子标记鉴定 采用SSR 分子标记鉴定对各世代进行多态性鉴定,利用CTAB 法对各世代进行DNA 的提取,材料必须选用各世代的幼嫩叶片,SSR‑PCR 反应体系包含5 μL 2×Taq PCR MasterMix(含染料)、2 μL 正向和反向引物(10 μmol/L)、2 μL去离子水、1 μL 模板DNA(50 ng/μL)。扩增程序为94℃ 5 min;94℃ 45 s,35℃ 45 s,72℃ 1 min,5 个循环;94℃ 45 s,52℃ 45 s,72℃ 1 min,35 个循环;72℃ 10 min;4℃保存。8%非变性聚丙烯酰胺凝胶电泳检测,银染,显影。SSR 引物序列来自申状状等[14]文献,由生物工程股份有限公司合成,引物序列见表2。

表2 SSR 引物序列信息Table 2 SSR primers sequence information
1.2.8 数据统计分析 数据使用Microsoft Excel 和SPSS 软件进行统计分析和作图。
2 结果
2.1 形态学鉴定结果
各世代的花形态差异很大,由图1 可知,父本瑟伯氏棉花的形状近似椭圆形,母本陆地棉的花瓣近似于三角形,杂种三倍体的花大于父母本,其苞叶是介于父母本之间,花瓣形状近似扇形,大小介于双亲之间,花蕊大小与母本无显著差异,与父本存在显著差异,花药数量介于双亲之间,颜色为淡黄色。与母本一致,弱于父本,无花斑。异源六倍体花的大小略大于杂种三倍体,但是差异不显著,花瓣近似扇形,与杂种三倍体相似,花瓣与父本相似都有褶皱,花瓣边缘较为平滑,无明显锯齿,有淡红色的花斑。苞叶大小介于双亲之间,与杂种三倍体相似,花蕊大小与父母本、杂种三倍体存在显著差异,花药数量大于双亲和杂种三倍体,颜色为橙黄色(图2)。

图1 不同世代花的解剖图和花蕊的比较Fig. 1 Comparison of flower anatomy and stamens of different generations

图2 不同世代花的形态比较Fig. 2 Comparison of flower morphologies in different generations
各世代的叶片也存在显著差异,母本P1陆地棉叶片较大,颜色深绿,有5 裂,叶裂较浅,有茸毛;父本P2瑟伯氏棉叶片较小,颜色浅绿,有3 裂,无茸毛;杂种F1有2 种叶形,一种介于双亲之间,另一种叶片略大,颜色浅绿,叶裂披针形,较深,且3-5裂都有;六倍体后代M1也有2 种叶形,与杂种相似但是更大,出现了宽披针形叶裂。由图3 可以看出,不同倍性棉花的叶面积存在显著差异,倍性增加会使叶面积增加,但是叶型并无规律可循,P1和F1的叶型指数并无显著性差异。

图3 不同世代叶片的比较Fig. 3 Comparison of the leaves in different generations
2.2 细胞学鉴定结果
为了验证三倍体和六倍体的育性,通过对杂种三倍体和异源六倍体的减数行为分别进行观察,二者的减数分裂均有正常和异常行为(图4),三倍体中的多分体较多,多于正常的四分体,而六倍体植株,正常四分体明显增多。由表3 可知,在三倍体植株的600 个多分体中,单分体有73 个,二分体有25 个,三分体有38 个,正常四分体有146 个,多分体有318 个,分别占比为12.17%、4.17%、6.33%、24.33%和53.00%。在六倍体植株的600 个多分体中,单分体有63 个,二分体有15 个,三分体有17 个,正常四分体有493 个,多分体有12 个,分别占比为10.50%、2.50%、2.83%、82.17%和2.00%。
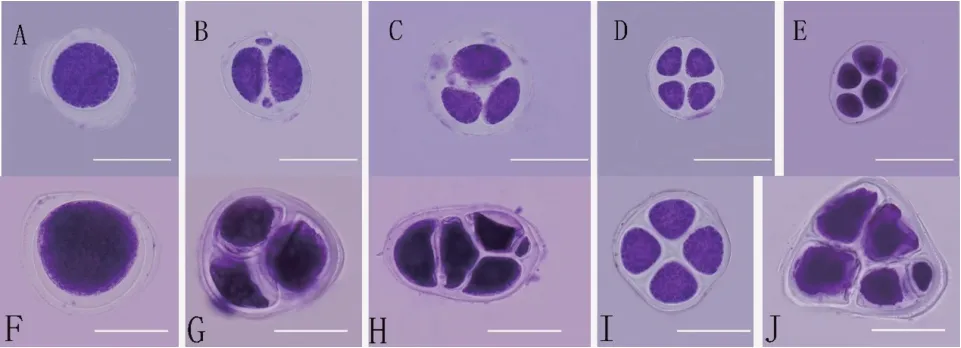
图4 不同世代减数分裂行为的对比Fig. 4 A comparison of meiosis behaviors in different generations(Bar=20 μm)

表3 各世代减数分裂的对比Table 3 Comparison of meiosis in different generations
叶片的气孔性状是指气孔的大小、气孔密度和保卫细胞对中的叶绿体数,是判断植物倍性的重要细胞学指标。通过对杂种三倍体和异源六倍体进行气孔性状的统计分析(图5,表4),结果表明,杂种三倍体和异源六倍体植株在气孔密度、气孔长度和叶绿体数上都存在着显著差异(P<0.05);随着倍性的增加,气孔密度呈下降趋势,而气孔长度和叶绿体数均呈上升趋势。本研究结果和前人研究结果一致[15]。

图5 不同世代的气孔的比较Fig. 5 Comparison of stomatas in different generations(Bar=20 μm)
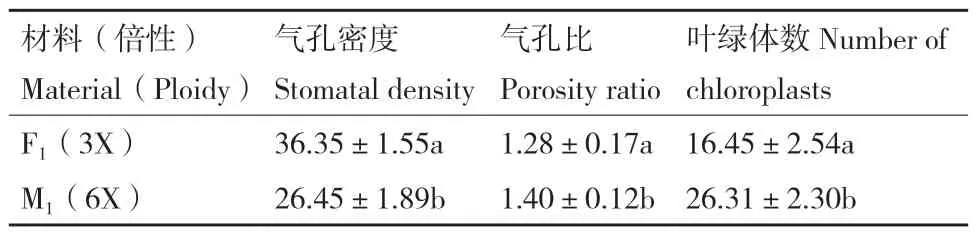
表4 各世代气孔的比较Table 4 Comparison of stomatas in different generations
2.3 生理生化指标鉴定结果
2.3.1 酶活性比较 酶活性是生物体内最直观的生理生化反应指标。本研究主要对超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)以及丙二醛(MDA)和可溶性蛋白的含量进行了测定。这些都是植物体内普遍存在且发挥重要作用的酶。由图6 可以看出,不同倍性棉花的POD 含量存在极显著差异,SOD、CAT、APX 的含量存在显著差异;4 种酶含量的大小顺序都是M1>P1>F1>P2,酶的活性呈现出随不同世代染色体数目的增加而升高的趋势,因此,不同材料酶活性的差异可以在一定程度上反映倍性的差异。
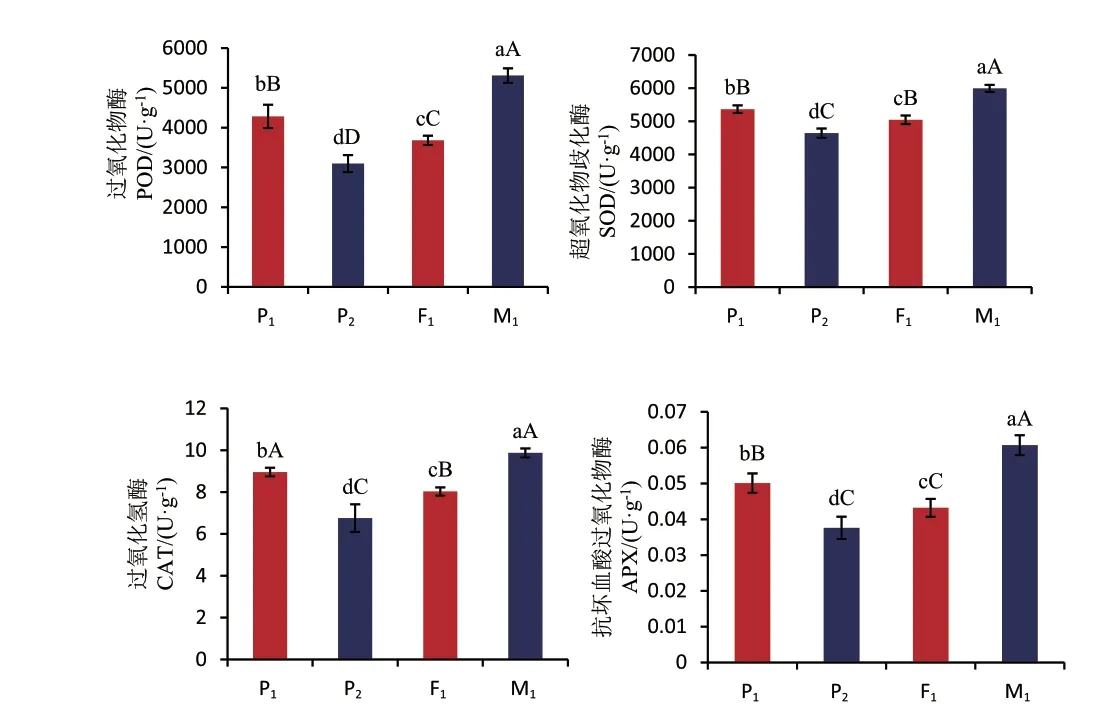
图6 各世代酶活性的比较Fig. 6 Comparison of enzyme activities in different generations
2.3.2 代谢产物的含量 由图7 可以看出,不同倍性棉花的MDA 含量存在显著差异,由大到小的顺序是P2>F1>P1>M1,随倍性的增长MDA 的含量出现了负增长的情况,这可能由于M1细胞内抗氧化酶含量高促使MDA 维持在较低水平;可溶性蛋白含量也随倍性的变化存在显著差异,由大到小的顺序是M1>P1>F1>P2。因此,不同材料生理生化反应的代谢产物之间会有明显不同,也可以在一定程度上反映倍性的差异。
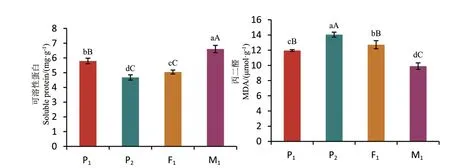
图7 各世代代谢产物含量的比较Fig. 7 Comparison of metabolite contents in different generations
2.4 SSR分子标记鉴定结果
为了进一步鉴定杂种三倍体(F1)和异源六倍体,对母本陆地棉、父本瑟伯氏棉、杂种三倍体(F1)和异源六倍体植株进行SSR 分子标记鉴定,通过实验室前期筛选出的13 对引物,对13 组条带进行多态性分析,由表5 可知,共有185 条清晰条带,其中母本有34 条,父本有21 条,杂种三倍体有59条,异源六倍体植株有61 条,重组条带分别为4 和6 条,其中,杂种三倍体34 条来自母本,21 条来自父本,4 条为杂种三倍体特有条带,异源六倍体中有34 条与母本相同,有21 条与父本相同,6 条为特有带,其中4 条特有条带与杂种三倍体特有条带一样,有2 条是六倍体植株特有条带,在这13 对引物中,条带的分子量都保持在500 bp 之内,在引物NAU1355、NAU1169 和NBRI_GM7 扩增结果中(图8),既扩增出父母本条带,也扩增出杂种和六倍体的特异性条带。结果表明,在母本陆地棉和父本瑟伯氏棉的杂交过程中可能引起了染色体重组和片段交换,后续验证还在进行中。同时表明陆地棉和瑟伯氏棉的杂种中存在丰富的遗传变异,SSR 分子标记鉴定结果分析证明该杂种是陆地棉和瑟伯氏棉的真杂种。

图8 SSR 分子标记在不同世代的扩增结果Fig. 8 Amplification results of SSR markers in different generations
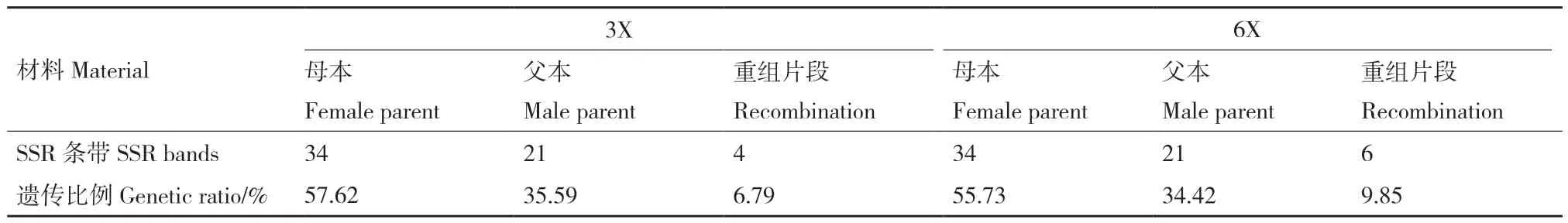
表5 不同世代的 SSR 多态性分析Table 5 Analysis of SSR polymorphism in different generations
3 讨论
3.1 远缘杂交及多倍化对棉花种质创新的重要性
远缘杂交是实现优良农艺性状从一个物种向另一个物种转移的有效途径,是种质创新的重要途径。棉花远缘杂交将野生种和栽培种的优良性状进行遗传重组,创造了大量的种间杂种材料并培育出许多高产、优质、抗逆性强的棉花品种[16]。远缘杂交之后,由于染色体组的差异,缺少同源染色体,生殖细胞减数分裂行为异常,导致不育或者杂种衰退,染色体加倍可以改善远缘杂种减数分裂的异常行为。通过多倍体实现基因组加倍是植物进化的一个重要过程,并在真核生物核基因组的进化中发挥了重要作用[17]。多倍体有多种类型,异源多倍体最为常见。异源多倍体经历了远缘杂交与多倍化2 个阶段,与杂种相比,异源多倍体表现出显著的优势,如更强的生长势与环境适应性。多倍化也是恢复育性的一种方法。申状状等[18]利用陆地棉与斯特提棉的杂种进行多倍体诱变,获得育性稳定且能够结铃的异源六倍体。
不同基因组通过远缘杂交和加倍进入同一细胞核后,新种质中存在大量重复基因和表达调控方式上的差异,会造成基因组组成和基因表达的强烈反应,如染色体重排、DNA 片段丢失、基因沉默,以及部分同源等位基因在功能和表达量上的分化。另外,有研究报道,在小麦和芸薹属等一些植物的多倍化过程中,经常会出现以快速的基因组重组和大量基因丢失为特征的二倍化过程,但在棉花和拟南芥等植物中,其基因组序列相对稳定,并没有表现出如此强烈的变化。因此,对远缘杂交种进行人工诱导染色体加倍,获得异源多倍体是远缘杂交种质稳定遗传的关键。远缘杂交及多倍化在许多植物的物种形成及进化过程中具有重要作用。
3.2 野生棉在棉花远缘杂交育种中的应用
棉属目前有55 个种,只有4 个栽培种,其余的均为野生棉[19],野生棉在抗逆性等方面都优于陆地棉,利用其有益农艺性状对提高栽培棉的产量和品质具有很大的作用,野生棉种和栽培棉种之间丰富的遗传多样性是棉花育种家进行遗传育种研究的宝贵资源。通过远缘杂交将野生棉的优良基因导入陆地棉中,创制出产量高、品质好、抗逆性强、抗病虫害等性状优良的新种质,如草棉(G.herbaceumL)和纳尔逊氏棉(G.nelsoniiFryx)的抗病性基因成功转入到陆地棉中[20],Chen 等[21]利用野生种澳洲棉与栽培种陆地棉进行远缘杂交,成功合成杂种三倍体,并对其进行诱变为异源六倍体,再将六倍体与野生种绿顶棉进行远缘杂交,成功合成三元杂种。通过花粉母细胞的减数分裂行为证实三元杂种的真实性。Meng 等[22]利用野生种异常棉对陆地棉的纤维品质和抗病虫害进行遗传改良,获取了异常棉中的优良基因,成功获得了可育的六倍体植株。Zheng等[23]利用细胞质雄性不育(CMS)将司笃克氏棉与陆地棉的杂交种进行了全基因组测序,为棉花种质创新提供新的思路和理论指导。Masoomi‑Aladizgeh等[24]利用了野生种G.robinsonii抗高温的特性,与陆地棉成功合成异源六倍体,并对其进行了抗高温的机理探究,揭示了热带棉花抗高温的分子机制。Wei 等[25]研究了野生二倍体棉(G. klotzschianum和G. davidsonii)对高盐胁迫(高达300 mmol/L NaCl)的初步反应,拓宽了对棉花耐盐机制的认识,为陆地棉抗盐遗传改良奠定了坚实的基础。本实验室前期成功合成了陆地棉与拟似棉、陆地棉与斯特提棉的杂种,并成功诱变为异源六倍体植株,后续筛选和性状鉴定还在进行中,期望能筛选出育性稳定且生产上有利用价值的新品种。
本研究以陆地棉为母本,瑟伯氏棉作父本,杂交合成陆瑟杂种,秋水仙碱成功加倍为异源六倍体植株,由于瑟伯氏棉具有抗寒性和抗黄萎病等特点,将杂种三倍体和异源六倍体植株进行温室活体保存,作为下一步抗逆性研究材料的筛选。
4 结论
陆地棉与瑟伯氏棉远缘杂种植株的性状介于双亲之间,异源六倍体植株略大于杂种三倍体,表现出显著的杂种优势及多倍化优势;细胞学结果表明三倍体杂种不育的主要原因,也证明了异源六倍体的育性在恢复;SSR 分子标记从分子水平证实了远缘杂种的真实性,同时表明杂种在杂交过程中发生了亲本的基因重组。