细胞特异性核酸适配体在疾病治疗中的应用
钟朝滨 朱龙佼 张博洋 张洋子 陈可仁 许文涛
(1. 中国农业大学食品科学与营养工程学院,北京 100083;2. 中国农业大学营养与健康系 食品精准营养与质量控制教育部重点实验室,北京 100083)
研究人员于1990 年发现了核酸适配体,证明与结合靶标具有高亲和力的核糖核酸(RNA)可以从一个大的RNA 文库中筛选出来[1]。随着研究的进展,发现了越来越多类型和数量的核酸适配体。核酸适配体可以特异性地结合到靶标物质上,由20-100 个核苷酸组成的单链脱氧核糖核酸(ssDNA)或核糖核酸(RNA)[2-3],一般通过指数富集的配体系统进化技术(SELEX),从由随机核苷酸组成的寡核苷酸文库中筛选得到。
核酸适配体可以折叠形成一个特定且稳定的三维结构,以高亲和力和特异性与靶标结合。平衡解离常数(KD)表示游离核酸适配体和游离靶标的结合程度,反映了核酸适配体与靶标分子的结合亲和力。高KD值表示核酸适配体与靶标分子的结合能力弱,表明核酸适配体对靶标的亲和力低;而低KD值则表示核酸适配体与靶标分子的强结合,表明核酸适配体对靶标的亲和力高[4]。一般来说,核酸适配体的KD值在皮摩尔到微摩尔的范围内[5]。抗体通常在纳摩尔到微摩尔范围内以非常高的亲和力结合靶标分子[6]。与抗体相比,核酸适配体对靶蛋白的亲和力相对接近甚至更高[7],并且核酸适配体可以替代常用的ELISA 中的抗体[8]。另外,核酸适配体的特异性结合靶点丰富,包括金属离子[9]、蛋白质[10]、病毒[11]、全细胞[12]等。与传统蛋白抗体相比,核酸适配体具有体积小、分子量低、靶标范围广、穿透力强、特异性高、易于化学修饰、稳定性高、无批次间差异、保质期长、毒性低、免疫原性低等优点[13]。核酸适配体的出现为生物医学领域提供了一个新颖、高效、快速的鉴定研究平台,发展迅速具有良好的应用前景。
传统药物以化学小分子为主。近年来,以抗体和细胞药物为代表的生物药物被广泛认可[14-15]。对核酸结构和功能的深入研究发现,它不仅可以作为疾病的生物标志物,而且可以作为疾病治疗药物。核酸药物具有良好的临床应用前景,如能够对化学药物或抗体药物无法靶向的位点进行特异性靶向和调控。因此,它们可能会对传统药物疗效不佳的疾病产生突破性影响[16]。功能性核酸治疗剂是疾病治疗的发展趋势。目前,核酸药物种类繁多,包括核酸适配体[17]、反义寡核苷酸[18]、siRNA[19]、核酶[20]、脱氧核酶[21]和CpG 寡核苷酸[22]等。其中,核酸适配体是功能性核酸研究中的重中之重,相较于其他核酸药物,它不仅具有低药物毒性、低免疫原性的特征,而且它的靶向位点更加丰富,可以直接作为药物影响靶点的生理活性与下游通路,也可以作为靶向递送工具递送传统药物。细胞是人体最基本的组成单元,大量的疾病发病与进展都是由于细胞发生非正常生理变化而导致。因此越来越多的研究关注于细胞以开发疾病治疗的策略,细胞特异性核酸适配体的研究应运而生,逐渐成为疾病治疗策略开发的重要发展方向。
本文总结了细胞特异性核酸适配体作为一种功能性核酸在疾病治疗中的研究进展,从细胞特异性核酸适配体的靶向位点、功能到其在各种疾病治疗中的应用,包括作为靶向工具改善细胞状态、募集细胞和治疗药物,以期为其在人类疾病治疗中的应用提供参考(图1)。
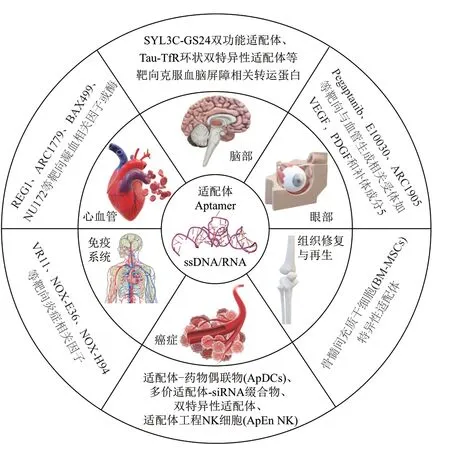
图1 细胞特异性核酸适配体在疾病治疗中的应用Fig. 1 Application of cell-specific nucleic acid aptamers in disease treatment
1 细胞特异性核酸适配体
1998 年,Morris 等[23]改进并完善了SELEX,筛选出红细胞膜上所有组分的核酸适配体并进行了解析,这是细胞特异性核酸适配体的首次筛选,此后的几十年,针对细胞的适配体被大量开发。细胞特异性核酸适配体的独特之处在于它们的特异性靶标是细胞成分,并且越来越多的研究表明,它们可以通过靶向与细胞生长和代谢相关的物质,或者作为靶向递送工具,直接或间接地影响细胞内生理活动或细胞外微环境。因此,细胞特异性核酸适配体引发了广泛关注,并已用于细胞靶点的发现[24]、疾病诊断[25]、药物递送[26]和免疫疗法[27]。
2 细胞特异性核酸适配体的临床现状
核酸适配体的理性筛选、裁剪和修饰促进了核酸适配体的开发研究,并发展出了多种应用。特别是细胞特异性核酸适配体在疾病治疗中显示出巨大的潜力和适用性。它们不仅可以作为识别特定靶标的简单诊断成像和递送工具,而且还可以作用于靶标分子来激活或抑制下游通路,或作为拮抗剂阻断蛋白质或受体配体相互作用。
目前,许多有重要意义的细胞特异性核酸适配体仍在开发和测试阶段,已有11 种核酸适配体被临床转化,并处于临床研究的不同阶段(表1)。这些核酸适配体的治疗范围包括眼部疾病、凝血、肿瘤和炎症。其中就有针对眼部疾病的年龄相关性黄斑变性(AMD)。除此之外,这些核酸适配体针对的疾病还包括冠状动脉疾病、急性心肌梗死、嗜血症、白血病、2 型糖尿病、蛋白尿、慢性贫血等,通常通过注射给药进行治疗。还有一些核酸适配体尚未进入临床试验,但已显示出巨大的临床应用潜力,如多价核酸适配体和环状核酸适配体。
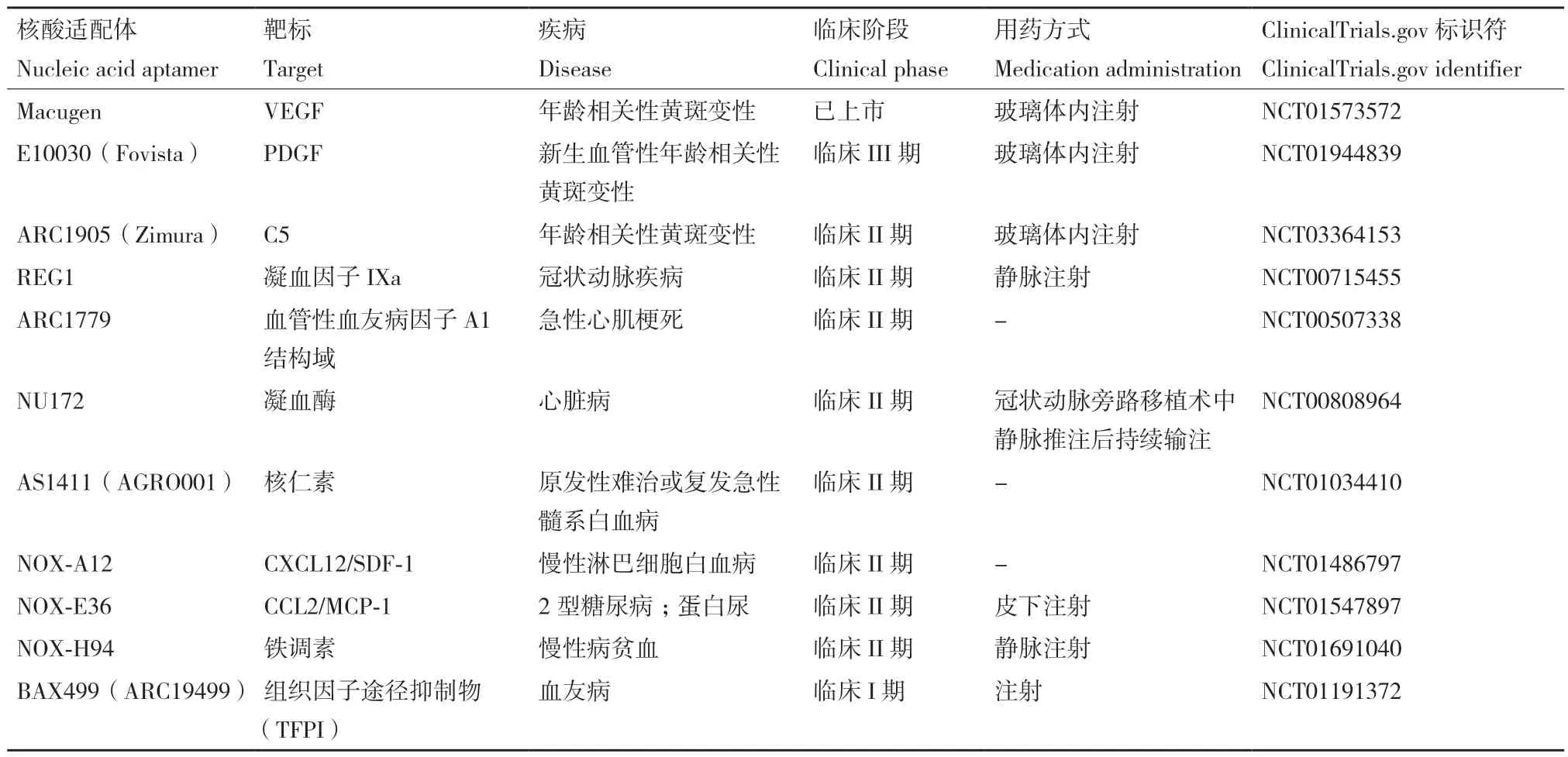
表1 进入临床试验中的核酸适配体Table 1 Nucleic acid aptamers entering clinical trials
3 细胞特异性核酸适配体的筛选方法
为了筛选得到细胞特异性核酸适配体,研究人员以SELEX 技术为基础开发了针对细胞的Cell‑SELEX 技术(图2)[28],使得细胞特异性核酸适配体的开发得到迅速发展。Cell‑SELEX 是以完整的细胞为靶标,筛选特异性核酸适配体的方法,所选的正筛细胞靶标通常是与某些疾病相关的病变细胞,再选择相对应的正常细胞作为反筛细胞,还需要合成一个随机的核酸序列文库,通常是由两端含有引物序列,中间含有20-100 个随机核苷酸组成。

图2 细胞特异性核酸适配体的筛选方法Fig. 2 Screening methods for cell-specific nucleic acid aptamers
在适宜的条件下分别培养正筛和反筛细胞至合适密度,将随机的核酸序列文库先后与两种细胞孵育,通过细胞收集、高温解离、离心沉淀等操作收集可以结合病变细胞但不结合正常细胞的随机核酸序列,再重复多轮上述操作,这样筛选得到的核酸适配体就能精准靶向具有某些生物标志物的疾病相关细胞。传统的Cell‑SELEX 筛选的整个过程中无需知道细胞表面的蛋白种类和数量,同时无需纯化靶标蛋白,降低了筛选成本。另外,在Cell‑SELEX 过程中细胞表面的膜蛋白保持着天然构象,与利用纯化蛋白筛选相比得到的核酸适配体能够更准确地识别靶细胞。
近年来,随着细胞特异性核酸适配体的需求丰富化、多样化,为了提高细胞特异性适配体筛选的效率和富集度,基于Cell‑SELEX 技术演变出更多的细胞特异性适配体筛选方法,包括等基因细胞SELEX(Icell‑SELEX)、荧光激活细胞分选FACS‑SELEX、配体引导选择(LIGS)、3D‑SELEX、细胞内化SELEX 等。不同的SELEX 方法使用不同的技术和工具来选择核酸适配体,但从概念上讲,所有这些方法都基于相同的基本原理,即反复选择和扩增,以获得具有高特异性、高亲和力的核酸适配体。
4 细胞特异性核酸适配体在疾病治疗中的应用
经过筛选得到的细胞特异性核酸适配体能够与特定的细胞标志物靶向结合,利用其独特的化学结构,可以精准递送各类药物、聚集不同细胞、封闭或激活相关受体通路、干扰蛋白活性等。这就有利于将其应用到多种疾病的临床治疗中,本文以疾病类型为划分方式,总结细胞特异性核酸适配体在不同疾病治疗中的应用,表2 归纳了针对不同疾病已经开发或正在研究中的核酸适配体药物。

表2 不同疾病治疗中开发的核酸适配体的应用Table 2 Applications of nucleic acid aptamers developed in the treatment of different diseases
4.1 在癌症治疗中的应用
化疗是癌症治疗中最常用的手段,但是传统的化疗药物靶向性差、副作用强,基于细胞特异性核酸适配体的递送能够实现精准靶向,并且可以克服一些化疗药物脂溶性差、剂量高和效果不理想等问题,还可以实现药物协同作用[29]。
核酸适配体-药物偶联物(ApDCs)领域正在迅速发展。核酸适配体与药物偶联的最简单形式是非共价连接。最典型的递送药物是多柔比星(Dox),它是一种具有芳香环的细胞毒性药物,能够嵌入到DNA 的‑GC‑富集区域,从而阻断DNA 复制并导致细胞死亡。多种核酸适配体‑Dox 复合物是通过将Dox 结合到核酸适配体结构中形成的。这类方法已被用于治疗多种癌症细胞系,如研究人员筛选出一种靶向急性髓系白血病(AML)细胞系表面未成熟层黏连蛋白受体蛋白(OFA/iLRP)的核酸适配体(AB3),将阿霉素插入AB3 的DNA 结构中形成了核酸适配体-多柔比星(Apt‑Dox)复合物,Apt‑Dox能有效破坏OFA/iLRP 阳性AML 细胞[30]。
尽管非共价连接简单有效,但存在药物无法嵌入到核酸适配体中的情况,因此需要通过共价连接载药[31]。基于核酸适配体的化学性质,研究提出了多种不同的核酸适配体-药物共轭方法,例如共价交联、生物相容性垫片、可裂解接头和疏水相互作用。靶向蛋白酪氨酸激酶7(PTK7)的核酸适配体sgc8c 和Dox,通过腙键共价连接形成络合物,腙键对pH 敏感,在肿瘤部位的酸性环境中容易断裂而起到靶向释放药物的效果[32]。研究人员构建了一种核酸适配体-多肽,通过亲核酰基取代共价共轭Dox 和喜树碱(CPT),然后通过点击化学连接到核酸适配体AS1411 上。该结构在体外对MDA‑MB‑231人乳腺癌细胞显示出极低的IC50,在体内微剂量注射的情况下显示出疗效[33]。
利用核酸适配体靶向递送化疗药物最大程度地降低了药物的副作用,但仍然会对肝、肾等器官带来负担,相对安全可靠的核酸疗法在癌症治疗中显示出更大的应用潜力。研究人员开发了核酸适配体介导的核酸递送,该递送系统的构建使得基于基因的核酸治疗更加高效和稳定。研究人员研发了多价核酸适配体‑siRNA 缀合物以克服多药耐药性[34],如黏蛋白‑1 核酸适配体连接Bcl2 特异性siRNA 与阿霉素[35],研究人员还合成了基于核酸适配体的脂质体,AS1411 核酸适配体偶联脂质体靶向结直肠癌(CRC)细胞递送siRNA 干扰COL1A1基因表达[36],提高了肿瘤细胞对化疗药物的敏感性。
有许多细胞特异性核酸适配体在靶向细胞递送药物时还具有细胞内化作用,更有利于药物进入细胞内发挥作用,涵盖多种细胞类型,包括癌细胞、癌症干细胞[37]和平滑肌细胞[38],这些核酸适配体介导的药物和siRNA 的递送对于癌症等疾病的治疗具有重要意义。例如核酸适配体sgc8c 无需外部帮助即可内化到T 细胞淋巴母细胞白血病细胞中[39],此外还有许多内化细胞表面标志物的核酸适配体,例如癌胚抗原(CEA)[40-41]、前列腺特异性膜抗原(PSMA)[42]和白细胞介素6 受体(IL6R)[43]。
除了利用核酸适配体递送药物来抑制肿瘤细胞生长外,双特异性核酸适配体可以直接介导肿瘤细胞裂解或免疫反应,基于这一概念,研究人员开发了一种稳定的基于核苷酸的双特异性核酸适配体,可介导c‑Met 阳性肿瘤的裂解[44],为肿瘤治疗开辟了新途径。还构建了一种针对MUC1 阳性肿瘤细胞和CD16 阳性淋巴细胞的多价双特异性核酸适配体,它能够聚集两种类型的细胞,并增强抗肿瘤反应[45]。双特异性核酸适配体将免疫细胞吸引至肿瘤的机制细胞大大增加了两种细胞之间相互作用的机会,从而激活淋巴细胞并增强抗肿瘤反应。
此外,核酸适配体工程自然杀伤细胞(ApEn‑NK)已广泛用于基于核酸适配体的免疫疗法。研究人员构建了核酸适配体-亲脂性分子锚定结构与NK92 细胞培养[30],并探讨了其稳定性。该研究证明ApEn‑NK 具有特异性攻击淋巴瘤细胞的免疫治疗潜力。还有报道在NK 细胞表面原位合成基于核酸适配体的多价抗体模拟物(PAM),大大增强了免疫细胞和癌细胞之间的相互作用[46]。此外,研究人员已经提出了培养特异性、通用性和渗透性NK 细胞的策略。这种NK 细胞配备有靶向核酸适配体和检查点阻断核酸适配体,能高度浸润到肿瘤深部区域,并为实体瘤的增强过继免疫疗法提供很大潜力[47]。
4.2 在组织修复与再生中的应用
典型的细胞募集和再生治疗方法是使用细胞特异性核酸适配体来鉴定和捕获用于组织工程的间充质干细胞(MSCs)。这些研究大多集中在骨和软骨组织修复方面,在骨治疗中将骨髓间充质干细胞(BM‑MSCs)的核酸适配体负载到支架上,募集BM‑MSCs 实现再生治疗[48]。
由于外源性干细胞移植常引起软骨组织工程中的问题,如低存活率和外源性感染的风险,因此基于核酸适配体的自体BM‑MSCs 的募集是非常重要的。这种核酸适配体功能化的支架可以募集BM‑MSCs 并支持细胞黏附,同时还可以刺激BM‑MSCs的定向分化。已经开发了多种细胞特异性核酸适配体介导的组织修复支架,包括针对不同组织特性和软骨下骨的再生能力设计的双功能双层支架[49],以及简单制备的生物纳米颗粒。
研究人员通过在含有刺激因子KGN 的基于海藻酸钠(SA)的网络中交联氧化石墨烯(GO)以形成GO‑SA 凝胶[50],该凝胶与生物矿物骨架(GBF)组装形成核酸适配体修饰的双层支架。这种双层支架有效募集MSCs,在支架内,KGN 促进MSCs 向软骨细胞分化,而核酸适配体‑GBF 加速了MSCs 向成骨细胞的成骨分化,从而成功实现了膝关节软骨和成骨的同时再生。
除了干细胞之外,也可以招募其他几类细胞。对支架表面生物功能化的研究显示,核酸适配体对成骨诱导的颌骨骨膜细胞(JPCs)有结合亲和力,从而增强骨组织工程中的细胞黏附和矿化[51]。研究人员在皮肤损伤小鼠模型中通过趋化因子FKN 核酸适配体功能化水凝胶募集非经典单核细胞M2 样巨噬细胞,从而增强组织修复[52]。
4.3 在眼部疾病中的应用
由Eyetech 和辉瑞公司共同开发和制造的Macugen,是核酸适配体成功治疗疾病的应用之一。这是2004 年11 月美国食品药物管理局批准的第一个靶向VEGF 用于治疗眼部疾病年龄相关性黄斑变性(AMD)的核酸适配体[53]。每6 周向眼部玻璃体内注射Macugen,能够特异性结合VEGF165,阻止眼部VEGF 受体被激活,从而抑制脉络膜新生血管的生成[54]。目前有3 种核酸适配体可用于治疗眼部疾病。除了VEGF,PDGF 和补体成分5(C5)也是治疗靶点,因为单独的抗VEGF 治疗可能无法防止由于周细胞相关的血管成熟导致的新血管退化。PDGF在周细胞募集中发挥作用,也是AMD 的潜在治疗靶点[55]。核酸适配体E10030 是一种靶向PDGF 的聚乙二醇偶联的核酸适配体,已经在多个III 期临床项目中评估了安全性和有效性[56]。而C5 与AMD 炎症诱导损伤的发病机制有关[57],靶向C5 核酸适配体ARC1905 也在AMD 治疗的临床研究中[58]。
4.4 在脑部疾病中的应用
脑部疾病的治疗受到血脑屏障的极大阻碍,血脑屏障限制了绝大多数小分子进入大脑。克服这一屏障的新方法是靶向内皮细胞膜上的受体,借助受体介导的转运机制通过血脑屏障。研究人员将与上皮细胞黏附分子结合的核酸适配体与靶向转铁蛋白受体(TfR)的核酸适配体融合,产生双功能核酸适配体,已开发SYL3C‑GS24 双功能核酸适配体来克服血脑屏障,可用于治疗特定的脑部疾病[59]。
Tau 是一种关键的神经元微管稳定蛋白,有助于微管组装和轴突生长。研究表明,不受调节的过度磷酸化和其他翻译后修饰的积累会使Tau 从多功能蛋白转化为神经毒物,触发Tau 聚集并最终导致不可逆的神经病变。有研究报道了一种环状双功能核酸适配体的合成,以增强体内血脑屏障渗透,从而更好地进行Tau 蛋白病治疗[60]。这种环状核酸适配体由一种转铁蛋白受体核酸适配体和Tau 蛋白核酸适配体组成,TfR 核酸适配体识别内皮细胞诱导转运,Tau 核酸适配体可以抑制大脑中的Tau 磷酸化和其他与Tau 蛋白病相关的病理变化。这种新型环状Tau‑TfR 双功能核酸适配体显著克服血脑屏障,改善Tau 蛋白病和体内创伤性脑损伤(TBI)诱导的认知缺陷,证明环状Tau‑TfR 核酸适配体可以进一步开发为Tau 蛋白病的诊断和治疗候选物。
4.5 在血管疾病中的应用
血栓仍然是全球死亡和残疾的主要原因。血栓的形成与凝血功能紊乱相关,凝血是血管壁受损时血液形成凝块的复杂过程,这一过程通过级联反应产生纤维蛋白达到止血目的,受多种凝血因子的调节。抗凝血核酸适配体以高亲和力和特异性与凝血因子结合,阻碍蛋白质-蛋白质识别反应,具有独特的治疗调节能力。
目前有4 种核酸适配体正在进行与凝血相关的临床试验,分别是REG1、ARC1779、BAX499 和NU172。REG1 是一种新型抗凝系统,由凝血因子IXa 的RNA 核酸适配体抑制剂和互补序列逆转寡核苷酸组成[61]。ARC1779 识别血管性血友病因子(VWF)A1 结构域,可以阻断VWF 的A1 结构域与血小板GPIb 受体的相互作用,从而在冠状动脉狭窄条件下调节血小板黏附、活化和聚集[62]。组织因子通路抑制剂(TFPI)是组织因子引发凝血的主要抑制剂,使其成为血友病治疗中新颖的治疗靶点,核酸适配体BAX499 通过特异性抑制TFPI 来改善止血,并可调节血友病患者血浆中的凝血酶生成[63]。NU172 是一种G‑四链体DNA 核酸适配体,可靶向凝血酶,有短效抗凝作用[64]。抗凝血核酸适配体的开发和应用将对血栓患者的治疗治愈产生积极作用。
4.6 在炎症疾病中的应用
细胞因子核酸适配体的研究也具有重要意义,例如TNFα 是促炎细胞因子,是与炎症性疾病相关的细胞因子网络的关键组成部分。已证明与人TNFα特异性结合的核酸适配体VR11[65]可抑制TNFα 信号通路,并已开发用于TNFα 检测。研究人员设计了一种使用VR11 功能化单层石墨烯作为导电通道的超柔性和可拉伸纳米传感器[66],其中VR11 与TNFα 的特异性结合会引起石墨烯载体浓度的变化,从而能够测量TNFα 浓度。这种纳米传感器可以作为检测人体皮肤或组织表面发生明显变形时的液体生物标志物的潜在可靠工具。
NOX‑E36 和NOX‑H94 这两种抗炎核酸适配体是NOXXON 公司开发的。NOX‑E36 识别趋化因子配体2(CCL 2)并通过与CCL 2 结合以减少白细胞募集来预防炎症[67],而NOX‑H94 则靶向调节铁稳态的肽激素铁调素,并干扰铁调素和铁转运蛋白[68],有助于改善炎症带来的慢性疾病难以治愈的问题,可分别用于诊断和治疗2 型糖尿病或慢性贫血。
5 总结与展望
细胞特异性核酸适配体作为一种强大的亲和工具,在疾病诊断、分子成像、生物标志物发现、药物递送和基因治疗等领域有着广泛的贡献。根据研究的需求,可以通过Cell‑SELEX 技术,从庞大的随机核酸文库中筛选出能特异性靶向细胞的核酸适配体,并且有越来越多的新型Cell‑SELEX 技术让筛选变得更加高效和准确,也使得细胞特异性核酸适配体的研究进程突飞猛进。
细胞特异性核酸适配体有着丰富的功能。首先,它可以作为一种靶向工具与靶标分子高度特异性结合实现疾病诊断或药物递送,这对于疾病的精准治疗有着突破性贡献,大大提高了疾病的治疗效率;其次,它可以直接作为治疗剂与靶标结合,从而激活或抑制细胞活动的相关通路来发挥作用,与传统化学药物相比,更加安全可靠;此外,核酸适配体还可以作为细胞外基质和细胞生长因子的模拟物,以及细胞招募的介质,在组织修复和再生医学中发挥重要作用。由于这些独特的优势,细胞特异性核酸适配体在人类疾病治疗方面具有重要地位,在包括癌症、眼部疾病、血管病、神经病变、炎症疾病和组织损伤等领域得到广泛关注和应用,越来越多的国内外医药企业也在投入大量的成本用于细胞特异性核酸适配体药物的开发,细胞特异性核酸适配体的治疗潜力还有望在更多领域得到进一步研究和应用。
尽管有许多基于细胞特异性核酸适配体开发的治疗药物有着巨大的临床应用潜力,但是细胞特异性核酸适配体还存在一些需要解决的问题,例如提高稳定性、安全性评价、降低筛选难度、开发口服递送载体等,所以目前只有较少药物进入临床试验阶段,更少有进入临床应用。由此可见,虽然细胞特异性核酸适配体在治疗人类疾病方面展现了极大的希望,但也充满着巨大的挑战。相信在未来,随着科研人员的不断探索,目前所面临的问题将被一一攻克,细胞特异性核酸适配体的潜力将被极大程度地开发,为人类疾病的治疗作出越来越多的贡献。