RNAi 技术在寄生蜂中的应用研究进展
张龙喜 吕琳 张欢欢 周金成 车午男 董辉
(1. 沈阳农业大学植物保护学院,沈阳 110866;2. 西藏自治区农牧科学院蔬菜研究所,拉萨 850032)
RNA 干扰现象最早由Napoli 等[1]于1990 年在矮牵牛(Petunia hyhridaVilm)上发现。Fire 等[2]在研究秀丽隐杆线虫(Caenorhabditis elegans)RNA干扰过程中阐述了基因沉默现象的本质,并将RNA干扰(RNA interference, RNAi)定义为双链RNA(double‑strand RNA, dsRNA)降解同源基因mRNA的效应。RNAi 不仅存在于植物和真菌,还广泛存在于昆虫中[3-6]。
RNAi 技术现已成为研究生物基因功能主要生物技术方法[7],并且成功应用于多种昆虫的基因功能研究中[8]。膜翅目是仅次于鞘翅目和鳞翅目的第三大目,膜翅目中的寄生蜂类群包含12 个科,是膜翅目的重要组成部分,也是防治农林害虫的重要天敌昆虫资源[9]。寄生蜂的生长发育依赖于寄主,同时与寄主昆虫产生相互作用。这些特殊的生物学特性为开展寄生蜂的基因功能研究,尤其是给RNAi 技术等反向遗传学手段的实施带来挑战。
本文综述了RNAi 技术在膜翅目寄生蜂中的发展与应用,包括RNAi 机制、影响RNAi 效率的因素等。研究将为RNAi 技术在寄生蜂基础理论和害虫防治应用的相关研究提供方法参考和科学依据。
1 RNAi 作用机制与dsRNA 递送方法
1.1 RNAi机制
RNAi 是一种高度保守的细胞机制,目前已知动物中的RNAi 通路有3 种,包括Short/small interfer‑ing RNA(siRNA)通路[10-11]、microRNA(miRNA)通路[12-13]和P‑element induced wimpy tesis(Piwi)‑in‑teracting RNAs(PiRNAs)通路[14]。
在昆虫中,当dsRNA 导入到细胞后,dsRNA 与R2D2 或内源性siRNA 途径中的Loquacious(Loqs)一起被III 型核糖核酸酶Dicer‑2(Dcr2)识别并切割[15]。在这个过程中细胞质中的dsRNA 被切割成19-21 nt 的siRNA 双链,随后siRNA 被装载到Ago2 后,Ago2 和其他RNA 诱导沉默复合体(RNA induced silencing complex, RISC) 相关蛋白组装RISC。RISC 中siRNA 的正义链被降解,反义链被保留,RISC 通过反义链引导RISC 中Ago2 识别并切割互补的靶mRNA[16]。RNAi 主要蛋白质参与者是Agronaute(Ago)家族蛋白,Ago 家族蛋白具有靶RNA 切割活性,AGO 蛋白与小RNA 结合并通过小RNA 和目标mRNA 之间的序列互补,触发靶RNA的降解[16-18]。siRNA 通路过程见图1。

图1 siRNA 介导的RNAi 通路示意图Fig. 1 Model of siRNA-mediated RNAi pathway
1.2 dsRNA导入方法
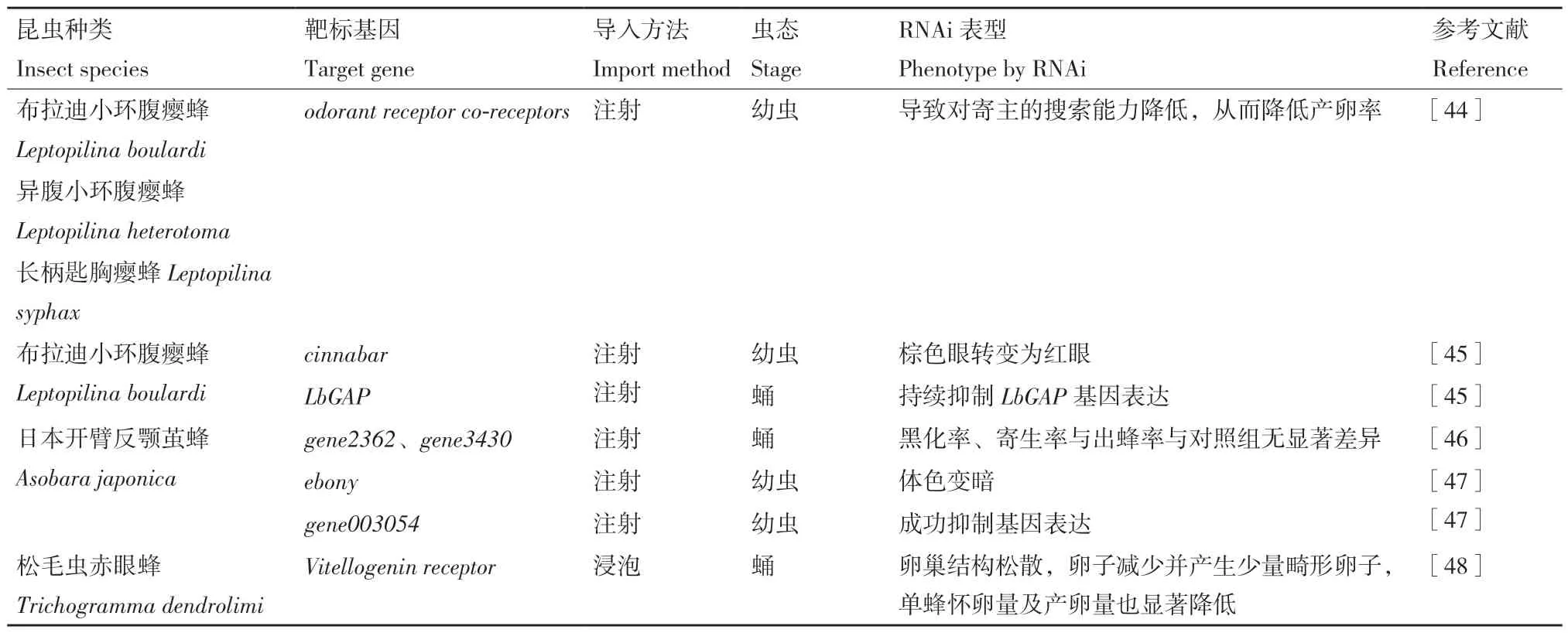
目前dsRNA 的导入方法包括显微注射法、饲喂法、浸泡法、组织培养法、电穿孔、病毒转染以及转基因等。寄生蜂主要发育时期都寄生于寄主昆虫内部,因此不同的dsRNA 导入方法受限于其寄生生活的特性。传统的饲喂、浸泡等方式导入RNA 的方法可能难以起效。目前,寄生蜂RNA 干扰研究中的导入方法集中于注射,包括卵期注射、幼虫注射、蛹期注射、成虫注射以及寄主注射(表1)。

表1 RNAi 在寄生蜂中的应用Table 1 Application of RNAi in parasitoids
1.2.1 显微注射法 显微注射法已报道于丽蝇蛹集金小蜂(Nasonia vitripennis)、中红侧沟茧蜂(Micr‑oplitis mediator)、菜蛾盘绒茧蜂(Cotesia vestalis)、蝶蛹金小蜂(Pteromalus puparum)、斑痣悬茧蜂(Me‑teorus pulchricornis)、甲腹茧蜂(Chelonus inanitus)、菜蛾盘绒茧蜂(Cotesia vestalis)、二化螟盘绒茧蜂(Cotesia chilonis)、蝶蛹金小蜂(Pteromalus pupar‑um)、日本开臂反颚茧蜂(Asobara japonica)等寄生蜂的基因功能研究中。
在金小蜂中,对毒液钙网蛋白(venom calretic‑ulin component,v‑crc)的敲除效率高达90%[22];在针对Wolbachia密度抑制基因(Wolbachia density sup‑pressor,Wds)的敲除中,沉默效率达到了71%[27]。在中红侧沟茧蜂(M. mediator)中,对Odorant Re‑ceptor基因抑制效率超过90%[34]。在菜蛾盘绒茧蜂(C. vestalis) 中, 注射法RNAi 效率可达74%-98%[30]。注射法作用效果快,需要少量的dsRNA 就能对靶标基因进行干扰,但是注射操作对于微型昆虫来说机械损伤仍然会造成较高的死亡率,同时对于操作环境和技术熟练度要求较高。
1.2.2 浸泡法 浸泡法是将供试昆虫直接浸泡在dsRNA 溶液中,dsRNA 分子直接通过昆虫气孔或表皮渗透至体内,干扰体内靶基因表达。高鹏[35]通过混合dsRNA 和纳米材料浸泡处理二化螟盘绒茧蜂(A. chilonis)成虫,靶基因热激蛋白基因Cchsp70‑4在27℃和36℃下的沉默效率分别达到34.25%和63.36%。然而,何馥晶[36]分别运用纳米材料浸泡法与注射法处理二化螟盘绒茧蜂预蛹和蛹发现,两种方法对靶基因半胱氨酸天冬氨酸蛋白酶基因Cccaspase‑1的沉默效率无显著差异。在松毛虫赤眼蜂(Trichogramma dendrolimi)中,通过dsRNA 溶液注射寄主卵浸泡处理卵内的子代蜂,靶基因沉默效率达70%[48]。相比于注射法,浸泡更方便更容易操作,对操作技术要求较低;相反,浸泡法所需要的dsRNA 量大,实验成本较高,且需要dsRNA 稳定的浸泡环境。
1.2.3 饲喂法 饲喂法是将dsRNA 加入昆虫的食物或人工饲料,昆虫通过取食进入体内对靶标基因进行干扰的方法。然而,寄生蜂幼期的生长发育依赖于寄主,其幼期脱离寄主将难以存活。在保障寄生蜂正常发育的基础上对寄生蜂饲喂dsRNA 具有一定难度。目前,应用饲喂法在寄生蜂实施RNAi 的研究鲜有报道。
1.2.4 其他RNAi 方法 细胞转染法是利用转染剂直接将dsRNA 递送到细胞中的干扰方法。Beck等[32]利用细胞转染法成功抑制中红侧沟茧蜂(M.mediator)glc1.8基因的表达,并挽救High Five 细胞的黏附表型。此外,在昆虫基因功能的研究中还有转基因、组织培养法、电穿孔、病毒转染等方法[32,49-51]。
续表1 Table 1 continued
2 RNAi 在寄生蜂中的应用
寄生蜂是一类营寄生生活的膜翅目昆虫,寄主大部分为鳞翅目害虫。寄生蜂寄生行为依赖于对寄主的精准定位以及携带的多种寄生因子,包括毒液、多分DNA 病毒(polydnavirus,PDV)、病毒样颗粒(virus‑like particles or MpVLPs)以及化感相关蛋白(OBPs、GRs、CSPs、ORs)等。同时,寄生蜂与宿主昆虫在生长发育和免疫反应的相互作用分子调控也得到关注。寄生蜂复杂的生物学特性给RNAi 技术的实施带来诸多挑战。
2.1 寄生蜂生长发育相关基因RNAi研究
亲本RNAi(parental RNAi, pRNAi)可以通过处理生物体的母代,而在后代观察到基因沉默表型。Olesnicky 等[28]利用pRNAi 原理沉默丽蝇蛹集金小蜂(N. vitripennis)cad基因,研究表明高浓度的dsRNA 使得胚胎停止发育,而低浓度时,雌性产出卵表现出表皮缺陷。基于pRNAi 的研究相对较多,在靶基因方面,tudor和Bicauda1‑D、Nv‑odd paired等与胚胎形成相关的基因都已相继在金小蜂中被验证[24,29]。Geuverink 等[4,19-20,52]利用金小蜂pRNAi,揭示了金小蜂的性别决定级联方式。
生物体能够通过生物钟基因利用光周期协调其发育、繁殖。其中period(per)、cryptochrome‑2(cry‑2)、clock(clk) 和cycle(cyc) 等生物钟基因扮演重要角色[53-54]。Mukai 等[23]对金小蜂per基因进行沉默后,金小蜂不能在短时间内产下滞育的卵。相同的是,Dalla 等[26]对金小蜂per基因进行干扰,结果导致昼夜节律时钟加快,改变了其他生物钟基因的表达,并推迟了滞育。姜卓[48]通过浸泡法成功将RNAi 技术运用于卵寄生蜂,成功干扰松毛虫赤眼蜂VgR基因。
2.2 寄生蜂免疫相关基因RNAi研究
2014 年Colinet 等[45]首次报道了寄生蜂毒液蛋白基因的有效沉默,表明LbGAP 是大量存在于布拉迪小环腹瘿蜂(Leptopilina boulardi)毒液中的毒力因子。毒液钙网蛋白是金小蜂基因组里鉴定到的仅有毒液蛋白,毒液钙网蛋白沉默后,抑制了宿主对金小蜂毒液的先天免疫反应,并减少宿主出血和黑化[22]。与之相反的是,在对日本开臂反颚茧蜂(A.japonica)中2 个已报道的与寄主黑化反应相关的基因进行RNAi 时,结果显示这2 个基因的RNA 干扰效率均在90%以上,但寄主黑化率、寄生蜂寄生率和出蜂率与对照组相比没有显著差异[46]。在中红侧沟茧蜂(M. mediator)中,干扰毒液蛋白基因MmRho1会导致雌蜂卵黄生成素和保幼激素、卵子生成和茧形成的下调。此外,通过酵母杂交实验表明MmRho1在中红侧沟茧蜂发育和抑制宿主细胞免疫反应中发挥双重作用[33]。
寄生蜂多分DNA 病毒(PDV)参与调控了宿主寄生蜂的免疫及生长发育过程。在中红侧沟茧蜂(M. mediator)中,MdBV 感染会阻断High Five 细胞黏附培养板的能力,而通过RNAi 沉默glc1.8的表达可以挽救High Five 细胞黏附[32]。对甲腹茧蜂(C.inanitus)的宿主注射CiV基因的dsRNA 后,挽救了末龄幼虫的发育停滞,相反,将相同的dsRNA 注射到寄生蜂卵中则阻止了寄生蜂的羽化,降低了寄生蜂的存活率。推测这些病毒基因可能参与诱导寄主发育停滞和软化角质层[37]。此外,BVs 可能参与核衣壳的形成[30]。
除此之外,病毒样颗粒也有助于削弱宿主免疫防御系统。在斑痣悬茧蜂(M. pulchricornis)中,MpVLP 在体外培养的早期阶段抑制宿主黏附血细胞的附着和扩散,这最终诱导宿主血细胞凋亡,从而保护宿主中产的受精卵[55]。Yokoi 等[40]通过单基因和联合基因沉默两种MpVLP 因子,导致对宿主幼虫浆血细胞的抑制作用减弱,表明两种MpVLP 因子参与了浆血细胞扩散的抑制,但不参与颗粒细胞的抑制。
2.3 其他基因RNAi研究
近年来,随着RNAi 技术的成熟,有关寄生蜂RNAi 的基因功能研究逐渐增多。在靶基因上,包括气味结合蛋白基因(CvesOBP17/18/19)、色素合成相关基因ebony和cinnabar、细胞色素P450基因、热激蛋白基因(Cchsp70‑4)、幼虫唾液蛋白基因(Pp16911)、含半胱氨酸的天冬氨酸蛋白水解酶(Cccaspase‑1)、α- 淀粉酶基因(PpAmy1、PpAmy2、PpAmy3)、脂肪酸合成酶基因(Fatty Acid Synthases,FASs)、UDP 糖基转移酶基因(UDP‑gly‑cosyltransferases,UGTs)等相关的基因功能研究都已报道[21,31,35-36,38-39,41-43,45,47]。
3 RNAi 效率的影响因素
3.1 靶基因的选择
在已报道的寄生蜂的RNAi 研究中,靶基因或靶序列可分为四类:(1)免疫相关基因,包括毒液蛋白基因[45-46]、病毒样颗粒[40]、多分DNA 病毒(PDV)[30,32,40]、幼虫唾液蛋白基因(Pp16911)[42]等。(2)生长发育相关基因,包括DNA 甲基转移酶基因(Dnmt)[24]、生物钟基因(per)[23,26]、脂肪酸合成酶基因(FASs)[38]等。(3)生殖及性别决定相关基因,包括与雄性生殖能力和雌性卵子孵化有关的基因,如dsx[19-20]、tra和tra2[4]、VgR[48]等。(4)寄主识别和适应相关基因,包括与嗅觉、味觉、视觉、听觉和触觉相关的基因,如气味结合蛋白OBPs[31]、味觉受体GRs、化学感觉蛋白CSPs、嗅觉受体ORs[44]、热激蛋白基因(hsp70‑4)[35]、含半胱氨酸的天冬氨酸蛋白水解酶基因(Cccaspase‑1)[36]等。
值得注意的是,使用致死作为表型结果时,应当考虑假阳性结果的风险。可以利用具有特定表型的基因来建立并优化RNAi 技术体系,并作为RNAi效率的指示基因。例如与昆虫色素沉着相关的基因,包括laccase[56-57]、ebony[47,58]等。
3.2 脱靶效应
与其他昆虫不同,许多寄生蜂幼期生活于寄主昆虫体内。dsRNA 的靶向性易受宿主昆虫影响。于昆虫的脱靶效应而言,目前已有参数来预测脱靶:与靶基因序列一致性达80%的dsRNA 可有效触发RNAi;具有完全匹配序列片段≥16 bp 或几乎完全匹配序列片段>26 bp,其中一个或两个错配很少分布的dsRNA(单个错配插入≥5 bp 的匹配片段之间或插入≥8 bp 匹配片段之间)也能够触发RNAi[59]。例如,在对赤拟谷盗(Tribolium castaneum)筛选防控基因时,dsTcCht10对丽蝇蛹集金小蜂(N.vitripennis)Cht10基因转录水平有显著影响,且赤拟谷盗dsTcCht10与丽蝇蛹集金小蜂同源基因的相似性为66.75%,存在连续19-23 nt 核苷酸的匹配个数[60]。因此为了更好地将RNAi 技术应用于寄生蜂研究,应该加强dsRNA 特异性检测。
3.3 降解dsRNA的核酸酶
已有的研究表明,昆虫血淋巴或者中肠中的核酸酶(DNases 和RNases)是降解dsRNA 关键因素。在寄生蜂-宿主昆虫系统中,宿主昆虫和寄生蜂产生的相关核酸酶均可能对dsRNA 产生降解作用。在昆虫血淋巴浓度初始剂量相同时,分别以1.0、2.3、11.5、33.0 μg 剂量的几丁质合成酶同源基因dsRNA 向美洲大蠊(Periplaneta americana)、大麦虫(Zophobas atratus)、飞蝗(Locusta migratoria)、斜纹夜蛾(Spodoptera litura)注射,分别导致了82%、78%、76%和20%的损耗[61]。进一步研究发现,沉默核酸酶基因可显著提高RNAi 效率,共同沉默多个核酸酶基因也可显著提高干扰效率[62]。深入研究表明,不同昆虫降解dsRNA 的核酸酶所需要的生理条件不同[63-64]。在东亚飞蝗(Locusta migratoria)中,LmdsRNase1可以在最适pH 5 下快速降解dsRNA,而中肠的生理pH 6.8 是LmdsRNase2活性的理想值[65]。综上所述,昆虫血淋巴和肠道中的核酸酶对RNAi 效率有严重影响,鉴定不同昆虫降解dsRNA 的关键基因,对于研究RNAi 机制具有重要意义。
3.4 dsRNA设计及其他因素
除了上述影响因素外,dsRNA 的长度、结构、反应时间、操作环境、剂量均会影响RNAi 的研究。List 等[66]总结了不同目昆虫RNAi 研究中所用的dsRNA 分子的有效性:(1)在构建dsRNA 分子大小有效性范围时,移除死亡率低于67%的结果后,结果显示有125-628 bp 的有效范围。在寄生蜂中,dsRNA 分子大小集中在300-600 bp。这些结果与Huvenne 等[67]的结果相近。(2)RNAi 反应持续时间可能对死亡率产生影响。在烟粉虱(Bemisia tabaci)中,饲喂ATP 酶dsRNA 在48 h 时,烟粉虱死亡率达70%。对温带臭虫(Cimex lectularius)连续饲喂28 d 后,死亡率才能达到80%-85%。(3)dsRNA 剂量也是影响RNAi 效果的重要因素。这与dsRNA 的导入方法以及昆虫的取食方式密切相关。在RNAi 研究中,稳定的操作环境、昆虫的处理方式以及实验器材的处理可能也需要考虑。包括注射或饲喂前对实验器材的灭菌处理,注射过程对成虫的麻醉方式,注射或饲喂后的培养环境,dsRNA 储存方式的影响等[68-69]。尤其是在设计靶标基因dsRNA 引物时,也应该考虑昆虫对dsRNA 碱基偏好性。
4 展望
RNAi 具有高效、特异性强等优点,现阶段已成为研究昆虫基因功能的常规技术。脂质体(liposo‑mes)修饰和纳米材料包被认为是提升干扰效率的潜在有效方法。但是,由于寄生蜂特殊的生活方式,RNAi 技术在寄生蜂的应用上仍然存在着多种挑战。在寄生蜂中,传统的饲喂法RNAi 研究鲜有报道,对于dsRNA 在其体内的递送机制也尚未揭示。在递送方式中,饲喂法操作简便,但目前仍然缺乏大量生产dsRNA 的成本效益高的方法。显微注射法在寄生蜂RNAi 研究中应用最多,但该方法多数只能在寄生蜂蛹期和成虫期操作,难以应用于其他发育时期,尤其是寄生蜂的早期胚胎阶段。dsRNA 的脱靶和非脱靶效应、作用位点的预测以及潜在的抗性发展问题也是RNAi 技术应用于寄生蜂的重要大挑战。目前迫切需要建立基于寄生蜂生物学特点的RNAi方法,重点聚焦提高dsRNA 的递送效率。相关方法的建立将有助于扫清寄生蜂分子调控理论研究和害虫生物防治应用的技术瓶颈。另外,通过分离昆虫的肠道共生菌,通过遗传改造特定共生菌,使其作为在昆虫体内稳定表达dsRNA 的媒介。以微生物为媒介的RNAi 方法可作为提高寄生蜂RNAi 效率的重要思路。
此外,随着RNAi 农药等新型杀虫剂的研发与应用,相关RNAi 杀虫剂对寄生蜂等天敌昆虫的脱靶效应和安全性也值得深入研究。因此,建立寄生蜂类群的RNAi 方法对寄生蜂的分子机理、生理调控、生物防治应用、RNAi 农药安全性评价等诸多方面均具有重要意义。