荧光素酶辅助定量大肠杆菌破碎效果的方法
李奕雅 吴一凡 丁能水 范小萍 陈凡
(1. 闽南师范大学生物科学与技术学院,漳州 363000;2. 福建傲农生物科技集团股份有限公司,漳州 363000)
20 世纪末以来,随着DNA 重组技术的蓬勃发展以及蛋白质分离纯化技术的不断进步,基于原核生物蛋白质表达系统的异源蛋白高效生产早已成为现实[1-3]。在原核表达体系中,以大肠杆菌为代表的表达系统具有遗传背景清晰、生长快速、表达量高、易于操作、连续发酵能力强等优点,已广泛作为外源蛋白的表达宿主[4]。
然而,在基于大肠杆菌的外源蛋白表达体系中,作为分离纯化目标的靶蛋白往往以胞内组分的形式存在。在分离提取环节,为了使细胞内含物得到释放,首先必须对细胞进行破碎或裂解。因此,细胞的破碎便成为提取胞内生物活性物质的关键技术[5]。目前,常用的大肠杆菌细胞破碎技术,主要有高压匀浆法、高速珠磨法、超声破碎法、酶溶法、化学渗透法等[6]。其中,超声破碎法作为一种低成本、易使用的菌体破碎手段,一直被广泛应用。该法利用超声波在液体介质中引起的空化效应,产生高压力的冲击波和局部高温,破坏细胞壁的网状结构,使细胞内容物释放出来,参与后续的纯化过程[7]。其作用效果受到探头直径、超声功率、溶液体积、容器大小、容器材质、破碎缓冲液组成以及超声作用时间等多方面因素的协同影响,若不作针对性优化,则难以达到较好的效果——在保证破碎率的基础上,尽可能保全靶蛋白的生物活性[8]。因此,超声破碎的参数优化,就成为原核表达蛋白质纯化过程中的关键步骤之一。而这一优化过程,往往需要借助SDS‑PAGE 及其后续的染色结果判断,费时费力且只能得到半定量的结果,效率与精度亟待提高[9]。
萤火虫(Photinus pyralis) 荧光素酶(firefly luciferase, FLuc)大量存在于萤火虫尾部,与生物发光密切相关[10-12]。其分子量约61 kD,常用于报告基因检测,具有灵敏度高、半衰期短、特异性强等特点,早已成为医学和生命科学研究领域的重要标记工具[13-15]。目前,已有研究表明[16],FLuc 的作用底物D‑Luciferin 在碱性条件下带负电荷,无法穿透大肠杆菌的细胞壁与细胞膜,不能与胞内的FLuc产生反应。若控制缓冲液的pH 值在碱性范围,则向表达FLuc 的菌悬液中添加底物时,底物仅与游离的FLuc 产生反应,发出荧光,故可用于表征菌体裂解时外屏障的受损情况。此外,FLuc 自身热稳定性不佳[17],在35℃以上环境中,即可检测到活性显著下降。这一特点可用于破碎过程中超声热效应的判定,为维持靶蛋白特别是热不稳定靶蛋白在破碎环节中的活性提供重要参考。
本研究使用基于大肠杆菌cspA启动子的原核表达载体[18],利用萤火虫荧光素酶活性作为破碎指标,考察了其在海肾荧光素酶(Renilla luciferase, RLuc)、增强绿色荧光蛋白(enhanced green fluorescent protein, EGFP)和红色荧光蛋白(mCherry)表达菌株破碎过程中的定量效果。研究成果为大肠杆菌细胞破碎过程中的条件优化和目标蛋白的活性保全提供了简便易行的评价手段。
1 材料与方法
1.1 材料
1.1.1 菌株与载体 pCold III DNA 载体(宝日医生物技术(北京)有限公司);BL21 化学感受态细胞(上海唯地生物技术有限公司)。转化了pCold‑FLuc、pCold‑RLuc、pCold‑EGFP 和pCold‑mCherry 等表达载体的BL21 菌种由本课题组构建并保存,各载体结构如图1 所示。
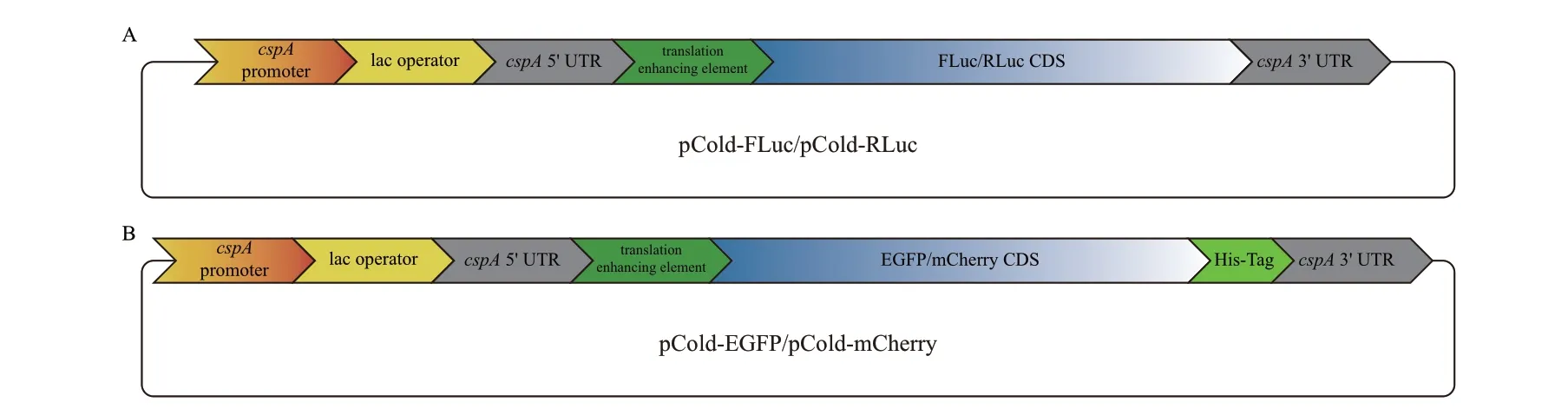
图1 本研究使用的载体结构示意图Fig. 1 Schematic representation of the plasmid structures used in this study
1.1.2 试剂 酵母提取物、胰蛋白胨(Oxoid);氯化钠、甘油(国药集团化学试剂有限公司);氨苄青霉素钠盐、RealBand 三色预染蛋白Marker、IPTG(生工生物工程(上海)股份有限公司);10×SDS 电泳缓冲液、10%蛋白预制胶、Ni‑NTA 树脂(镍珠)(北京兰博利德商贸有限公司);DL101‑01 双萤光素酶报告基因检测试剂盒(南京诺唯赞生物科技股份有限公司)。
1.1.3 仪器 XS‑TD1 台式全温振荡培养箱(象尚昱科(上海)实验仪器有限公司);Spark 多功能酶标仪(瑞士Tecan 公司);T30D 型三槽超级梯度PCR 仪(杭州朗基科学仪器有限公司);UV‑1600 紫外可见分光光度计(上海美谱达仪器有限公司);H2050R‑1 高速冷冻离心机(湖南湘仪实验仪器开发有限公司);VCX800 细胞破碎仪(美国Sonics 公司);Imager 600 UV 生物分子成像仪(美国GE 公司);DYCZ‑24DN 垂直电泳槽、DYY‑6D 电脑三恒多用电泳仪电源(北京六一生物科技有限公司);VM‑100旋转混合仪(杭州佑宁仪器有限公司);GelSMART凝胶成像仪(大龙兴创实验仪器(北京)股份公司)。
1.2 方法
1.2.1 菌种的活化与靶蛋白的诱导表达 取保存于‑80℃的甘油菌1 μL,加入到750 μL 氨苄(100mg/L,下同)抗性LB 培养基中,置于37℃,220 r/min环境中振荡培养16 h。随后取其中的500 μL,加入到150 mL氨苄抗性LB培养基中,继续37℃,220 r/min振荡培养至浊度(以OD650计,避免mCherry 被入射光激发,干扰检测[19])介于0.5-0.6 之间,再添加终浓度100 μmol/L 的IPTG,置于15℃,220 r/min环境下继续培养24 h,并开展后续实验。
1.2.2 菌体的超声破碎 按1.2.1 所述步骤诱导表达后的菌液,在7 000 ×g,4℃离心2 min 后,弃上清,收集菌泥,以20 mL 冰冷的PBS 缓冲液(pH 7.4,0.01 mol/L,下同)重悬,重复离心一次,弃上清后以10 mL 冰冷的PBS 重悬。随后利用50 mL 离心管盛放菌液,置于冰水混合物中,使用直径6 mm 的超声探头,在指定功率下按照“破碎2 s,停止3 s”的条件破碎并采样检测。破碎样品经15 000 ×g,4℃离心15 min 后,取上清液检测蛋白质活性。
1.2.3 荧光素酶活性检测 取一定量经PBS 稀释的荧光素酶样品,用试剂盒附带的细胞裂解液补足20μL 后,利用多功能酶标仪逐孔检测。检测时,利用自动进样器添加对应的底物,再对酶标板进行2 s 的振荡,随后立即检测荧光强度。此外,检测FLuc 活性时,设置数据衰减模式为“OD1”(约衰减到原始数值的10%);检测RLuc 活性时,应将仪器衰减模式设置为“OD3”(约衰减到原始数值的0.1%),以避免过曝。
1.2.4 荧光蛋白活性检测 利用多功能酶标仪检测EGFP(滤光片组合:EX‑485;EM‑535)和mCherry(滤光片组合:EX‑535;EM‑595)活性时,取破碎后的上清液,用PBS 补足100 μL 后上机检测。为避免过曝,EGFP 检测过程中需将增益值(Gain)设置为45,mCherry 检测时需将增益值设置为60。
1.2.5 萤火虫荧光素酶辅助破碎定量效果检测 按1.2.1、1.2.2 有关步骤进行靶蛋白诱导表达和菌体清洗,最终得到表达4 种靶蛋白的菌悬液各10 mL。此后,向含有RLuc、EGFP 和mCherry 的菌悬液中,各加入20 μL 表达了FLuc 的菌悬液。再于160 W 功率下进行超声破碎。破碎结束后,取上清液2.5 μL,按1.2.3 所述方法直接检测萤火虫荧光素酶活性;针对海肾荧光素酶,则取稀释500 倍后的上清液2.5μL 检测;对于含有EGFP 或mCherry 的上清液,则按1.2.4 所述步骤,取5 μL 上清液检测活性。
1.2.6 温度对蛋白质活性的影响评价 按1.2.1、1.2.2 所述步骤进行靶蛋白诱导表达和菌体破碎(160W,15 min)。随后取若干个0.2 mL 离心管,每管加入50 μL 含有靶蛋白的上清液,先利用梯度PCR 或冰水混合物(0℃)孵育15 min,再以室温孵育15 min,随后以0℃处理的样品活性为100%,检测并计算各靶蛋白的残余活性。
1.2.7 不同破碎功率对荧光素酶活性的影响评价 按1.2.1、1.2.2 有关步骤进行靶蛋白诱导表达和菌体清洗,得到表达FLuc 和RLuc 的菌悬液各10 mL,取每种菌悬液20 μL,加入到10 mL 冰冷的PBS 中,混合均匀后按1.2.2 所述的超声破碎方法分别使用160 W、240 W 和320 W 超声功率进行菌体破碎,并于破碎过程中定时采样获得破碎上清液,取其中2.5 μL 直接检测荧光素酶活性。
1.2.8 蛋白质活性的半定量摄像 针对FLuc 样品,取少量含有FLuc 的破碎上清液,用试剂盒附带的细胞裂解液补足20 μL,再加入检测用底物溶液100μL,混合2 s 后立即使用摄像头采集反应图像。针对EGFP 或mCherry 样品,取少量含荧光蛋白的破碎上清液,用PBS 补足100 μL 后,通过485 nm 光源激发荧光,以520 nm 滤光板(长通型)辅助拍照。
1.2.9 蛋白质的镍珠法纯化与电泳检测 用10 倍镍珠体积的PBS 清洗镍珠3 次,再将等体积的镍珠添加到待纯化的蛋白质溶液中,混匀后取样保存。随后以20 r/min,4℃上下回旋振荡12 h,500 ×g离心3 min 后取少量上清液保存。再以PBS 清洗镍珠3 次,取约20 μL 镍珠颗粒保存。最后将终浓度1×的SDS‑PAGE 上样缓冲液加入各样品中,定容至100 μL,95℃加热10 min 后取其中15 μL 进行SDS‑PAGE(分离胶浓度10%)检测,并以考染方式分析电泳结果。
1.2.10 冻存菌的破碎与检测 按1.2.1 所述步骤诱导表达靶蛋白的菌液,离心清洗菌体1 次,用10mL 含有体积分数为30%的甘油的PBS 重悬。再将重悬后的菌液分装置于‑80℃冷冻保存。此后,每隔30 d 取出含有FLuc 和RLuc 的菌悬液各1 mL,37℃水浴解冻,离心后用10 mL 冰冷的PBS 重悬,随后以160 W 功率破碎,并定时取样。破碎上清液用PBS 稀释50 倍后,取2.5 μL 检测荧光素酶活性。
1.2.11 统计分析 所有检测结果使用Minitab v17.0软件进行数值统计,数据以“平均值±标准差(mean± SD)”形式表示(每组实验均重复3 次)。待比较数据的方差一致时,使用Tukey 方法进行多重比较;方差不一致时,使用Games‑Howell 方法进行多重比较。同一实验中,不含共享字符的两组数据存在显著差异(P<0.05)。
2 结果
2.1 荧光素酶和荧光蛋白活性检测条件的确定
在各靶蛋白的诱导表达和菌体超声破碎(160 W,20 min) 后, 对含有FLuc、RLuc、EGFP 和mCherry 等4 种蛋白质的上清液进行活性检测(FLuc和RLuc 样品在检测前须稀释500 倍),并绘制标准曲线(图2)。由各标准曲线可见,本研究选择的样品添加量与反应荧光强度存在较强的线性关系,可认为对应的检测方法和上清液用量是有效且准确的。此外,基于图2 所示数据可知,在辅助破碎的过程中,向目标菌悬液中按1∶500(体积比)添加表达FLuc的菌悬液,能够将检测读数控制在标准曲线所及的范围内并留有余量,足以为破碎过程提供定量依据。
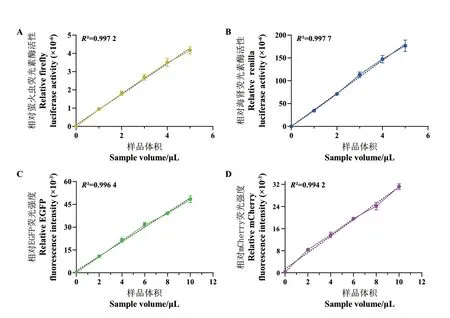
图2 经诱导表达的4 种蛋白质活性标准曲线Fig. 2 Standard curves of four induced proteins activities after induction
2.2 超声破碎的萤火虫荧光素酶辅助定量效果检验
确定辅助定量所需的FLuc 菌液用量后,按照1.2.5 所述步骤,检验FLuc 表达菌对RLuc、EGFP和mCherry 表达菌的超声破碎辅助定量效果。以破碎样品中活性最强的平均值为100%,绘制活性变化曲线如图3 所示。通过对图3 中各子图的分析可知,FLuc 在破碎上清液中的活性上升趋势与3 种靶蛋白基本一致。说明FLuc 对靶蛋白的释放过程起到了良好的定量表征作用,能为不同条件下超声破碎参数的设置提供有效参考。

图3 三种菌悬液超声破碎的萤火虫荧光素酶辅助定量结果图Fig. 3 Firefly luciferase-assisted quantification of ultrasonic disruption for three bacterial suspensions
2.3 萤火虫荧光素酶对超声破碎功率的敏感性测试
按1.2.6 所述实验步骤,对4 种蛋白质分别进行加热和保温处理,探讨温度对4 种蛋白质活性的影响,结果如图4 所示,可得到如下结论:(1)由图4‑A,B 可见,FLuc 和RLuc 在38.5℃和40℃环境下处理15 min 后,活性明显下降,且FLuc 活性损失较大。(2)在图4‑C, D 中,EGFP 和mCherry 所表现出的热稳定性远高于荧光素酶,其活性仅在处理温度大于67℃后出现下降,且mCherry 的活性下降更为缓慢。因此,后续宜选用“FLuc+RLuc”这一对温度更敏感的蛋白质组合,考察不同破碎功率对终产物活性的影响。
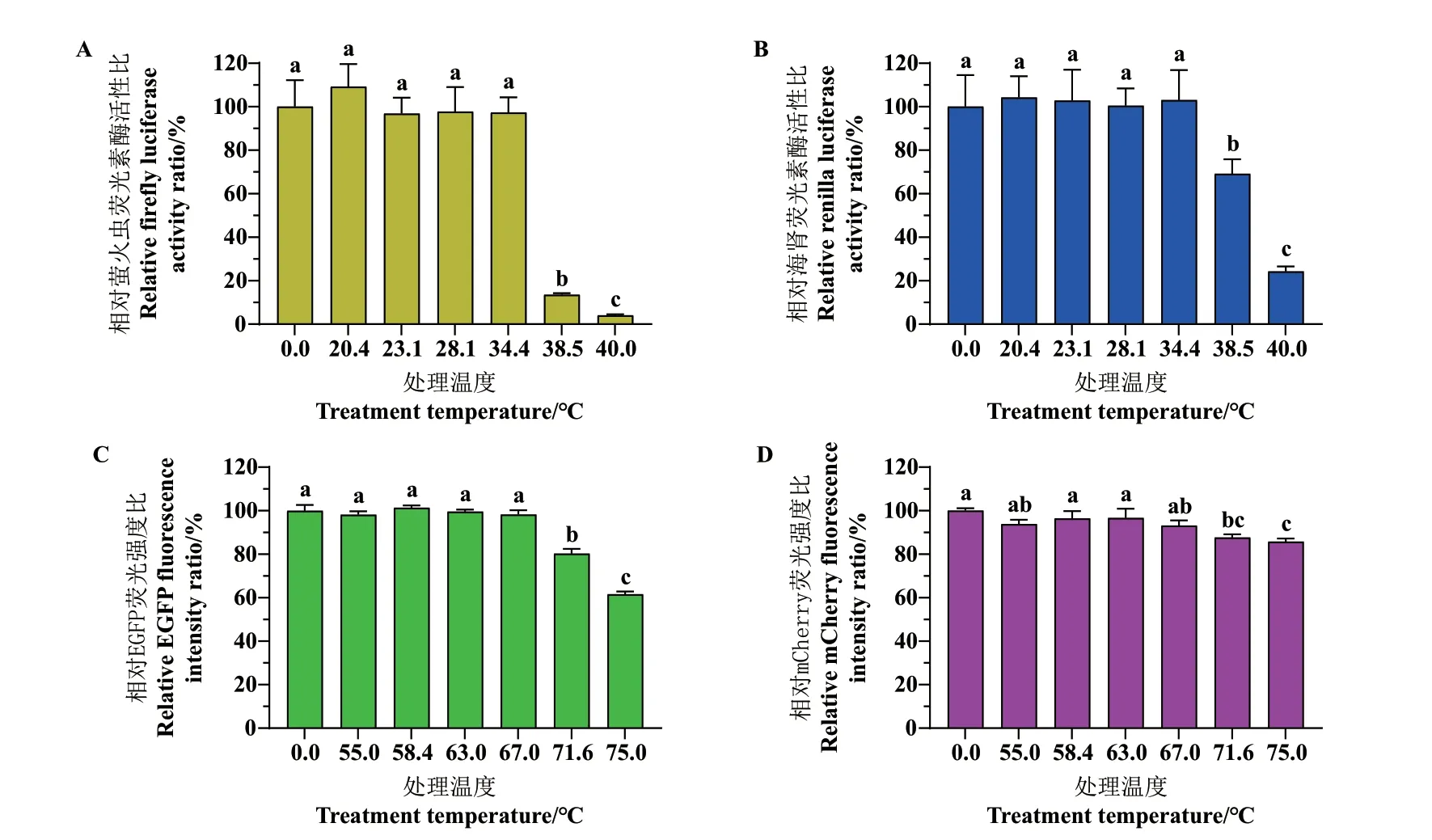
图4 不同处理温度下4 种蛋白质活性的变化Fig. 4 Activity changes of four proteins incubated under different temperatures
按1.2.7 所述步骤,以不同超声功率对荧光素酶表达菌进行破碎,结果显示,(1)以160 W 功率破碎(图5‑A),荧光素酶活性在10 min 内达到最大值,随后逐步下降,破碎25 min 后,两种酶的活性损失均大于45%。(2)以240 W 功率破碎(图5‑B),荧光素酶活性在5 min 内达到最大并迅速下降,破碎结束后,两种酶的活性损失均大于85%。(3)以320 W 功率破碎(图5‑C),荧光素酶活性在10 min内就经由升高到近乎完全损失,高功率带来的负面效应明显。综合图5 所示结果,认为FLuc 的活性变化确实能够反映出破碎条件过于剧烈的可能,从而为蛋白质活性的保全提供重要参考。
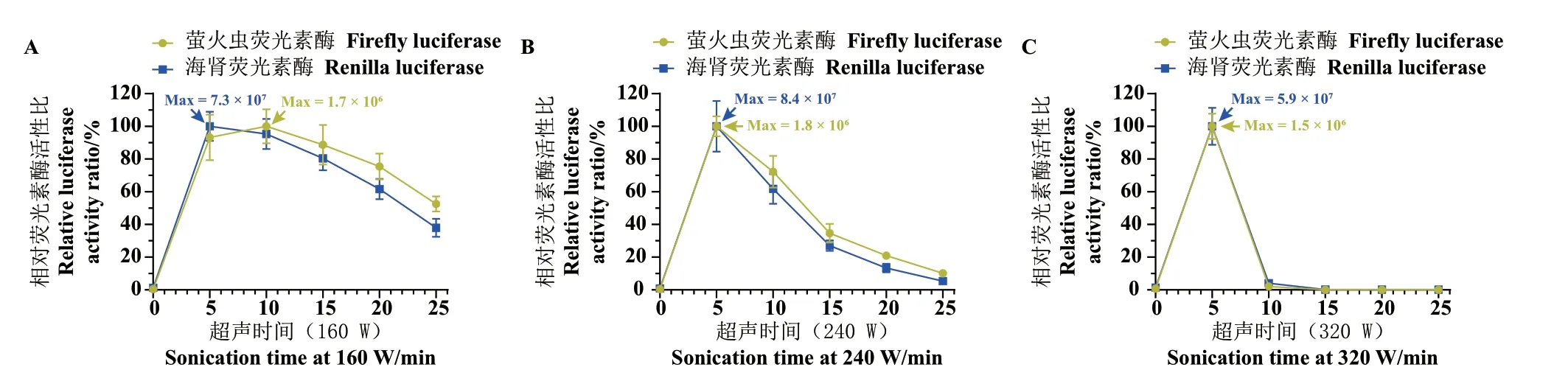
图5 不同超声破碎功率对破碎后荧光素酶活性的影响Fig. 5 Effects of different ultrasonic power on luciferase activity after sonication
2.4 添加荧光素酶对靶蛋白纯化的影响
本研究使用的FLuc 不带纯化标签且用量极少,理论上不干扰靶蛋白的后续纯化。为验证该假设,首先按照1.2.8 所述步骤,拍摄了实验2.1 所使用的FLuc、EGFP 和mCherry 破碎上清液的活性影像,结果如图6‑A-C 所示。可见各上清液中确实含有与样品对应的外源蛋白。随后再将FLuc/EGFP 或FLuc/mCherry 上清液按2∶1(体积比)混合,作为待纯化的样品,按1.2.9 所述步骤进行镍珠吸附检测,结果如图6‑D 所示。由该结果看出,即便在过量添加FLuc 的样品中,该酶也难以被镍珠吸附,其对应条带基本保留在上清液中,与EGFP 和mCherry 的显色结果截然相反。因此,以FLuc 作为破碎辅助定量手段时,其对镍珠纯化过程及产物纯度的影响可忽略不计。
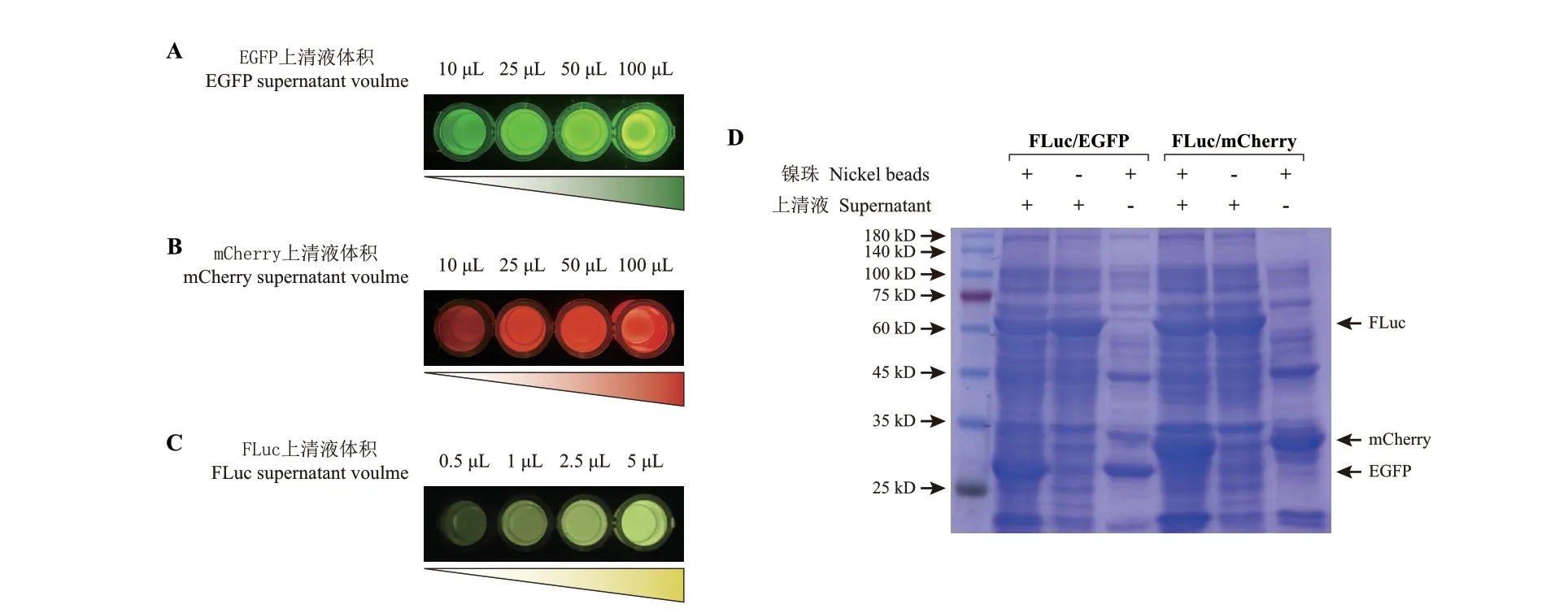
图6 萤火虫荧光素酶的添加对靶蛋白后续纯化的影响Fig. 6 Effect of firefly luciferase addition on the purification of target proteins
2.5 低温冻存对辅助定量效果的影响
按1.2.10 所述步骤,验证菌体冻存对辅助定量效果的影响,结果(图7)显示,两种荧光素酶的活性曲线中,后3 组数据的均值在连续4 次检测中未见下降趋势(酶活仅因检测温度不同,略有波动),说明冻存期间两种荧光素酶的活性并未产生可检出的损失。荧光素酶活性曲线中,0-3 min 内的斜率最大,说明破碎初始阶段,菌体对超声作用最为敏感。而在连续4 次检测中,位于3 min 数据点的数值,与后3 组数据均值之比都在50%-60%之间波动,同样未见明显上升趋势。且图7‑A 所示新鲜菌液的破碎曲线与图7‑B-D 所示冻融菌的破碎曲线,在趋势上也大体相同,可见一次冻融对大肠杆菌细胞壁或细胞膜的破坏有限,并不能大幅降低菌体对外力破坏的耐受性,冻融菌破碎难度与新鲜菌体基本一致。
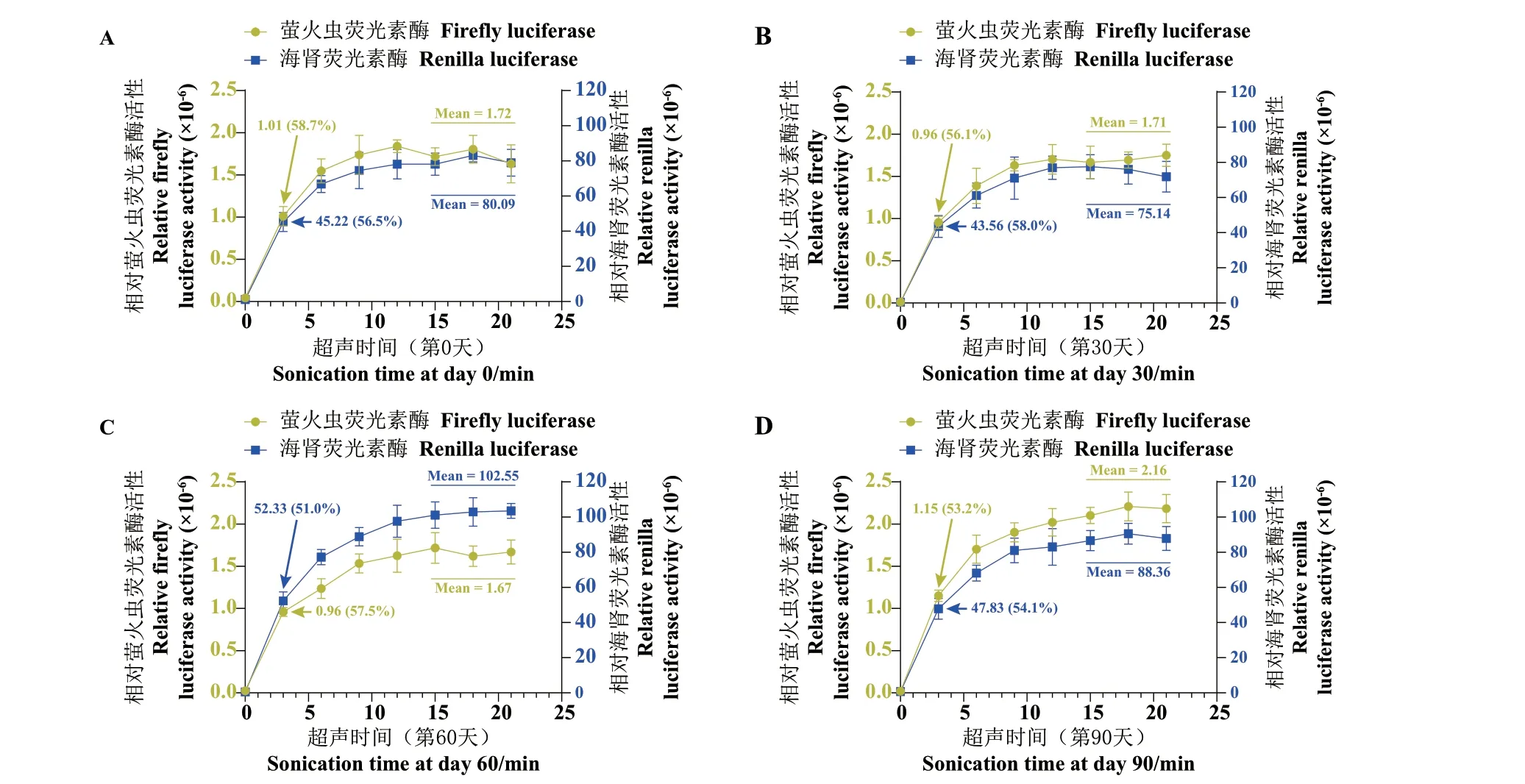
图7 不同冻存时间对萤火虫荧光素酶辅助定量效果的影响Fig. 7 Effect of different cryo-storage time on firefly luciferase-assisted quantification
3 讨论
萤火虫荧光素酶具有灵敏度高、线性范围广、检测操作简单且结果容易量化等特点,在生物学和医学领域具有广泛的应用。本研究提出并验证了大肠杆菌超声破碎的萤火虫荧光素酶辅助定量方法,进一步拓宽了荧光素酶的应用范围,其主要优势在于:(1)实际操作中,由于破碎效果受多种条件的协同影响,使超声处理条件的精细优化较为繁琐。本法利用表达了FLuc 的大肠杆菌作为内标,通过破碎过程中荧光素酶的活性释放情况,表征待测菌体的破碎程度,特别适合靶蛋白活性检测困难的场合,能为大肠杆菌的超声破碎条件优化提供量化指导且不影响靶蛋白的后续纯化,具有良好的可行性。(2)在超声破碎过程中,氧化效应、空化效应,特别是热效应的持续累积[20],可能对靶蛋白的高级结构产生破坏,对终产物的质量产生不利影响。因此,一种能够反映破碎条件是否过于剧烈,从而避免靶蛋白活性损失的指标就显得极为重要。而热稳定性不佳且分子量适中[21-22]的FLuc,恰恰适合监测破碎条件的剧烈程度,并能够给出溶液的整体量化均数,对于稳定性高于FLuc 的靶蛋白,其数据有较高的参考价值,信息量丰富。但仍应注意在实际操作中,破碎条件对靶蛋白活性的影响,还与其自身的结构稳定性有关。对于具体的研究项目,靶蛋白与FLuc相比是否更为稳定,应通过预实验对比确认。若遇到靶蛋白稳定性较差的情况,可考虑使用条件上更为温和的化学或酶法裂解,减小破碎过程中的损失。(3)辅助定量过程中,FLuc 表达菌的用量极少。若FLuc 表达菌需要随目标菌一同培养,则整个定量流程将过于繁琐。而依据实验结果,研究人员可将表达FLuc 的菌体分装后低温冻存,且冻存菌可在至少3 个月内保持相似的检测灵敏度,对需要反复优化破碎条件的研究工作极为有利,也极大地保障了方法的实用性和便捷性。
此外,从本文所示的各项实验结果中也能推断:(1)辅助定量可使用的荧光素酶不仅限于FLuc。在本文所示数据中,RLuc 在破碎过程中的活性变化和FLuc 十分接近,同样可以作为定量依据。但FLuc 在生物学研究中应用较早,试剂盒国产化程度高[23-25],检测成本相对低廉,故成为本研究的首选酶系。(2)因FLuc 的原核表达效率较高,故应避免使用闪光型荧光素酶检测试剂盒。一方面其荧光强度高,容易造成检测器过曝;另一方面,闪光型反应发光时间过短,检测特别是手动加样检测时误差较大,往往导致更大的数据变异系数,对辅助定量极为不利。(3)研究结果显示,超声破碎时,菌体的用量也能显著影响破碎结果。相同功率下,菌体量少则破碎速度快,但破碎造成的蛋白质变性情况也将增加。这可能与菌体用量大时,随菌体破碎而进入外部缓冲液的物质量增加有关。通常情况下,蛋白质自身或环境中极性氨基酸浓度增大时,其稳定性也相应提高。且游离到胞外的分子伴侣蛋白,也可能对靶蛋白的高级结构起到保护或修复的作用,故其整体活性能够维持在比较高的水平[26-27]。(4)本研究中pCold III DNA 载体使用了大肠杆菌的cspA启动子,故大部分大肠杆菌均可作为宿主使用,仅表达量可能有所不同,具备广泛应用的潜力。且从理论上分析,无论使用何种破碎方式或表达宿主种类,只要该宿主表达的FLuc 有活性并累积于胞内,而破碎方式又不影响FLuc 的活性和检测,均可使用本定量方法。(5)若靶蛋白的表达对细菌细胞壁或细胞膜有破坏作用,则两种菌体破碎难度不同,不适用本研究所述的辅助定量方式。
4 结论
本研究建立了以萤火虫荧光素酶为内标的大肠杆菌超声破碎辅助定量方式,利用相对简便的操作和稳定的检测结果,较好地解决了大肠杆菌超声破碎过程中的检测效率问题,适合超声破碎的条件优化或日常实验中的质量监控,为相关研究人员提供了又一实用工具。