基于抗体-适配体夹心生物传感器检测大肠杆菌O157: H7
侯炜辰 叶柯 李洁 张洋子 许文涛 朱龙佼 李相阳
(1. 北京农学院食品科学与工程学院 食品质量与安全北京实验室 农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206;2. 中国农业大学食品科学与营养工程学院,北京 100083;3. 中国农业大学营养与健康系 食品精准营养与质量控制教育部重点实验室,北京 100083)
大肠杆菌(Escherichia coli)是一种革兰氏阴性短杆菌,作为正常菌群存在于人或温血动物的体内,同时也被用作多种基质粪便污染的指标[1-3]。然而,一些进化的大肠杆菌群体已经积累了致病性,对人类造成潜在威胁。
肠出血性大肠杆菌O157: H7 是一种产志贺毒素大肠杆菌,是主要致病性大肠杆菌之一。大肠杆菌O157: H7 是一种罕见的大肠杆菌血清型,1980 年首次作为肠道病原体报道,从食用半熟汉堡后患出血性结肠炎的患者中分离[4]。此后,陆续报告了由大肠杆菌O157: H7 导致的出血性和非出血性腹泻以及溶血性尿毒症综合征(haemolytic uraemic syndrome,HUS)、出血性结肠炎(haemorrhagic colitis,HC)、血栓性血小板减少性紫癜(thrombocytopenic purpu‑ra,TTP),如果未进行及时的治疗会危及生命[5-6]。
目前对于大肠杆菌的检测方法主要依据国标GB 4789.36-2016[7]、免疫学鉴定法[8]和分子学中基于核酸扩增的检测方法[9],此外还有一些光学[10]和电化学[11]等检测手段。目前的标准检测方法仍是传统培养方法,通常基于选择性预富集、富集和镀膜,然后使用菌落形态、糖发酵模式和溶血特性来确认疑似菌落。虽然这种方法廉价且简单,但由于其耗时长且操作繁杂,并不适用于致病菌的快速筛查和即时检测。
适配体是基于DNA 或RNA 的短单链寡核苷酸,当其折叠成独特的三维结构时,可以选择性地靶标结合,具有高亲和力和特异性[12-13]。目前已有报道多种适配体作为诊断工具和疾病治疗药物靶向不同的目标。利用适配体进行检测、分析和量化小分子和蛋白质已经成为时下热点。使用适配体作为探针的一个最重要的优点是该技术不需要动物或体内免疫,从而最大限度地减少批次与批次之间的差异[14-15]。
传统方法由于耗时长,需要培养和核酸提取等步骤,无法满足快速检测需求。为了克服这些限制,及时采取措施防止疾病传播和扩散,本研究旨在开发一种快速、准确的大肠杆菌检测方法,以便在医疗、食品安全和环境监测等领域得到广泛应用,为保护公共卫生和人民的健康提供有力支持。
1 材料与方法
1.1 材料
本研究涉及的核酸适配体序列在上海生工生物技术有限公司合成(表1);大肠杆菌、副溶血性弧菌、金黄色葡萄球菌、阪崎肠杆菌、单核增生李斯特菌、鼠伤寒沙门氏菌、兔多克隆抗体由中国农业大学农业部农业转基因生物安全评估(食品)重点实验室提供;NaCl、MgCl2、KCl、Na2HPO4、KH2PO4购自国药集团化学试剂有限公司;乙二胺四乙酸(EDTA)购自山东拓普生物工程有限公司;吐温20(Tween‑20)购自天津富宇精细化工有限公司;1‑(3‑二甲氨基丙基)‑3‑乙基碳二亚胺盐酸盐(EDC)、N‑羟基琥珀酰亚胺(NHS)购自上海麦克林生化科技有限公司;2‑(N‑吗啉)乙磺酸(MES)购自南京都莱生物技术有限公司。自配制PBS 缓冲溶液(pH 7.4,8 g NaCl,0.2 g KH2PO4,2.9 g Na2HPO4·12H2O,0.2 g KCl,使用蒸馏水定容至1 L)、PBST 缓冲溶液(1 L PBS 缓冲溶液,0.5 mL Tween‑20)、TE(称取1.211 4 g Tris,0.033 6 g EDTA,使用蒸馏水定容至100 mL。)、SPSS(称取NaCl 0.45 g,使用蒸馏水定容至50 mL)、BB结合缓冲液(pH 7.5,6.06 g Tris,8.775 g NaCl 和0.476 g MgCl2溶于800 mL 去离子水中,使用蒸馏水定容至1 L)。
LineGene 9600plus 荧光定量PCR 检测仪购于杭州博日科技有限公司);CF1524R 台式高速冷冻离心机购于杭州恒流科技有限公司;可调式混匀仪旋涡混合器购于北京开源国创科技有限公司。
1.2 方法
1.2.1 抗体-适配体夹心法检测原理 以免疫磁珠(immune magnetic beads, IMB)和裁剪后得到的具有高亲和力的适配体S1‑3 为识别分子,搭建生物传感器检测致泻性大肠杆菌O157:H7。IMB 识别靶标上抗原区域和靶标进行特异性结合,形成IMB‑靶标复合物。当在体系中进一步加入适配体S1‑3 后,靶标上的适配体结合区域会进一步被结合,从而形成IMB‑靶标-适配体三明治夹心复合物。当加入不同浓度的靶标时,复合物的形成比例也将不同,对其进行qPCR 实验,根据其阈值周期数值(cycle thr‑eshold value,Ct)变化即可对靶标进行量化(图1)。
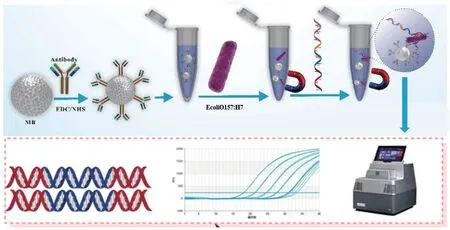
图1 抗体-适配体夹心法检测大肠杆菌原理图Fig. 1 Schematic diagram of antibody aptamer sandwich method for detecting Escherichia coli
1.2.2 适配体的裁剪 取生长对数期的大肠杆菌培养物1 mL 于6 000 r/min 4℃离心5 min 移去上清,使用BB 清洗3 遍,再使其重悬于1 mL BB 中。将合成的适配体溶解于BB 中(100 μmol/L)并稀释至1μmol/L,95℃孵育10 min,冰上立即冷却10 min 以使核酸变性,便于后续与靶标的充分结合。取20 μL(1 μmol/L)适配体与180 μL 重悬在BB 中的大肠杆菌于25℃,200 r/min 孵育1 h 后,8 000 r/min 离心5 min,并用BB 漂洗5 次。将漂洗完成的菌体内加入100 μL TE 缓冲溶液,95℃下孵育10 min,立即4℃ 12 000 r/min 离心15 min,将上清稀释至合适倍数后做qPCR 扩增模板。qPCR 反应体系总体积为20 μL:0.6 μL FP 和RP,10 μL 2×Universal SYBR qPCR Mix,2 μL 模板Apt,去离子水6.8 μL。反应体系在95℃下预变性10 min;95℃下变性10 s,在60℃下退火及延伸30 s,经过39 个循环。设置阴性对照组为不加入适配体其他操作相同,利用其Ct 值得出适配体裁剪效果。
1.2.3 免疫磁珠的制备 本实验采用EDC/NHS 两步法进行IMB 的制备。取100 μL 磁珠(magnetic beads,MB)至离心管中,磁性分离去除上清液,用200 μL MEST 溶液进行磁性分离洗涤2 次,然后移除上清液。迅速加入新鲜配制的100 μL EDC 溶液和100 μL NHS 溶液到装有磁珠的离心管中,漩涡混匀使磁珠充分悬浮,25℃活化30 min,期间保持磁珠的悬浮状态,200 μL 偶联液反复洗涤3 次,磁分离去除上清;向其中加入40 μL 纯化抗体置于摇床200 r/min 振荡1 h,保持MB 处于单分子悬浮状态;然后加入100 μL 封闭液孵育30 min,以封闭未反应的活化基团,磁分离洗涤3 次弃上清;最后加入200 μL PBS 缓冲液放于4℃冰箱备用。
1.2.4 抗体- 适配体夹心qPCR 法检测大肠杆菌 制备完成IMB 后,加入不同浓度的培养至对数生长期的大肠杆菌,室温孵育1 h,使用BB 反复清洗磁珠3 次,以充分去除未结合的靶标。向IMB中加入100 nmol/L 裁剪适配体充分反应30 min,进行3 次磁分离以去除未结合的融合适配体。qPCR反应体系总体积为20 μL:0.6 μL FP 和RP,10 μL 2×Universal SYBR qPCR Mix,2 μL 制备完成的生物传感器,去离子水6.8 μL。对扩增曲线Ct 值进行数据分析。空白对照不添加靶标物质,其余操作与阳性样本同步进行。除非特殊说明,所有实验均进行3 次重复。
1.2.5 条件优化 由于生物传感器是通过两步反应法完成,且为避免IMB‑适配体偶联,不改变原始设定IMB‑靶标和裁剪适配体孵育时间30 min,对IMB‑靶标孵育时间进行优化,在30-60 min 内改变反应时间,测定其Ct 值变化,选取IMB‑靶标最佳反应时间。
1.2.6 检测性能探究 在最佳条件下,对生物传感器在纯培养物中定量检测大肠杆菌的性能进行了探究。将浓度为106CFU/mL 的大肠杆菌进行10 倍梯度稀释,使用稀释后的菌液进行1.2.4 的操作,根据Ct 值和靶标浓度之间的关系绘制标准曲线,利用Ct值对靶标浓度进行量化。
1.2.7 特异性验证 为探究传感器是否具有特异性,选取金黄色葡萄球菌、沙门氏菌、克罗诺杆菌属(阪崎肠杆菌)、副溶血性弧菌、单增李斯特菌(属间特异性验证)和大肠杆菌ATCC 25922、大肠杆菌ATCC 35218、大肠杆菌CICC 10389、大肠杆菌CICC 10663(种间特异性测试)作为非特异性靶标,和大肠杆菌O157: H7进行对比测试传感器传感能力。
1.2.8 实际样品检测 在实际检测中,往往无法实现对单纯培养基质中大肠杆菌的研究,因此本实验探究了传感器在食品基质中的检测性能。在最佳条件下,对生物传感器在购自华联超市的金典纯牛奶基质中定量检测大肠杆菌的性能进行了探究。对牛奶中3×103、3×104、3×105CFU/mL 的大肠杆菌进行加标回收实验,测定其回收率和相对标准偏差。
2 结果
2.1 适配体裁剪
在对适配体S1 进行截短前,首先对该适配体的亲和力进行评估。通过改变其与菌液结合的适配体的浓度和菌液浓度,评估其Ct 值变化。如图2 所示,当改变与靶标结合适配体的浓度,从10 μmol/L 变为1 μmol/L 时,其Ct 值呈现了10 倍梯度变化的趋势(Ct:8.93-12.02);当改变菌液浓度,从约为108CFU/mL 变为107CFU/mL,而不改变适配体浓度1 μmol/L 时,其Ct 值呈现了10 倍梯度变化的趋势(Ct:12.02-14.96)。且由于适配体浓度在1 μmol/L 时,其梯度变化趋势更为明显,后续裁剪实验中均采用此浓度与靶标结合。
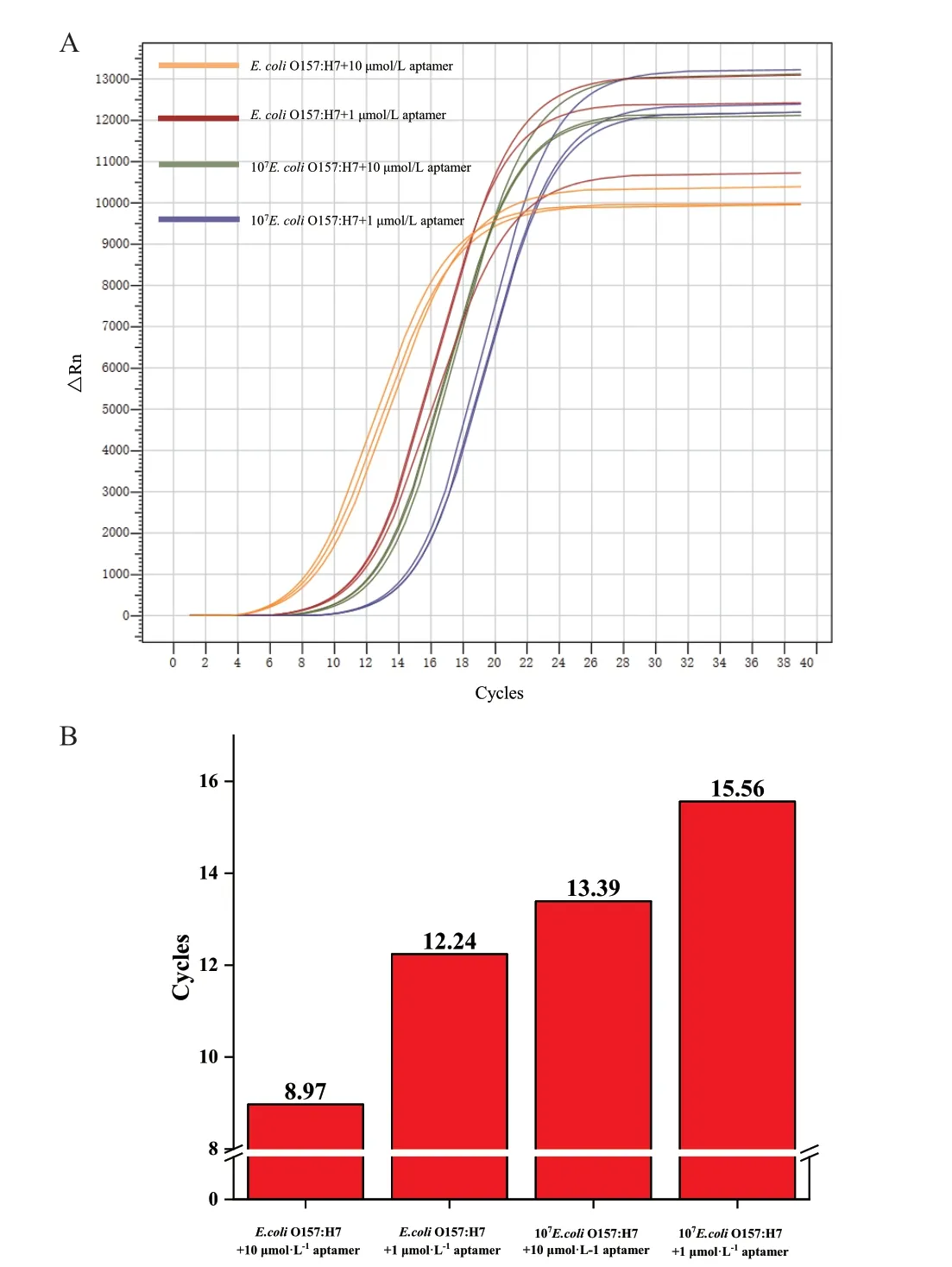
图2 适配体裁剪可行性分析Fig. 2 Feasibility analysis of adaptor clipping
确定适配体S1 具有可行性后,开始对其进行裁剪。通过对其二级结构的预测发现,其在接近5'端区域存在一个茎环结构,推测核心序列位于该区域,因此首先裁剪得到接近5'端22 nt 的裁剪适配体S1‑1,发现其和原适配体序列相比Ct 值从12.46下降至11.66,亲和力有所上升(图3‑A)。虽然变化较小,但相比于原长已经减少了23 nt。第二步验证了减少的23 nt 序列的冗余。裁剪适配体S1‑2 和原始适配体S1 相比,Ct 从12.46 变为了13.69(图3‑B),因此可得出结论减去接近5'端的茎环结构后的适配体S1‑2 的亲和力有所下降。第三步继续对适配体S1 的中间部分进行探究,保留11-30 位碱基即长达20 nt 的序列S1‑3,发现其和原始适配体相比Ct 值明显下降,由12.46 下降至9.87,亲和力大幅度提升,因此得到核心序列S1‑3(图3‑C)。最后对S1‑3 继续进行裁剪至12 nt 得到适配体S1‑3‑1,其Ct值为13.28,亲和力明显下降,推测由于序列太短导致其加上引物后占比过小从而失去和靶标结合能力(图3‑D)。
2.2 免疫磁珠的表征
本实验对IMB 的制备结果进行了动态光散射表征,主要从粒径变化和zeta 电位两方面进行评估。当羧基磁珠与抗体分子经过偶联时,激活羧基官能团并形成稳定的NHS 酯中间体,形成稳定的酰胺键,将抗体与羧基磁珠连接起来,由于羧基磁珠表面的羧基官能团带有负电荷,而抗原分子中的氨基官能团是中性的,因此在偶联过程中,抗原的连接会引入正电荷,导致电位点升高。如图4‑A 所示,MB 粒径约为1 000 nm,与抗体偶联后显著增加至约1 271 nm,表明成功合成了IMB。同时zeta 电位值(图4‑B)表明,偶联前后MB 表面上的电荷也发生了变化,再次验证IMB 的成功合成。

图4 IMB 的表征Fig. 4 Characterization of IMB
2.3 可行性验证
当生物传感器分别加入IMB、靶标和适配体后,生物传感器出现较高响应(图5‑A),当菌液浓度在8×106CFU/mL 时,其Ct 值为7.27。当向生物传感器中加入IMB 和适配体时,传感器出现较低响应(Ct:18.85),推测由于体系中不存在任何菌细胞时,适配体和IMB 出现了非特异性结合从而出现了较低响应。当向生物传感器中加入IMB 和靶标时,生物传感器未出现响应,和预想一致。因此对8×106CFU/mL 菌液连续10 倍梯度稀释4 次,测试其传感能力,结果表明其梯度良好(图5‑B)。

图5 生物传感器可行性分析Fig. 5 Feasibility analysis for biosensor
2.4 条件优化结果
在适配体裁剪过程中,对菌液清洗去除培养基时,将缓冲液由BB 分别替换为PBS、PBST、TE、SPSS。由图6‑A 可得,除PBS 的Ct 值15.45 接近BB 的Ct 值15.23 外,其余缓冲液结合效果均更差,因此缓冲液确定为BB 结合缓冲液。确定缓冲液类型后,改变缓冲液pH 为5.7、6.6、7.5 和8.4,由图6‑B 可得,适配体和靶标在pH 为7.5 时结合效果最好,因为在中性环境中适配体稳定性更好。由图6‑C可得,孵育温度在25℃时适配体和靶标结合效果更好,因此选用更便于实验操作的25℃完成后续实验。

图6 条件优化结果Fig. 6 Condition optimization results
在传感过程中,IMB 和靶标结合,由图6‑D 可得,在30-50 min 内,Ct 值有所变化,当50 min 以后,结合趋于饱和,Ct 值基本不再发生变化。为保证IMB 和靶标充分结合,减少IMB 和适配体的偶联,选取1 h 作为IMB‑靶标孵育时间。
2.5 灵敏度分析
为了确定生物传感器的检测限,将在培养条件下的菌液从8×106CFU/mL 连续10 倍梯度稀释至8×103CFU/mL。由图7 可得,随着细菌细胞浓度的增加,Ct 值也成比例地降低。在(8×103)-(8×106)CFU/mL 范围内,存在良好的线性关系,线性方程为y=18.973 43-1.858 3LgC,回归系数为0.999 74。其中y表示Ct 值,C 表示菌液浓度。通过该线性方程,可以计算出定量限为8×103CFU/mL,检测限为800 CFU/mL。
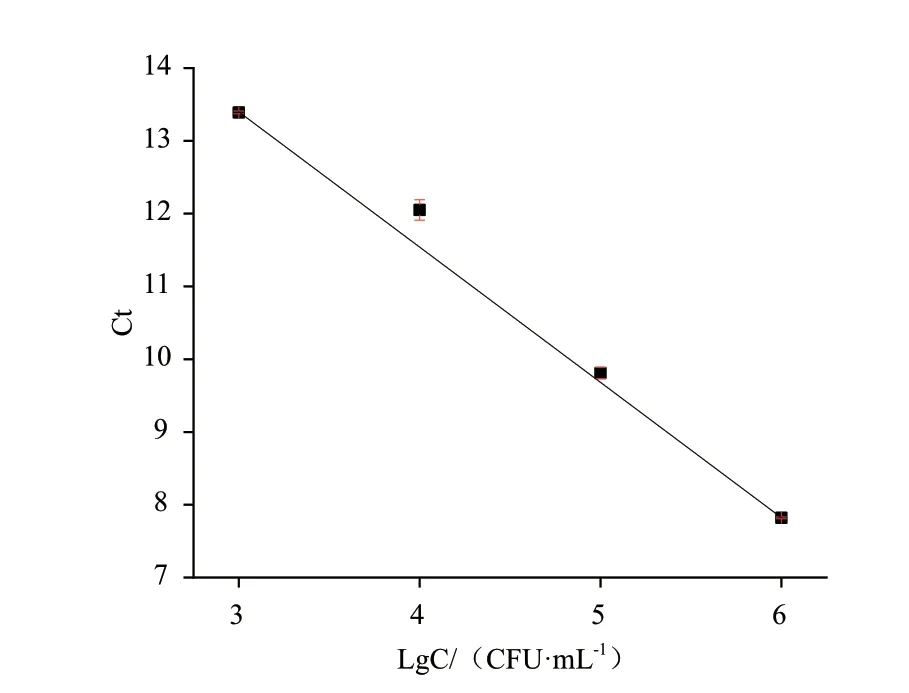
图7 灵敏度测定Fig. 7 Sensitivity measurement
2.6 特异性验证
首先检测了裁剪适配体的特异性。由图8‑A 可以看到,当加入相同浓度(100 nmol/L)的适配体时,靶标菌和其他非特异性靶标相比,具有较高响应,Ct 值为9.44,而非特异性靶标副溶血性弧菌(Ct:16.17)、金黄色葡萄球菌(Ct:15.00)、克罗诺菌属(阪崎肠杆菌Ct:17.94)、单核细胞增生李斯特菌(Ct:18.14)和沙门氏菌(Ct:17.92)均与之有所差距。靶标菌Ct 值和非靶标菌之间存在显著差异(P<0.05),证明该适配体具有良好的特异性。
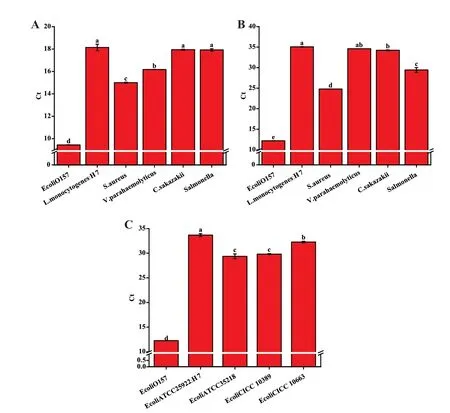
图8 大肠埃希菌 O157∶H7 检测方法的特异性Fig. 8 Specificity of detection method for E. coli O157∶H7
其次检测生物传感器的特异性,向传感器中加入不同靶标测试其传感能力。由于不同菌生长情况不同,为尽可能地减小误差,且更好展现出生物传感器的特异性,靶标浓度稀释至8×104CFU/mL,其他均复苏4 h 后使用。由图8‑B 可以看到,在属间测试中,当加入靶标菌时,生物传感器具有较高响应,Ct 值为12.19,而非特异性靶标金黄色葡萄球菌(Ct:24.79)、沙门氏菌(Ct:29.43)、克罗诺菌属(阪崎肠杆菌Ct:34.22)、副溶血性弧菌(Ct:34.61)、单核细胞增生李斯特菌(Ct:35.06)均与靶标有较大差距,靶标菌Ct 值和非靶标菌之间存在显著差异(P<0.05)。由图8‑C 可以看到,在种间测试中,当加入靶标菌时,生物传感器具有较高响应,Ct 值为12.25,而非特异性靶标大肠杆菌ATCC 25922(Ct:33.67)、大肠杆菌ATCC 35218(Ct:29.35)、大肠杆菌CICC 10389(Ct:29.81)、大肠杆菌CICC 10663(Ct:32.26)均与靶标有较大差距,靶标菌Ct 值和非靶标菌之间存在显著差异(P<0.05)。因此认为该生物传感器对大肠杆菌O157: H7 具有高度特异性。
2.7 实际样品检测
由于生物传感器最终目的是用于食品中大肠杆菌O157: H7 的检测,因此有必要将生物传感器应用于人工污染的食品样品中,对生物传感器在食品中的检测性能进行验证。市面上的食品样品被证实没有可检测到的病原体。在牛奶样品中人工接种约108CFU /mL 的大肠杆菌O157: H7。接种4 h 后,通过传统培养法测得实际细胞数约为3×107CFU/mL。连续10 倍梯度稀释后选取细胞数为3×103、3×104、3×105CFU/mL 使用生物传感器对其进行回收实验,测得其回收率分别为96.3%、103%、108%,RSD 分别为2.15%、2.07%、1.35%(表2)。
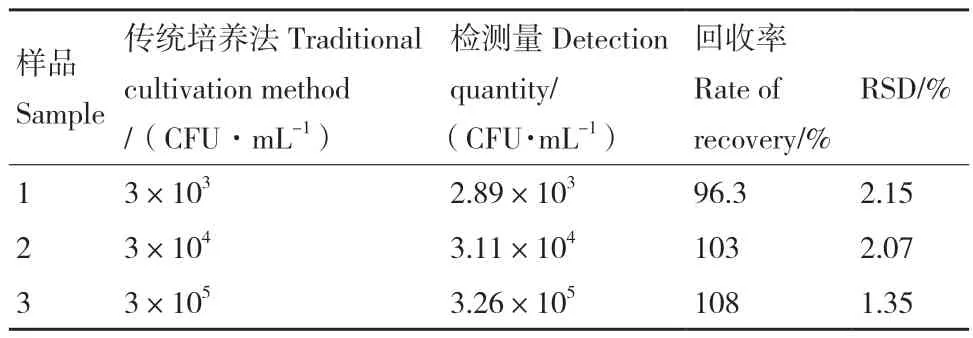
表2 实际样品检测Table 2 Actual sample testing
3 讨论
大肠杆菌O157: H7 是最主要的致病菌之一,常与食源性疾病相关,每年都会引起疾病发生和甚至造成死亡,因此对其构建检测方法十分有必要。传统常规培养法虽然准确度高,但耗时耗力。因此近年来更为快速的基于抗原和抗体的特异性结合的免疫学技术备受青睐。辛思培等[16]建立了一种针对大肠杆菌O157: H7 的双抗夹心化学发光酶联免疫检测方法,检测限为2.5×104CFU/mL,虽然与传统ELISA 方法相比有更好的特异性和灵敏度,但仍需扩增培养10 h,同时单纯的免疫学检测方法易出现假阴性和假阳性结果。核酸类的分子检测方法是检测大肠杆菌和其他食源性病菌的常用手段。除了单一技术的使用,研究者们也已经尝试将免疫学与分子学技术相结合,王淑娟等[17]开发了一种基于金属有机骨架免疫磁珠富集结合多酶恒温核酸快速扩增的检测大肠杆菌O157:H7 的方法,检测限为1.18×105CFU/mL。
近年来生物传感器技术在致病菌菌株检测方面取得了巨大的进步,并成为一种备受大众认可的通用分析工具[18]。樊凯等[19]开发了用于检测食品中大肠杆菌O157:H7,通过测量HRP 酶催化之后的过氧化氢的氧化还原电流,来实现电化学免疫生物传感器,能在(5.2×10)-(5.2×106) CFU/mL 的动态检测范围内实现食品中大肠杆菌的检测。以适配体作为识别原件,将生物识别事件转化为可测量的物理或化学信号,信号检测与处理系统则负责将信号转化为可读的结果的优势更为突出。
本文章利用免疫磁珠的捕获作用和磁分离,并通过多克隆抗体和裁剪得到的适配体搭建生物传感器。使用传统的PCR 检测由于取样小,磁珠技术在检测的过程中可以排除样品基质性质的干扰,从而提高检出率,缩短样品中病原菌富集的时间[20]。在前人研究的基础上,将45 nt 长的适配体序列裁剪至20 nt,得到其核心序列。从核酸文库中选择的全长适配体长度一般约为80 nt,但发挥靶体接触作用的区域通常为10-15 nt[21]。在某些条件下,非必需核苷酸的存在会干扰适配体与靶分子的结合。多余的和不必要的核苷酸被消除后会提高其亲和力。当在体系中进一步加入适配体S1‑3 后,靶标上的适配体结合区域会进一步被结合,从而形成IMB‑靶标-适配体三明治夹心复合物。加入不同浓度的靶标时,复合物的形成比例也将不同,使用实时荧光定量PCR 对靶标进行检测,可以根据其Ct 值变化即可对靶标进行量化,最终实现对大肠杆菌O157:H7 的定量检测。将该生物传感器引入纸基技术或微流控技术,可以实现高通量的样品处理和便捷快速检测,能够进一步缩短在实际应用中的检测时间。
4 结论
本文成功构建了一种用于检测大肠杆菌O157:H7 的抗体-适配体夹心生物传感器。实现了对大肠杆菌O157: H7 在(8×103)-(8×106) CFU/mL 范围内的定量检测,该检测限为800 CFU/mL,该方法具有良好的特异性,操作简便成本低廉,可以在2 h内完成检测。