黑曲霉葡萄糖吸收定量检测的方法建立及其在MstC 功能研究中的应用
高凯月 郭雨婷 杜奕谋 郑小梅 马欣荣 赵伟郑平 孙际宾
(1. 天津科技大学生物工程学院,天津 300457;2. 中国科学院天津工业生物技术研究所,天津 300308;3. 国家合成生物技术创新中心,天津 300308;4. 中国科学院大学,北京 100049;5. 山东福洋生物科技股份有限公司,德州 253100)
黑曲霉(Aspergillus niger)是有机酸与酶制剂的重要工业生产菌株,黑曲霉生产的柠檬酸全球年产达200 万t,并以每年5%的速度递增[1]。黑曲霉所生产的葡糖淀粉酶、葡萄糖氧化酶与植酸酶等大宗酶制剂占有较大的市场份额[2]。黑曲霉具有强大的水解酶系可快速将多聚葡萄糖分解为葡萄糖,由葡萄糖双转运系统高效转运至胞内,供给细胞生长与发酵生产。作为重要的碳源底物,葡萄糖的摄入吸收直接影响黑曲霉的发酵生产性能。葡萄糖摄入吸收的研究对理解黑曲霉生长发育特性与高效生产性能具有重要理论意义与工业应用价值。
为应对胞外葡萄糖等碳源变化,黑曲霉具有较为复杂的葡萄糖双亲和力转运系统[3]。黑曲霉葡萄糖转运系统包括高亲和力转运系统与低亲和力转运系统,分别在低葡萄糖浓度与高葡萄糖浓度下发挥作用[3]。在黑曲霉葡萄糖转运系统的鉴定方面,基因组分析发现黑曲霉CBS513.88 中具有106 个糖转运蛋白,其中14 个可能为己糖转运蛋白[4]。目前,仅有MstA 等基因鉴定为高亲和力葡萄糖转运蛋白[5-6]。MstC 与MstA 具有不同的表达模式,推测属于低亲和力转运系统[6-7],但尚未有直接的实验证据。由于丝状真具有复杂的菌丝形态与特殊的生理特性,目前对于葡萄糖转运系统的研究还较为有限,尤其是在葡萄糖吸收能力的定量检测上研究较少[8],限制了对黑曲霉葡萄糖吸收转运与关键组分功能的理解认识。
葡萄糖吸收能力多通过细胞无法代谢的葡萄糖类似物来进行检测,常用的葡萄糖类似物包括3‑O‑甲基葡萄糖(3‑O‑methyl glucose, 3‑OMG)与2‑脱氧葡萄糖(2‑deoxyglucose, 2‑DG)等[9]。当被细胞吸收至胞内后,3‑OMG 将由于无法被己糖激酶磷酸化而驻留在胞内,而2‑DG 则被磷酸化为6‑磷酸‑2‑脱氧葡萄糖(6‑phosphate‑2‑deoxyglucose, 6‑P‑2‑DG)后,无法被磷酸葡萄糖异构酶进一步代谢,进而使其在胞内积累来表征葡萄糖的吸收能力[9]。因此,放射性同位素标记如氚标记的3‑OMG 与2‑DG 被广泛用于细胞葡萄糖吸收摄入能力的检测中[8]。虽然放射性同位素标记的检测方法灵敏度高、定量准确,但存在费用昂贵与有辐射损伤的问题,因此非放射性同位素标记的2‑脱氧葡萄糖类似物也逐渐被用于葡萄糖吸收能力的检测[8-9]。例如2‑脱氧葡萄糖类似物(2‑[N‑(7‑nitrobenz2‑oxa‑1,3‑diazol‑4‑yl)amino]‑2‑deoxy‑D‑glucose, 2‑NBDG)是荧光标记的2‑DG,可被细胞吸收后,被己糖激酶磷酸化而驻留在细胞内,释放的荧光信号可作用细胞葡萄糖吸收的示踪剂,来表征细胞葡萄糖吸收能力[9-10]。2‑NBDG由于具有检测方便、分辨率高且无辐射等优势,已应用于哺乳动物细胞与酵母细胞的葡萄糖吸收能力检测中[9-11],但目前在丝状真菌中还尚无相关方法的报道。
针对上述问题,本文首先以2‑NBDG 为葡萄糖吸收转运的示踪剂,利用荧光成像与流式细胞定量检测,优化获得2‑NBDG 的最佳使用浓度与孵育时间,建立黑曲霉葡萄糖吸收能力的定量检测技术流程。然后,利用该方法定量检测黑曲霉低亲和力转运蛋白MstC 的过表达对细胞葡萄糖吸收的影响,并鉴定MstC 的关键活性氨基酸,为葡萄糖转运的改造应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 FastPfu DNA 聚合酶与限制性内切酶购自北京全式金生物技术有限公司。ClonExpress® II 一步重组基因克隆试剂盒购自南京诺唯赞生物科技有限公司。2‑NBDG 购自Thermo 公司;PEG6000、PEG3350 和来源于木霉的裂解酶均购自Sigma 公司;氨苄青霉素、蔗糖、麦芽糖提取物、山梨醇购自Amresco 公司;无尿嘧啶的氨基酸混合物、色氨酸、亮氨酸和组氨酸、琼脂粉、无水麦芽糖、醋酸锂、二硫苏糖醇(DTT)、PBS 缓冲液与Tween‑80 购自北京索莱宝科技有限公司;酵母粉和蛋白胨购自Oxoid 公司。鲑鱼精、氯化钠、无水葡萄糖、磷酸氢二钠、磷酸二氢钾和氯化铵购自国药集团化学试剂有限公司。
1.1.2 菌株、质粒与引物 本研究所使用的所有菌株和质粒均在本实验室保存。本研究所用的菌株、质粒与引物如表1、表2 所示。

表1 本研究所用的菌株与质粒Table 1 Strains and plasmids used in this study

表2 本研究所用引物及其序列Table 2 Primers and their sequences used in this study
1.2 方法
1.2.1 重组表达质粒pRS‑MstC、pRS‑MstCR188K与pOE‑MstC、pOE‑MstCR188K的构建 首先,从Fung‑iDB 数据库[15](https://fungidb.org/fungidb/app)中获得黑曲霉葡萄糖转运蛋白MstC 的核苷酸序列,来设计质粒构建的相关引物(表2)。然后,以黑曲霉D353.8 菌株的反转录cDNA 为模板,以MstC‑F1/MstC‑R1 为引物来扩增mstC基因的cDNA 片段。经核酸琼脂糖电泳检测后,进行PCR 产物纯化。采用ClonExpress® II 一步重组基因克隆试剂盒,再与经限制性内切酶BcuI 和HindIII 处理的质粒片段pRS426 进行DNA 片段重组。然后,热击转化到大肠杆菌Trans1‑T1 感受态细胞。以pRS‑F/pRS‑R 为引物进行菌落PCR 后,挑去正确的阳性克隆,进行质粒提取与DNA 测序验证。DNA 测序正确的质粒,命名为pRS‑MstC。为获得mstC基因的点突变体表达质粒,以pRS‑MstC 为模板,以MstCR188K‑F 与MstCR188K‑R 为引物来在mstC基因中引入点突变。经DNA 测序正确后,质粒命名为pRS‑MstCR188K。为构建在黑曲霉表达质粒,以MstC‑F2/MstC‑R2 为引物,分别以pRS‑MstC 与pRS‑MstCR188K为模板PCR 扩增,获得MstC 与点突变体MstCR188K的编码DNA 片段。然后,经PCR 产物纯化后,采用ClonExpress®II 一步重组基因克隆试剂盒与PacI 和SnaB I 酶切处理后的pXMD7 载体片段进行DNA 重组。经大肠杆菌转化与菌落PCR,筛选阳性克隆后,提取质粒与DNA 测序。经DNA 测序验证正确的质粒,分别命名为pOE‑MstC 与pOE‑MstCR188K。
1.2.2 葡萄糖转运蛋白的酵母重组表达菌株的构建与验证 利用醋酸锂化学转化方法将重组表达质粒pRS‑MstC 与pRS‑MstCR188K转化至无葡萄糖转运蛋白酵母菌株(Saccharomyces cerevisiae)EBY.VW4000中。首先,进行酵母感受态细胞的制备:挑取酵母菌株EBY.VW4000 的新鲜单菌落在5 mL YPM 培养基中,30℃、200 r/min 预培养24 h,然后选取生长最好最快的进行后续实验。取2 mL 培养物转接入50 mL YPM 培养基中,30℃,200 r/min 继续培养6-9 h。至OD600达到0.8-1.5 后,开始在冰上制备感受态细胞。用无菌去离子水进行洗涤后,获得的细胞悬液即为酵母感受态细胞。然后,在500 μL 酵母感受态细胞中分别加入2 μg 重组表达质粒pRS‑MstC与pRS‑MstCR188K、50 μL 1 mol/L LiAc、20 μL 1 mol/L DTT、15 μL 鲑鱼精DNA(10 mg/mL)以及160 μL 50% PEG‑3350,42℃孵育30 min 保持不动,2 500 r/min 离心5 min 收集菌体,重悬于250 μL 无菌去离子水,涂布于营养缺陷型加有20 g/L 麦芽糖的SD固体平板上,在30℃培养3-5 d 直至菌落长出。挑取单菌落进行酵母菌落PCR 验证,以pRS‑F/pRS‑R为引物,来筛选阳性酵母重组菌株。
1.2.3 葡萄糖转运蛋白的黑曲霉过表达菌株的构建与验证 利用PEG 介导的原生质体DNA 转化方法将重组表达质粒pOE‑MstC 与pOE‑MstCR188K转化至黑曲霉D353.8 菌株的原生质体中。黑曲霉DNA 转化方法参考文献[14],首先,进行原生质体悬液的制备:将D353.8 菌株的孢子悬液在34℃、220 r/min培养16-18 h。然后采用含有体积质量分数为1.0%的来源于哈茨木霉(Trichoderma harzianum)的裂解酶的酶解体系,在37℃孵育2-3 h,裂解菌体的细胞壁以制备原生质体。用STC 进行洗涤后,获得原生质体悬液。然后,在100 μL 原生质体中分别加入2 μg 重组表达质粒pOE‑MstC 与pOE‑MstCR188K以及25% PEG 缓冲液,冰浴后依次加入1 mL 25% PEG缓冲液,加入2 mL STC 和10 mL 预热的MMSA 上层培养基,然后平铺至MMSA 下层培养基上,在34℃倒置培养5 d。挑取转化子在CMA 固体平板上进行单孢子划线分纯,以获得稳定遗传的转化子。然后,采用天根植物基因组提取试剂盒来提取各转化子的基因组。最后,以各转化子基因组为模板,以MstC‑F2/MstC‑R2 为引物进行PCR 验证,筛选阳性黑曲霉重组菌株。
1.2.4 黑曲霉孢子摄取2‑NBDG 的样品处理 黑曲霉孢子摄取2‑NBDG 的样品处理主要包括黑曲霉孢子的预处理与2‑NBDG 的孵育两个步骤。首先,利用生理盐水洗涤培养96 h 的CMA 固体平板上的孢子,制备新鲜的孢子悬液,以保证孢子活力。以将1×106个黑曲霉孢子接种于1 mL MM 培养基中,在34℃,200 r/min 的条件下进行预培养 4 h。然后,离心收集预培养的孢子后,用等体积PBS 缓冲液洗涤两次。最后,将预培养孢子用含有不同浓度2‑NBDG的PBS 缓冲液进行重悬,在34℃,200 r/min 的条件下孵育不同时间后,再次通过离心收集处理后的孢子,再用等体积PBS 缓冲液洗涤两次后,用于荧光显微成像与流式检测。
1.2.5 黑曲霉孢子摄取2‑NBDG 后的荧光显微成像检测 采用激光扫描共聚焦显微镜Leica TCS SP5 II(Leica)与成像分析软件Leica Microsystems LAS AF‑TCS MP,在100×1.4 NA 油镜下,在激发波长为475 nm,检测波长为550 nm 的条件下,来对2‑NBDG处理的黑曲霉孢子进行成像观察。采用Image J 软件来进行图片处理,每个样品下至少采集50 个孢子的荧光成像图,用于2‑NBDG 的荧光强度的相对定量分析。
1.2.6 黑曲霉孢子摄取2‑NBDG 后的流式定量检测 采用BD Fortessa X‑20 分析型流式细胞仪来定量检测2‑NBDG 孵育后的黑曲霉孢子。流式细胞仪的激发波长设置为488 nm;前向散射电压(forward scatter(FSC)voltage)设置为37;侧向角散射电压(side scatter(SSC)voltage)设置为170;异硫氰酸荧光素电压(fluorescein isothiocyanate(FITC)volt‑age)设置为390。对流式数据进行轻微的门控,以排除明显的错误,如灰尘颗粒、细胞簇和分生孢子聚集体等。每个样品平行共检测10 万个细胞,用于分析荧光强度(FITC)和侧向角散射(SSC)。流式检测结果采用FlowJo 软件(Beckman Coulter Inc., Brea,CA, USA)进行分析。每组样品检测至少3 组平行,各组样品之间的差异采用t‑检验进行统计分析。
2 结果
2.1 基于2‑NBDG的黑曲霉葡萄糖摄取定量检测方法的建立
为摸索合适的2‑NBDG 孵育浓度,将预培养的黑曲霉孢子与不同浓度的2‑NBDG 孵育2 h 后,分别采用荧光显微成像与流式细胞仪来检测黑曲霉孢子吸收2‑NBDG 后的荧光情况,以确认能否以荧光强度来表征黑曲霉细胞的葡萄糖吸收能力。结果如图1 所示,随着2‑NBDG 浓度的增加,黑曲霉孢子吸收2‑NBDG 后,产生的荧光强度逐渐增加。具体来说,当黑曲霉孢子与100 μmol/L 2‑NBDG 孵育后,黑曲霉孢子出现较为微弱的可检测荧光信号;并且在流式细胞检测中,平均荧光强度为510.4±36.5,进入强荧光区域(Q2, FITC‑H>103)的孢子比例为19.6%。当2‑NBDG 的孵育浓度为150 μmol/L 2‑NBDG 时,黑曲霉孢子出现的荧光信号有所增强,流式细胞分析的105个孢子的平均荧光强度提高至712.1±51.2。当孵育浓度进一步增加至添加200 μmol/L 时,但与150 μmol/L 2‑NBDG 的情况相比,并无统计学差异(P=0.24)。因此,选择2‑NBDG 的孵育浓度为150 μmol/L,用于后续检测。
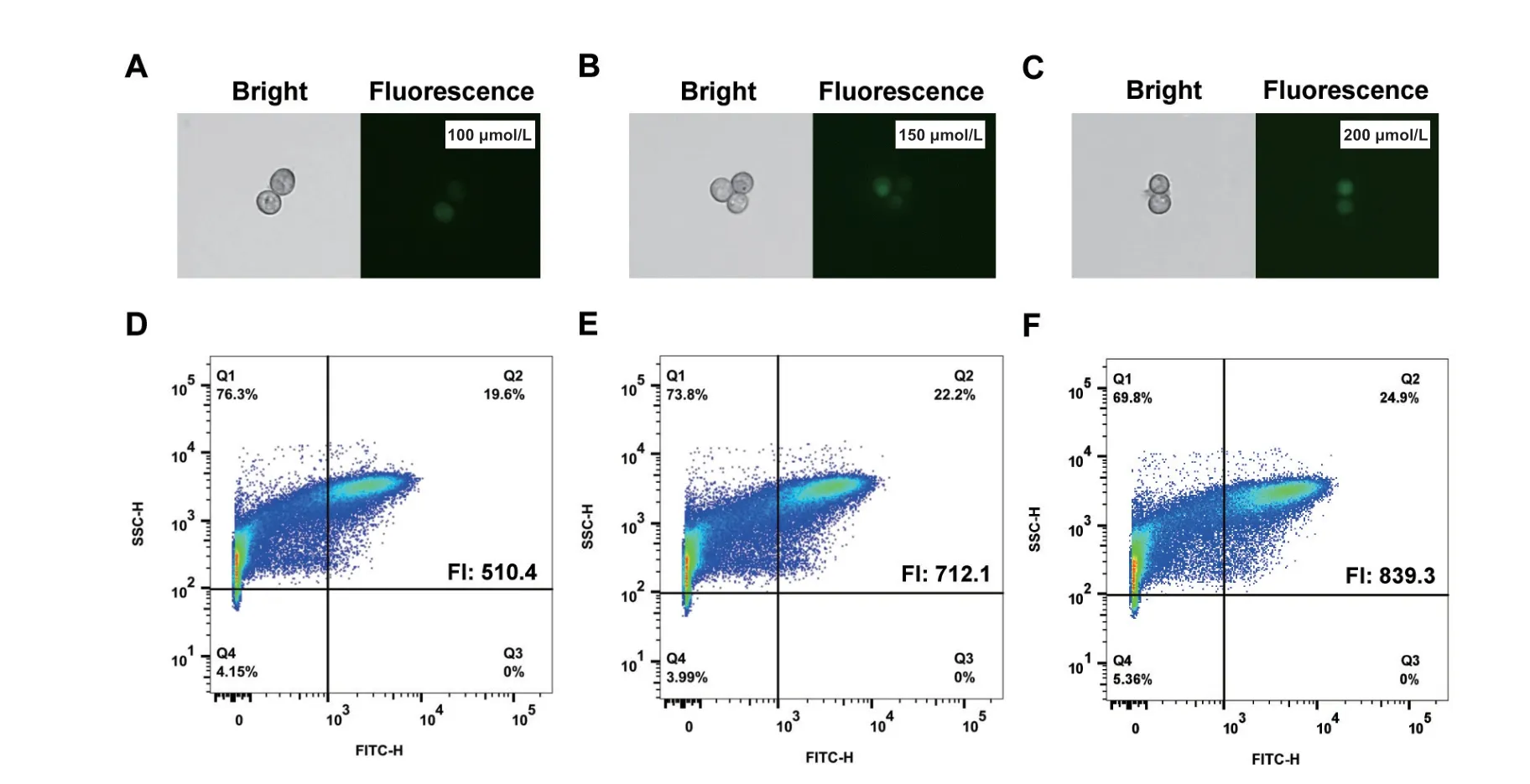
图1 不同2-NBDG 孵育浓度对葡萄糖吸收荧光检测的影响Fig. 1 Effect of 2-NBDG concentration on the glucose uptake in A. niger
为了检测2‑NBDG 孵育时间是否影响黑曲霉孢子吸收2‑NBDG 后的荧光强度,本研究对预培养孢子与2‑NBDG 孵育后的荧光强度进行了跟踪检测。将预培养后的黑曲霉孢子与150 μmol/L 2‑NBDG 孵育后,在2 h 与4 h 进行跟踪取样,然后采用荧光显微成像与流式细胞仪来检测黑曲霉孢子对2‑NBDG吸收的荧光强度。结果如图2 所示,随时间的增加,预培养后的黑曲霉孢子吸收2‑NBDG 后可检测到的荧光强度逐渐增加。黑曲霉孢子与2‑NBDG 孵育2 h 后,黑曲霉孢子出现可检测到的荧光信号,但仍然有部分孢子的荧光信号较弱。在流式细胞检测中,孵育2 h 后的可检测到的平均荧光强度从0 h 时的40.1±2.7 增加到609.5± 4.5,进入强荧光区域(Q2,FITC‑H>103)的孢子比例增长到17.4%。当2‑NBDG孵育时间增加至4 h 时,孢子中荧光信号进一步增强,在所检测的10 万个孢子中,29.6%的孢子出现较强的荧光信号(Q2, FITC‑H>103),平均荧光强度达1 877.0±2.5,这说明与2‑NBDG 孵育4 h 后,通过流式细胞仪可有效对孢子吸收2‑NBDG 后产生的荧光信号。同时,孢子的显微成像检测表明该处理后的孢子处于未萌发未产生菌丝的状态,因此可保证其在流式细胞仪中的顺利检测。综合考虑孢子的状态与荧光信号,因此选取4 h为黑曲霉孢子与2‑NBDG孵育时间,用于后续检测。
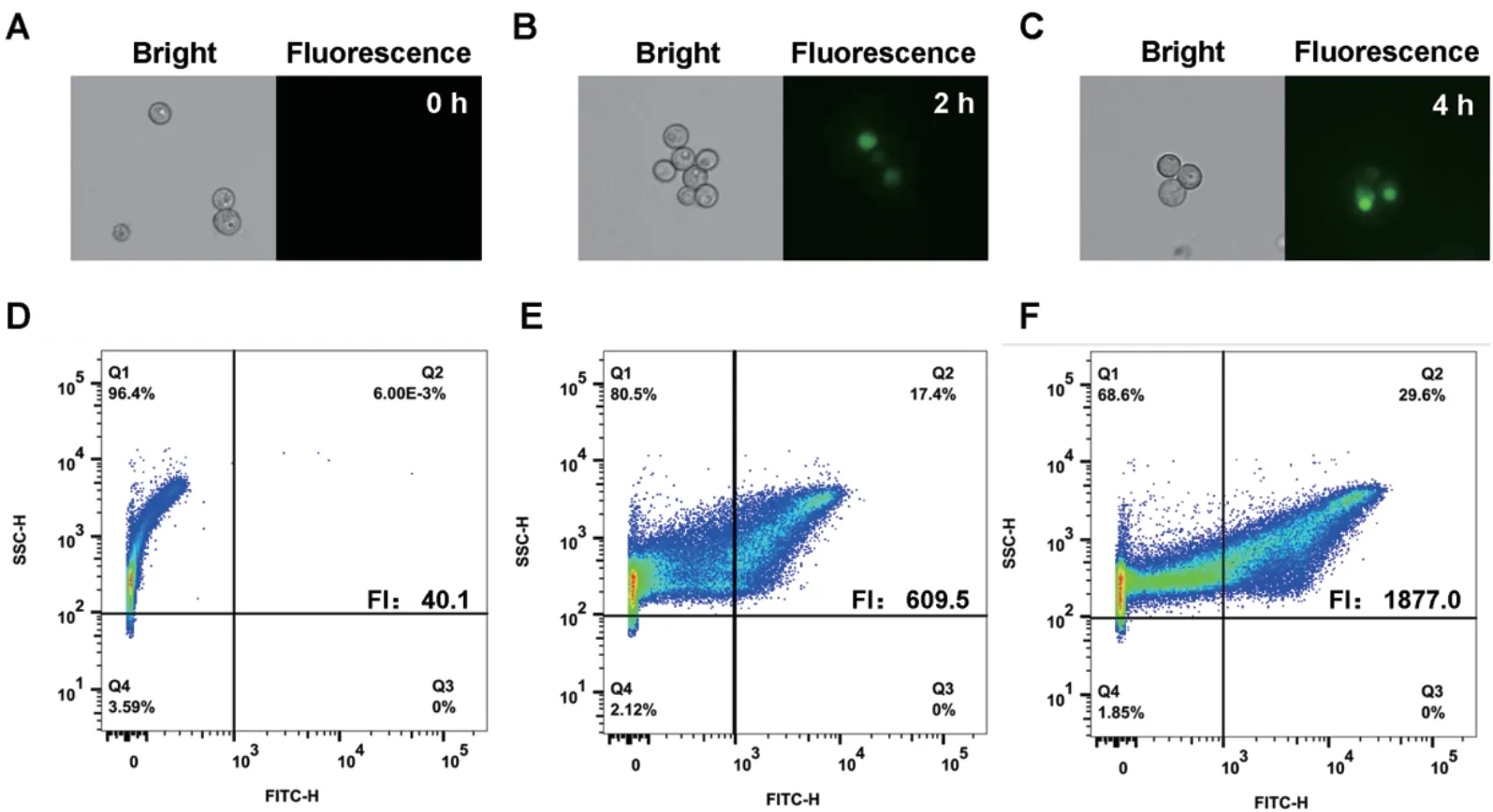
图2 不同2-NBDG 孵育时间对葡萄糖吸收荧光检测的影响Fig. 2 Effect of 2-NBDG incubation time on the glucose uptake fluorescence detection in A. niger
2.2 黑曲霉葡萄糖转运蛋白MstC及其突变体的葡萄糖转运能力检测
虽然有文献预测MstC 可能属于低亲和葡萄糖转运系统,但并未系统检测MstC 的转运活性。为检测MstC 的转运能力,本文首先以无糖转运蛋白酵母菌株EBY4000 为宿主,构建了黑曲霉MstC 的酵母重组菌株EBY.MstC,然后检测EBY.MstC 在不同浓度葡萄糖下的生长情况。酵母菌株EBY4000 由于敲除了内源的所有己糖转运蛋白,而无法在以己糖为唯一碳源的无机盐培养基上生长,仅能在麦芽糖培养基上生长。因此,导入外源葡萄糖转运蛋白后的生长情况可用于表征外源葡萄糖转运蛋白的转运能力,酵母重组菌株生长越强,表明其外源转运蛋白的转运能力越强。如图3 所示,MstC 的表达可使无糖转运蛋白酵母菌株EBY4000 在葡萄糖为唯一碳源的培养基上生长,表明MstC 为葡萄糖转运蛋白。同时,EBY.MstC 可在0.02%、0.2%与2%的不同葡萄糖浓度下生长,且在高葡萄糖浓度下生长显著高于低葡萄糖浓度下的生长。这表明MstC 在不同葡萄糖浓度均可发挥葡萄糖转运的作用。
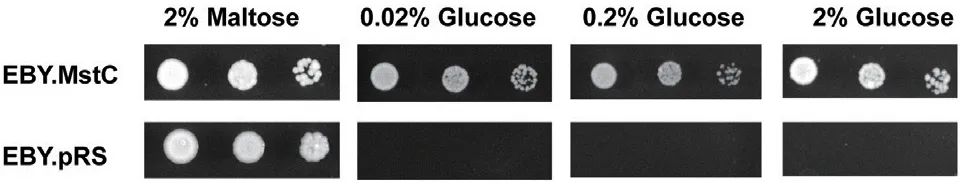
图3 酵母重组菌株EBY.MstC 在不同葡萄糖浓度下的生长情况Fig. 3 Effect of glucose concentration on the cell growth of recombinant E. coli strain EBY.MstC
2.3 黑曲霉低亲和葡萄糖转运蛋白MstC及其突变体的葡萄糖摄取能力检测
为检测MstC 对黑曲霉葡萄糖吸收的影响,本研究利用组成型启动子PgpdA构建了MstC 的过表达菌株OE.MstC。通过基因型验证后,采用本研究建立优化的2‑NBDG 葡萄糖吸收定量检测方法,检测了MstC 的过表达对黑曲霉葡萄糖吸收的影响。结果如图4 所示,当过表达菌株OE.MstC 的孢子预培养后与2‑NBDG 孵育后,与出发菌株D353.8 相比,所检测的孢子具有更强的荧光信号。进一步流式细胞的定量分析发现,在过表达菌株OE.MstC 所检测的105个孢子中有41.9%的孢子具有较强的荧光信号(Q2,FITC‑H>103),而出发菌株D353.8 的强荧光的孢子比例为24.9%。同时,过表达菌株OE.MstC 平均荧光强度达4 359.5±12.5,显著高于出发菌株D353.8(P为0.025),是出发菌株D353.8 平均荧光强度的2.44 倍。这表明MstC 在黑曲霉葡萄糖吸收中起重要的作用。
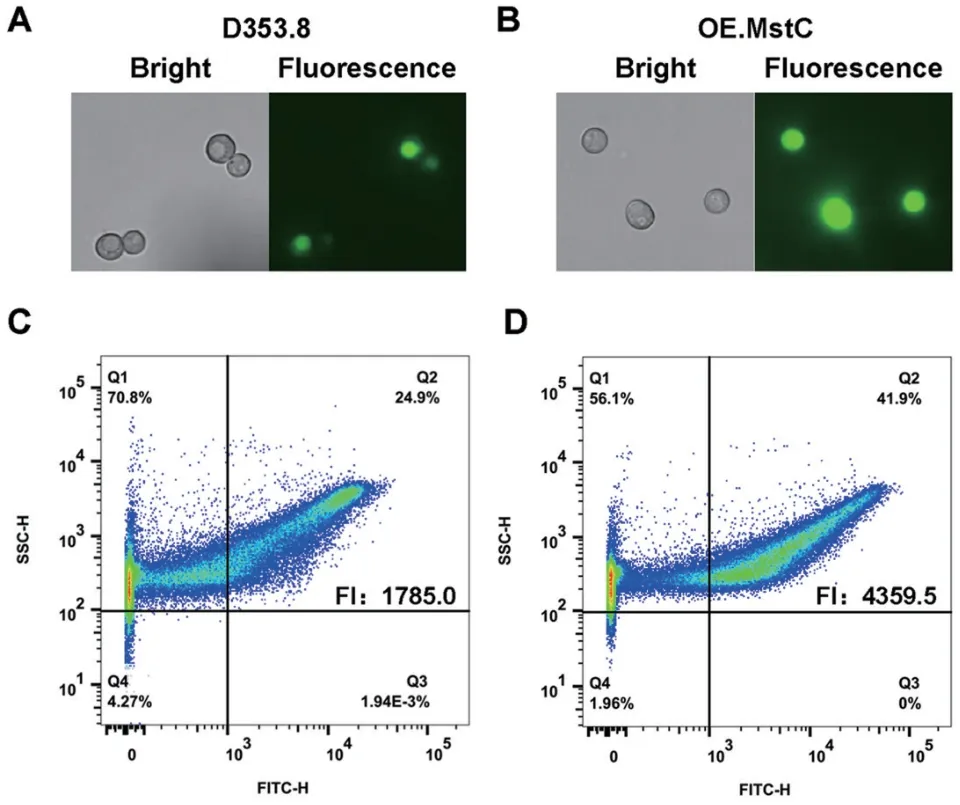
图4 黑曲霉MstC 过表达菌株的葡萄糖吸收能力检测Fig. 4 Glucose uptake capacity detection based on MstCoverexpressed strain A. niger
2.4 黑曲霉葡萄糖转运蛋白MstC的关键活性氨基酸的预测与鉴定
为鉴定MstC 中起关键作用的氨基酸残基,本研究首先利用TMHMM 预测了MstC 的跨膜螺旋,如图5 所示,MstC 具有12 个跨膜螺旋,N‑端与C‑端均位于细胞质中。结合在粗糙脉孢霉(Neurospora crassa)葡萄糖转运蛋白关键氨基酸的鉴定与多序列比对分析,本研究预测发现,与粗糙脉孢霉葡萄糖转运蛋白关键氨基酸相对应的氨基酸位点,即位于MstC 的第4 个跨膜螺旋与第5 个跨膜螺旋之间188 位的精氨酸Arg188 可能为影响MstC 葡萄糖转运功能的关键氨基酸。为鉴定这个氨基酸残基,本研究构建了该位点的突变体MstCR188K及其酵母重组菌株EBY.MstCR188K。当在0.02%、0.2%与2%的不同葡萄糖浓度下进行培养时,酵母重组菌株EBY.MstCR188K均无法生长,与仅转化空载体的阴性对照菌株EBY.pRS 具有同样的表型。这表明MstC 中R188K 的突变直接导致MstC 葡萄糖转运能力的丧失,即Arg188 为影响MstC 葡萄糖转运的关键氨基酸位点。
为进一步在黑曲霉中验证这一结果,本文构建了MstC 突变体MstCR188K的黑曲霉过表达菌株OE.MstCR188K,并采用本文建立的2‑NBDG 葡萄糖吸收定量检测方法,对黑曲霉过表达菌株OE.MstCR188K进行葡萄糖吸收能力的定量检测。结果如图6 所示,当MstC 突变体的过表达菌株OE.MstCR188K的孢子预培养后与2‑NBDG 孵育后,其所检测到的荧光信号与出发菌株D353.8 无显著差异(P为0.13),其孢子的平均荧光强度为1 553.5±12.5;但显著低于野生型MstC 的过表达菌株OE.MstC 的平均荧光强度(P为0.005 7)。这表明MstC 的Arg188 在葡萄糖转运中起到重要的作用,是决定MstC 葡萄糖吸收的关键氨基酸位点。
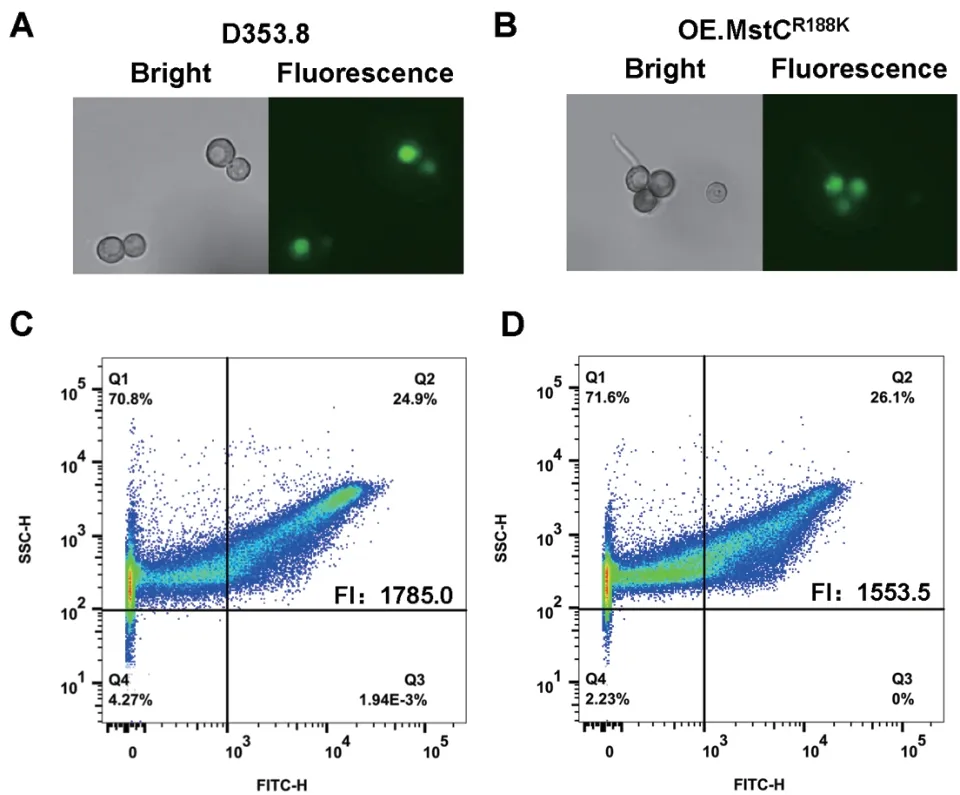
图6 黑曲霉MstC 突变体过表达菌株OE.MstCR188K 的葡萄糖吸收检测Fig. 6 Glucose uptake capacity detection of A. niger MstC point mutant over-expressed strain OE.MstCR188K
3 讨论
黑曲霉等丝状真菌是重要的有机酸与酶制剂工业生产菌株[1],具有较为复杂的葡萄糖转运系统。作为重要的碳源与信号分子,葡萄糖的摄入吸收直接影响黑曲霉的发酵生产性能,因此葡萄糖摄入吸收的研究对理解黑曲霉生长发育特性与改造优化较为重要。本研究利用葡萄糖衍生物2‑NBDG 建立了黑曲霉葡萄糖吸收能力的定量检测方法,并利用该方法鉴定了黑曲霉葡萄糖转运蛋白MstC 及其突变体对黑曲霉葡萄糖吸收的影响。
荧光标记的葡萄糖衍生物2‑NBDG 已在哺乳动物细胞与酵母细胞的葡萄糖吸收能力检测中得到应用[9,11],被细胞吸收后,可被己糖激酶磷酸化而驻留在细胞内,释放的荧光信号可表征细胞葡萄糖吸收能力,具有检测方便、分辨率高且无辐射等优势。但由于丝状真菌具有复杂的菌丝形态[16],其菌丝体难以直接进行荧光检测。针对这一问题,丝状真菌的单倍体孢子[14]或萌发的孢子[17]分别被用于进行流式细胞检测,来定量细胞的荧光强度。在本研究建立黑曲霉葡萄糖吸收定量检测方法的过程中发现,虽然萌发后的孢子长出菌丝虽然可以吸收2‑NBDG在细胞内产生明显的细胞信号,但由于在预培养的过程中,孢子存在萌发速度的差异,导致不同菌丝间的荧光信号差异较大,且在流式细胞分析中可能会形成相互聚集的菌丝,而导致无法正常检测。本研究采用预培养4 h 的孢子来进行荧光定量分析,此时的孢子处于吸水膨胀的阶段,但还未长出菌丝,从而保证样品间荧光定量分析的准确性。预培养的孢子与2‑NBDG 孵育时间越长,所检测的细胞内荧光强度越高。但由于需同时考虑孵育后孢子的状态,因此在判断最佳孵育时间时,需要跟踪检测孢子在孵育过程的萌发状态。例如,本研究发现当预培养的孢子与2‑NBDG 孵育4 h 时,所检测的孢子具有明显的荧光信号,且在不同样品进行检测时具有较好的重复性,因此黑曲霉孢子与2‑NBDG 的最佳孵育为4 h 用于黑曲霉葡萄糖吸收定量检测。
丝状真菌多具有复杂的双亲和力葡萄糖转运系统[3]。在粗糙脉孢霉中,Hgt1 与Hgt2 为高亲和力葡萄糖转运系统的关键组分,而Glt1 为低亲和力葡萄糖转运蛋白的主要组分,两个不同葡萄糖转运系统具有不同转录表达调控模式,从而在不同葡萄糖浓度下发挥作用[18]。在黑曲霉中,Vankuyk 等[5]鉴定了MstA 为首个鉴定的高亲和力转运蛋白,但其敲除后黑曲霉仍可正常生长,表明葡萄糖转运系统较为复杂[6]。Jørgensen 等[6]发现在批次培养中高亲和力转运蛋白MstA 并不表达,而另一个转运蛋白MstC 则具有较为显著的表达,推测MstC 与MstA具有不同的表达模式,推测MstC 可能为低亲和力转运蛋白,但并未提供直接的实验证据。本文对MstC与不同来源的葡萄糖转运蛋白进行多序列比对分析与进化分析时发现,MstC 与低亲和力葡萄糖转运蛋白的同源性更高。在无己糖转运蛋白酵母中的葡萄糖转运活性检测发现,MstC 在不同葡萄糖浓度下均可转运葡萄糖,与高亲和力葡萄糖转运蛋白仅在低葡萄糖浓度下发挥作用显著不同。由此可见,MstC为黑曲霉低亲和力葡萄糖转运系统的主效组分。当在黑曲霉中,采用强组成型启动子PgpdA来过表达MstC 时,可使黑曲霉葡萄糖转运能力提高至出发菌株的2.44 倍。这与MstC 同糖酵解途径关键酶的过表达可提高黑曲霉苹果酸转化率的结果(从1.27 mol/mol 提高到1.64 mol/mol[7])相一致,表明MstC可用于黑曲霉葡萄糖吸收转运强化的重要改造靶点。
葡萄糖转运蛋白中活性氨基酸是影响转运能力的关键,比如酿酒酵母Hxt1 位于第8 个跨膜螺旋的N370A 会导致转运能力的丧失[9]。在粗糙脉孢霉中,低亲和力葡萄糖转运蛋白Glt1 中,位于第4 个跨膜螺旋与第5 个跨膜螺旋之间的保守精氨酸Arg167的点突变R167K 均会导致其葡萄糖转运活性的丧失[18]。为鉴定黑曲霉MstC 中的关键氨基酸位点,本文通过多序列比对鉴定出这两个跨膜螺旋之间的保守氨基酸Arg188。该位点的单点突变R188K 也导致MstC 葡萄糖转运能力的丧失,当R188K 在黑曲霉中进行过表达时,其葡萄糖转运能力与出发菌株基本一致,无显著差异。这说明黑曲霉葡萄糖转运蛋白MstC 的Arg188 是决定葡萄糖转运活性的关键氨基酸。目前,对于该保守精氨酸影响转运蛋白的葡萄糖吸收的具体机制还尚未有报道。考虑到该位点处于第4 个跨膜螺旋与第5 个跨膜螺旋之间的细胞质侧,该位点的突变可能会使转运蛋白跨膜螺旋的构象改变,进而影响整个转运蛋白的跨膜通道的结构,有可能进一步导致转运蛋白无法识别胞外的葡萄糖或者使葡萄糖无法通过跨膜通道。
4 结论
本研究利用葡萄糖衍生物2‑NBDG 建立了黑曲霉葡萄糖吸收定量检测方法,并确立2‑NBDG 的最佳使用浓度与孵育时间。通过MstC 的过表达使黑曲霉的葡萄糖吸收能力提高1.44 倍,同时发现R188K 的点突变会导致MstC 葡萄糖转运活性的丧失,Arg188 位点为MstC 的关键活性氨基酸。本研究不仅为丝状真菌葡萄糖吸收的定量研究提供了切实可行的技术方法,还揭示了MstC 及其关键突变体对黑曲霉葡萄糖吸收的作用,为黑曲霉葡萄糖转运系统的认识与开发利用奠定理论基础。