S-腺苷-L-甲硫氨酸依赖的3-氨基-3-羧基丙基利用酶研究进展
何家乐 董敏
(天津大学化工学院 天津大学系统生物工程教育部重点实验室,天津 300072)
S‑腺苷‑L‑甲硫氨酸(S‑adenosyl‑L‑methionine,SAM)是除三磷酸腺苷(ATP)外,被有机体应用最广泛的辅因子[1]。SAM 分子中的硫原子通过3 个C‑S 键分别与甲基、5'‑脱氧腺苷(5'‑deoxyadenosine,5'‑dA)和3‑氨基‑3‑羧基丙基(3‑amino‑3‑carboxy‑propyl,ACP)相连,由于形成的锍鎓结构,这3 个C‑S键都不稳定[2]。有机体中不同的SAM 依赖酶可以选择性地裂解其中不同的C‑S 键来催化各种生化反应(图1)。SAM 最常见的应用方式是作为甲基转移酶的甲基供体[3]。另外,SAM 自由基酶可以催化SAM中C5'‑dA‑S 均裂,产生5'‑脱氧腺苷自由基(5'‑dA·),从而引发底物发生一系列化学上困难的转化[4]。与甲基和5'‑dA 的广泛应用相比,目前仅有少量利用SAM 中ACP 基团的酶被报道,本文中将这一类酶统称为ACP 利用酶(ACP utilizing enzyme),文中主要介绍当前已发现的ACP 利用酶催化的反应类型、反应机制和含有ACP 修饰的对应产物的生理功能。
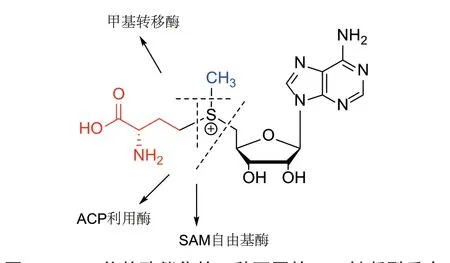
图1 SAM 依赖酶催化的3 种不同的C-S 键断裂反应Fig. 1 Three kinds of C-S bond cleavage reactions of SAM dependent enzymes
目前已知的ACP 利用酶从功能上主要分为两类:第一类ACP 利用酶能够以SAM 作为ACP 供体,将ACP 基团转移至相应的底物,如RNA、蛋白质及各类小分子代谢产物,故称之为ACP 转移酶。ACP转移反应从机制上有极性机理和自由机理两种不同的反应机制(表1)。第二类ACP 利用酶则是催化SAM 的ACP 基团发生分子内的环化反应,生成氨基环丙基‑1‑甲酸(1‑aminocyclopropane‑1‑carboxylic acid,ACC)或氮杂环丁烷2‑甲酸(azetidine 2‑car‑boxylic acid,AZC),ACC 和AZC 可以作为构建模块被引入非核糖体肽或聚酮类天然产物中,所以将其称为ACP 环化酶。
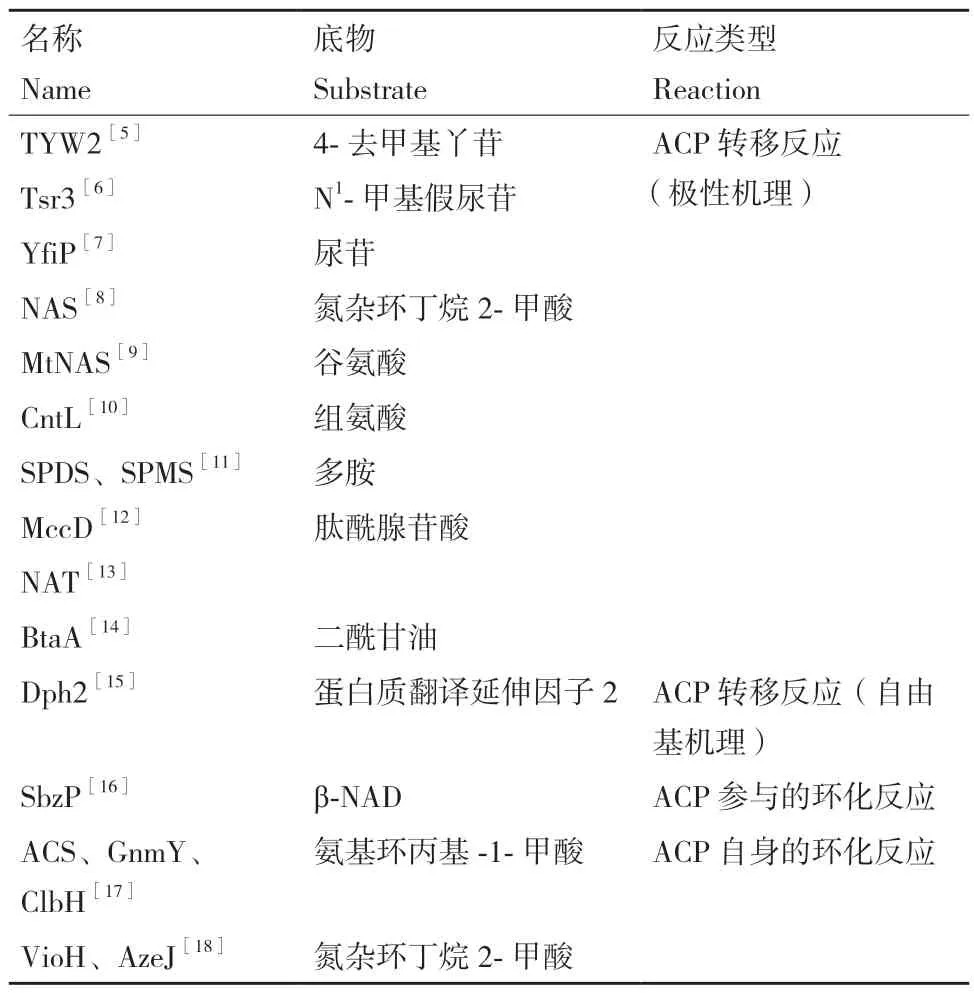
表1 ACP 利用酶总结Table 1 Summary of ACP utilizing enzymes
1 ACP 转移酶
ACP 转移酶的反应机制有极性机理和自由基机理两种。由于N、O 原子亲核性较强,目前发现的N、O 上的ACP 转移反应都是通过极性机理进行的。同时电子云密度较高的烯胺碳原子上的ACP 转移反应也是通过极性机理进行。组氨酸咪唑环的C2 位由于电子云密度低,亲核性相对较差,所以该位置上的ACP 转移反应是目前报道的唯一通过自由基机理完成的ACP 转移反应[19]。
1.1 极性机理的ACP转移酶
1.1.1 修饰RNA 的ACP 转移酶 怀丁苷(wybuto‑sine,yW)是一种被高度修饰的核苷,特异地存在于真核生物tRNAPhe的37 位[20]。yW 可以通过其体积庞大的疏水结构稳定tRNAPhe反密码环的构象,同时能够维持苯丙氨酸(Phe)阅读框的稳定,提高翻译过程的准确性[21]。yW 在酵母中的生物合成过程如下:首先SAM 依赖的RNA 甲基转移酶Trm5 催化G‑37N1 上的甲基化,生成m1G‑37[22]。随后SAM 自由基酶TYW1 催化形成4‑去甲基丫苷(4‑demethylwyosine,imG‑14)[23]。然后SAM 依赖的ACP 转移酶TYW2催化imG‑14 C7 上的ACP 烷基化[24]。接着甲基转移酶TYW3 催化N4 上的甲基化。最后由双功能酶TYW4 催化ACP 侧链上羧基的甲基化和氨基的甲氧羰基化,最终得到yW[24](图2‑a)。原核细胞中不存在yW,但Umitsu 等[5]发现两种来源于古细菌的TYW2 同源蛋白MjTYW2 和PhTYW2 在体外具有与酵母TYW2 相同的ACP 转移活性。晶体结构表明TYW2 在结构上与I 类SAM 依赖的甲基转移酶相似[25-27],且TYW2 中结合SAM 腺苷和核糖部分的保守基序也与I 类甲基转移酶类似,但二者结合ACP 基团的方式则显著不同。在I 类甲基转移酶Trm5 中,SAM 的ACP 基团结合在由DX3GXG 基序所形成的腔(M 腔)内,而甲基朝向底物结合口袋一侧[28]。TYW2 中同样存在由DX3GXG 形成的M腔,但TYW2 中的M 腔被一个空间位阻很大的氨基酸残基所占据,在不同种属的TYW2 中,该基团可以是His 或Tyr。所以ACP 基团无法进入TYW2 的M 腔,而是结合在由MXSX2NX3R/K 基序形成的A腔中。正是这种特殊的ACP 基团结合方式,使得TYW2 具有了ACP 转移酶的活性[5]。

图2 参与RNA 转录后修饰的ACP 转移酶TYW2(a), Tsr3(b)和YfiP(c)Fig. 2 ACP transferase TYW2 (a), Tsr3 (b) and YfiP (c) involved in RNA modification
真核生物核糖体小亚基的18S rRNA 中存在保守的N1‑甲基‑N3‑(3‑氨基‑3‑羧基丙基)-假尿嘧啶(m1ACP3ψ)修饰[29]。以酵母为例,该修饰的生物合成步骤分为三步:首先18S rRNA 的尿苷U‑1191被小核仁核糖核蛋白颗粒(snoRNP)催化转化为假尿嘧啶(ψ-1191)[30],然后RNA 甲基转移酶Nep1催化ψ-1191 嘧啶环上N1 的甲基化反应,生成m1ψ-1191[31-32],最后由Tsr3 催化m1ψ-1191 嘧啶环上N3的ACP 转移反应,生成最终产物m1ACP3ψ[6](图2‑b)。其中,Tsr3 是SAM 依赖的ACP 转移酶,生成产物m1ACP3ψ 的同时,将SAM 转变为5'‑甲基硫代腺苷(5'‑methylthioadenosine,MTA)。Tsr3 也能够接受尿苷U 作为底物,催化其N3 上的ACP 转移反应,生成ACP3U 修饰[33]。m1ACP3ψ 与18S rRNA 的成熟过程有关,敲除酵母中Tsr3基因,会导致20S rRNA的积累[34]。Tsr3 含有D/EXS/TW(DTW)保守基序,该基序对于ACP 转移活性至关重要[6]。通过解析来源于古细菌中Tsr3 同源蛋白VdTsr3 和SsTsr3 的晶体结构发现,Tsr3 在结构上与SPOUT 类RNA 甲基转移酶类似[35]。Tsr3 和Tyw2 在结构上的相似性很低,但采用了相似的策略来结合SAM 以保证ACP转移反应的发生,而非更常见甲基转移反应。在Tsr3 中SAM 的甲基处在不利于反应的位置上,而ACP 基团处于更有利反应的位置。RNA 甲基转移酶Trm10 与Tsr3 结构相似,但Trm10 结合SAM 的方式与Tsr3 正相反,在Trm10 中,SAM 的ACP 基团被包埋在蛋白内部,而甲基部分暴露于底物RNA 的结合位点附近[35]。Tsr3 可能是由甲基转移酶进化而来,通过改变SAM 在活性口袋中的结合方式而获得了ACP 转移能力。
大肠杆菌的多种tRNA 中都含有ACP3U 修饰[36],最近,Meyer 等[7]揭示了ACP3U 生物合成的酶学机理。来源于大肠杆菌的YfiP 是Tsr3 的同源蛋白,但大肠杆菌小核糖体亚基RNA 中并没有m1ACP3ψ 或ACP3U 两种转录后修饰,而是在多种tRNA 可变环上都含有ACP3U‑47 修饰[37]。Meyer等[7]发现YfiP 能够将SAM 中的ACP 基团转移到tRNA 47 位尿嘧啶核苷的N3 上,生成tRNA 的ACP3U 修饰(图2‑c)。YfiP 序列中也含有D/EXS/TW(DTW)保守基序[6]。YfiP 及其同源蛋白在N 端区域中都存在用于结合锌离子的保守基序——CX2CX6CXC,实验表明YfiP 是一个锌结合蛋白,且对应的结合域是活性必需[7]。大肠杆菌tRNA ACP3U修饰的生理学意义目前并不清楚。哺乳动物tRNA中同样存在ACP3U 修饰,例如tRNATyrD 环中的ACP3U20 和tRNAAsn的ACP3U20a[38]。人类基因组中的DTWD1 和DTWD2 中也存在DTW 结构域,Li 等[38]发现DTWD1 和DTWD2 都能够合成ACP3U,但二者对于tRNA 的底物选择性不同。DTWD1 或DTWD2单敲除导致细胞生长减缓,而DTWD1‑DTWD2 双敲除则导致严重的生长缺陷,表明ACP3U 修饰在哺乳动物细胞中具有更为重要的生理学意义。
1.1.2 植物烟草胺合酶、古细菌热烟草胺合酶和细菌类烟草胺合酶 烟草胺(nicotianamine,NA)是一种在植物中广泛存在的金属螯合剂[39],对植物体中Fe2+、Fe3+、Cu2+、Zn2+、Mn2+、Ni3+、Co2+等金属离子的稳态至关重要[40-41]。金属离子只有与NA形成络合物,才可以实现其在植物体内的长距离运输[42]。同时,NA 也是植物铁载体的生物合成前体[43],植物释放铁载体到根际土壤中,铁载体能够与Fe3+络合,使Fe3+以络合物的形式被植物体吸收[44]。烟草胺合酶(NA synthase,NAS)负责NA 的生物合成,NAS 利用了三分子SAM 的ACP 基团合成NA,相应的生成三分子的MTA,其中一分子ACP 环化,形成氮杂环丁烷2‑甲酸(AZC)结构[8,45](图3‑a)。与其他的ACP 转移酶相比,NAS仅以SAM 作为底物,没有其他额外的ACP 受体,而且能够催化连续两次的ACP 转移反应,并且NAS还兼有ACP 环化酶和ACP 转移酶的特征。nas基因并非植物所独有,在真菌和古细菌中同样发现了nas的同源基因[46]。Dreyfus 等[9]研究了来源于热自养甲烷嗜热杆菌的NAS 同源蛋白MtNAS,然而,MtNAS 的催化产物并非NA,而是将NA 中AZC 部分替代为Glu 的NA 类似物,该化合物被称作热烟草胺(thermoNicotianamine,tNA)。tNA 由MtNAS 催化两分子SAM 和一分子的Glu 合成。通过研究MtNAS 与底物复合物的晶体结构发现,MtNAS 通过同一个活性位点(S1)催化两次ACP 转移反应。首先Glu 与SAM 在S1 位点形成中间体Glu1‑AP2,而后该中间体被自发地转入更深的S2‑S3 位点。第二分子SAM 进入S1 位点后发生第二次ACP 转移反应,生成最终产物tNA(Glu1‑AP2‑AP3)[47](图3‑b)。
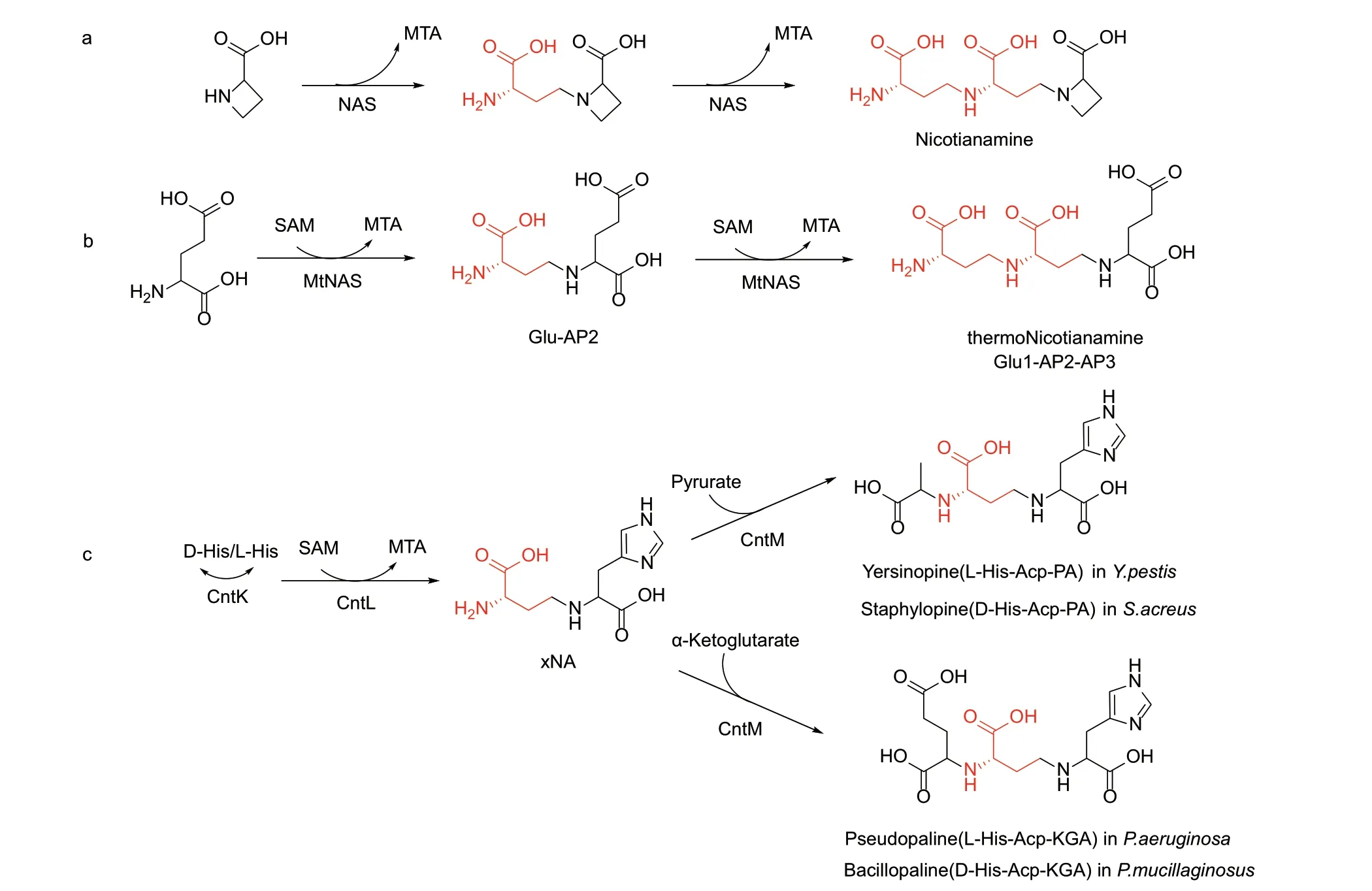
图3 烟草胺合酶(a)、热烟草胺合酶(b)与类烟草胺合酶(c)催化的反应Fig. 3 Reactions catalyzed by NAS (a)、MtNAS (b) and CntL (c)
Ghssein 等[10]进一步在细菌中寻找NAS 同源基因,成功发现了来源于金黄色葡萄球菌的cntL。CntL 与NAS 仅有12%的序列相似性,亲缘关系较远,但CntL 与NAS 和MtNAS 具有相似的结构。CntL参与staphylopine 的生物合成,其生物合成通路如下[10]:首先,组氨酸消旋酶CntK 催化L‑His 转化为D‑His;然后CntL 催化SAM 的ACP 基团转移到D‑His 的α-氨基氮原子上,形成中间体xNA;最后,CntM 催化xNA 与丙酮酸(pyruvic acid, PA)的还原缩合,生成最终产物staphylopine 同时消耗一分子NADPH(图3‑c)。此后在铜绿假单胞菌和鼠疫杆菌中分别发现了CntL 的同源基因。在鼠疫杆菌中,CntL 参与yersinopine(L‑His‑ACP‑PA) 的生物合成,该化合物与staphylopine(D‑His‑ACP‑PA)的区别仅在于His 部分的构型不同[48]。鼠疫杆菌中缺少CntK,故CntL 以L‑His 作为ACP 基团受体。而在铜绿假单胞菌中,CntL 参与pseudopaline(L‑His‑ACP‑KGA)的生物合成,pseudopaline 由L‑His、ACP 和α-酮戊二酸(KGA)构成[49]。Laffont 等随后在胶冻样类芽孢杆菌中发现了D‑His‑ACP‑KGA 的存在,将其命名为bacillopaline[50]。这些化合物统称为类NA 金属载体。病原微生物侵染宿主后,宿主会通过营养免疫产生对病原微生物的营养胁迫,而铜绿假单胞菌等病原微生物,通过产生类NA 金属载体恢复对Fe2+、Cu2+、Zn2+等金属离子的吸收[51],因此可以开发以CntL 为靶点的新型抗生素。
1.1.3 其他极性机理的ACP 转移酶 Nocardicin A是由放线菌产生的单环β-内酰胺类抗生素,SAM 依赖的ACP 转移酶NAT 将SAM 的ACP 基团转移到nocardicin E 的酚羟基上,得到isonocardicin A,然后再由异构酶催化其ACP 侧链中Cα异构化,得到最终产物Nocardicin A[13](图4‑a)。NAT 的ACP 受体在结构类似于儿茶酚O‑甲基转移酶底物。NAT 与儿茶酚O‑甲基转移酶二者之间的系统发育关系和造成二者活性差异的结构基础还有待进一步研究。
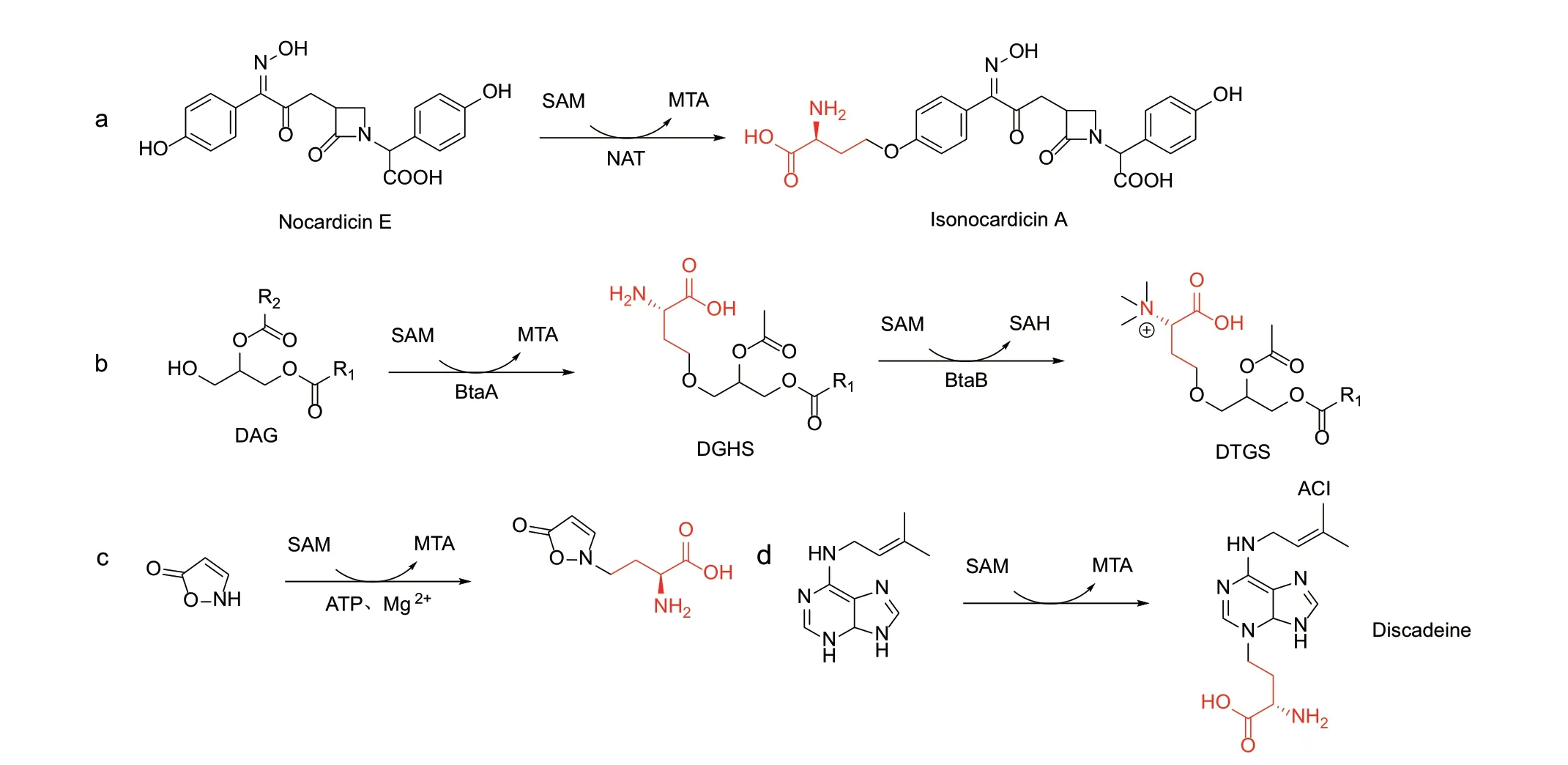
图4 其他极性机理的ACP 转移酶Fig. 4 ACP transferases with polar mechanism
甜菜碱脂(betaine lipids)是磷脂酰胆碱的类似物,其化学结构为二酰基甘油‑N,N,N‑三甲基高丝氨酸(DTGS)。甜菜碱脂能够帮助细菌、真菌和植物应对环境中磷酸胁迫。其生物合成过程分为两步[14]:首先BtaA 将SAM 中的ACP 基团转移到二酰甘油(DAG)的羟基上,生成二酰甘油高丝氨酸(DGHS),而后甲基转移酶BtaB 催化DGHS 高丝氨酸侧链N 原子上连续三次的甲基转移反应,生成产物DTGS(图4‑b)。很多BtaA 同源蛋白的N 端都含有12-15 个碱性和疏水的氨基酸残基,且C 端含有一段延展的寡肽。这两个结构域可能通过形成两亲性的α-螺旋将BtaA 锚定在细胞膜上,且N 端结构域中的碱性氨基酸残基能够与带负电荷的生物膜形成稳定的静电相互作用[14]。考虑到甜菜碱脂的主要生理作用是在磷酸胁迫的环境下替换生物膜中的磷脂,BtaA 结合在生物膜上的特点也是与其功能相适应的。
在香豌豆种子中,主要存在两种异恶唑啉酮衍生物:2‑(3‑氨基‑3‑羧基丙基)‑异恶唑啉‑5‑酮(ACI)和β-(异恶唑啉‑5‑酮‑2‑基)‑L‑丙氨酸(BIA),二者的区别仅在于侧链上相差一个亚甲基。其中BIA 由胱氨酸合酶催化异恶唑啉‑5‑酮和O‑乙酰‑L‑丝氨酸合成[52],虽然ACI 与BIA 结构相似,但二者的生物合成过程有很大区别。ACI 中的2‑氨基丁酸侧链来源于SAM 而非L‑高丝氨酸(图4‑c)。利用从香豌豆种子的部分纯化的粗酶,可以实现ACI 的体外生物合成,该过程依赖Mg2+和ATP 的存在[53],目前已知的利用SAM 中ACP 基团的酶中,还没有依赖Mg2+和ATP 的例子。但该酶的编码基因还未知,其催化机理有待进一步的研究。
盘基网柄菌产生的化合物discadinine 中也含有来源于SAM 的ACP 侧链。Discadinine 是一种腺嘌呤衍生物,能够抑制盘基网柄菌自身孢子的萌发。盘基网柄菌的细胞提取物可以催化SAM 的ACP 基团转移到N6‑(Δ2‑异戊烯基)‑腺嘌呤的N3 上,生成产物discadinine[54](图4‑d)。Discadinine 合酶的编码基因也依然未知。
1.2 自由基机理的ACP转移酶(非经典SAM自由基酶)
白喉酰胺(diphthamide)是真核生物和古细菌蛋白质翻译延伸因子EF2 上特定组氨酸(histidine,His)残基的翻译后修饰[55],EF2 参与核糖体蛋白的翻译过程,通过水解GTP 催化核糖体在mRNA 上的移位[56]。白喉毒素能够特异性识别白喉酰胺,并催化白喉酰胺N1 上的ADP‑核糖化,该反应导致EF2 失活,影响宿主细胞中蛋白质的合成[57]。在古细菌中,Dph2 催化白喉酰胺生物合成的第一步反应,Dph2 以SAM 作为ACP 供体,通过自由基机理催化EF2 组氨酸残基ACP 烷基化[15]。Dph2 属于SAM 自由基酶家族,SAM 自由基酶是迄今发现最大的酶家族之一。其分子中都含有至少一个[4Fe‑4S]簇,通过还原态的[4Fe‑4S]簇向SAM 中传递电子,使SAM 中C5'‑dA‑S 均裂,产生5'‑脱氧腺苷自由基(5'‑dA·),而5'‑dA·进一步攫取底物上的氢原子,产生5'‑dA和底物自由基,利用自由基机理实现底物的转化[4]。由于Dph2 还原裂解SAM 的Cγ,Met‑S 而不是C5'‑dA‑S,且序列中不含一般的SAM 自由基酶的保守半胱氨酸基序所以被称为非经典SAM 自由酶。
Dong 等[58]通过快速冷冻淬灭(RFQ)捕捉Dph2 的反应中间体,并用电子顺磁共振(EPR)和电子-核双共振(ENDOR)对捕捉到的反应中间体进行表征,提出了Dph2 催化EF2 的His 残基C2 位ACP 烷基化反应的酶学机理。首先,Dph2 铁硫簇通过向SAM 中Cγ,Met传递两个电子,形成MTA 和有机金属中间体I,在底物EF2 存在下,有机金属中间体I 中的Cγ,Met‑Fe 均裂释放ACP 自由基,ACP 自由基与EF2 上His 反应,生成有机自由基中间体II。中间体II 失去一个质子和一个电子后,最终形成ACP 修饰的His 残基(图5)。

图5 非经典SAM 自由基酶Dph2 的催化机理Fig. 5 Catalytic mechanism of noncanonical radical SAM enzymme Dph2
2 ACP 环化酶
目前发现的ACP 环化酶主要是催化SAM 的ACP 基团分子内环化,生成ACC 和AZC 两种小分子。PLP 依赖酶SbzP 虽然不能将ACP 基团环化为ACC或AZC,但能够催化ACP 与β-NAD 的3+2 环化且SbzP 与ACC 合酶机理相近,故将SbzP 归于此类讨论。
2.1 ACP自身的环化反应
2.1.1 植物及细菌ACC 合酶 氨基环丙基‑1‑甲酸(ACC)是植物激素乙烯的生物合成前体[59],ACC由ACC 合酶(ACC synthase,ACS)以SAM 为前体催化合成[17]。ACC 氧化酶进一步将ACC 转化生成乙烯[60]。因为乙烯能够促进果实成熟、花瓣和叶片脱落,这也导致了果蔬、鲜花的储运过程中的大量损失,所以开发ACC 合酶抑制剂能获得更好的经济效益。ACS 是一种PLP 依赖酶,其催化机理如下[61]:(1)ACS 活性位点内保守的赖氨酸(Lys)残基的ε-氨基与PLP 的甲酰基脱水缩合,此时PLP 通过C=N链接到酶上,形成“内部醛亚胺”。(2)SAM 分子中甲硫氨酸(Met)的α-氨基的亲核进攻“内部醛亚胺”,使其与PLP 之间形成“外部醛亚胺”,而Lys ε-氨基重新游离出来。(3)Lys ε-氨基进攻SAM中Met 的α-碳原子,形成共振杂化的碳负离子中间体,即“醌型中间体”。(4)“醌型中间体”恢复到芳香结构,引发一系列的电子传递,最终导致甲硫氨酸中Cγ‑S 键的断裂,MTA 释放。(5)去质子化的Lys ε-氨基进攻PLP 的C4',重新生成“内部醛亚胺”,产物ACC 被释放出来,完成一个催化循环(图6‑a)。
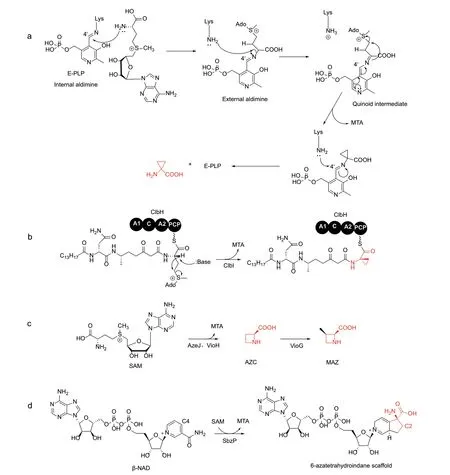
图6 ACC 合酶的催化机理及其他ACP 环化酶催化的反应Fig. 6 Catalytic mechanism of ACS and reactions catalyzed by ACP cyclases
广南霉素(guangnanmycins)由非核糖体肽合酶-聚酮合酶系统(NRPS‑PKS)催化合成,其分子也含有ACC 结构单元。虽然ACC 合酶在种子植物中广泛存在,但在细菌中并无ACC 合酶同源基因发现。Pan 等[62]发现了广南霉素生物合成基因簇中GnmY具有ACC 合酶的活性。序列分析表明,GnmY 属于PLP 依赖的天冬氨酸转氨酶超家族,与植物来源的ACC 合酶仅有较低的序列相似性。GnmY 是首次报道的细菌来源的ACC 合酶。
大肠杆菌素(colibactin)是一种由大肠杆菌产生的基因毒素,常见于结肠癌和肠炎患者的病理组织中[63],其分子内的环丙基是一种具有高反应活性的DNA 烷化剂,能够导致DNA 损伤[64]。大肠杆菌素的生物合成过程中同样也利用到了SAM 的ACP基团形成ACC 结构,但与广南霉素生物合成中先利用SAM 生成ACC,再将ACC 作为结构组件整合到广南霉素骨架中的机理不同,参与大肠杆菌素生物合成的非核糖体肽合酶ClbH 能够直接活化SAM 并将其整合到自身的肽酰载体蛋白(PCP)结构域上[65]。Zha 等[65]证明了SAM 是ClbH‑A2 结构域的底物,并通过质谱确认了SAM 能够共价连接到ClbH 的PCP 结构域上。连接在ClbH‑PCP 上的SAM 利用其ACP 基团的氨基与来自上游的生物合成中间体形成酰胺键以后,由聚酮合酶ClbI 负责SAM 环化形成ACC 结构(图6‑b)。同样是利用SAM 在天然产物中引入ACC 结构,广南霉素和大肠杆菌素的生物合成分别代表了两种不同的策略。不依赖PLP 的ClbI 如何催化ACP 环化的,它与ACC 合酶的催化机理有何不同,这些问题还有待深入研究。
2.1.2 AZC 合酶 Azetidomonamides(ADA)是一类来源于铜绿假单胞菌的生物碱,其分子中含有独特的氮杂环丁烷的结构。Hong 等[18]鉴定出ADA 的生物合成的基因簇,并发现SAM 依赖酶AzeJ 能够催化SAM 中ACP 基团的分子内环化反应,生成MTA和氮杂环丁烷2‑甲酸(AZC)(图6‑c)。AzeJ 的同源基因分布广泛,根据AzeJ 的同源酶可能发现更多的含有AZC 结构的天然产物。然而,AzeJ 同源基因在植物中并不存在,但多种植物中都存在AZC,植物中的AZC 起源还有待进一步研究[66]。
Vioprolides 是一种由紫色孢囊杆菌产生的非核糖体肽,由于具有很强的细胞毒性和抗真菌活性[67]。其中Vioprolides A 和Vioprolides C 中含有特殊的4‑甲基氮杂环丁烷羧酸(MAZ)结构。Yan 等[68]发现VioH 和VioG 负责MAZ 的生物合成。VioH 能够催化SAM 发生分子内环化,生成AZC,AZC 再被VioG 催化生成MAZ[18]。吲哚类生物碱okamarine B、okamarine D 中的氮杂环丁烷结构,由α-酮戊二酸依赖的双加氧酶OkaE 催化线性结构的前体分子内环化而来[69]。而多氧霉素中氮杂环丁烷结构以异亮氨酸为前体合成[70],VioH 和AzeJ 代表了一种新的氮杂环丁烷的生物合成策略。VioH 具有与I 类甲基转移酶类似的结合SAM 的保守基序。VioH 与I 类甲基转移酶结构上有何区别与联系,哪些关键的氨基酸残基决定了VioH 独特的催化活性,这些问题还有待进一步研究。
2.2 ACP参与的环化反应
Altemicidin 是一种由链霉菌产生的具有抗肿瘤活性的化合物,其结构中含有特殊的6‑氮杂四氢茚骨架[71]。Barra 等[16]发现SbzP 可以利用β-NAD 和SAM 催化合成Altemicidin 中的6‑氮杂四氢茚骨架结构。与植物ACS 一样,SbzP 也是一种PLP 依赖酶,且同样利用了SAM 分子中的ACP 基团,并产生MTA。SbzP 的催化过程中同样也包括,“内部醛亚胺”和“外部醛亚胺的”和“醌型中间体”生成,与植物ACS 合酶不同,SbzP 随后催化SAM 中Met的Cβ的去质子化从而导致MTA 的释放并形成β,γ-不饱和醌,该结构中的Cγ由于共轭而具有良好的亲核性,Cγ进攻β-NAD 中吡啶环的C4 位,形成中间体I。随后活性位点内Lys 残基进攻PLP 的C4'位使中间体I 的Cβ重新质子化,β-NAD 中吡啶环的C5进攻Cα合成第二个C‑C 键,最后环化产物释放,酶的活性口袋内重新形成“内部醛亚胺”(图6‑d)。酶促反应动力学表明,SbzP 以乒乓机制催化SAM 和β-NAD 的反应,即SbzP 先与SAM 结合,释放第一个产物MTA,同时产生活化的酶复合物(β,γ-不饱和醌),再与第二个底物β-NAD 结合催化得到最终产物。Barra 等[16]捕捉到了没有β-NAD 存在时SbzP 与ACP 所形成的β,γ-不饱和醌,支持了乒乓机制。通过生物信息学分析发现了更多的sbzP同源基因,这些同源基因存在于不同的生物合成基因簇中,对这些生物合成基因簇进行研究可能会发现更多由β-NAD 衍生而来的天然产物。SbzP 的发现不仅是对ACP 利用酶的重要补充也是对β-NAD 生理学功能的重要补充。
3 ACP 变体转移酶
生物体除了直接利用SAM 的ACP 基团外,还会以ACP 变体的形式加以利用。这部分主要介绍向底物分子引入氨基丙基修饰的酶,其中亚精胺合酶、精胺合酶等利用脱羧基SAM 作为氨基丙基供体,直接向底物中转移氨基丙基。而参与微菌素C 生物合成的MccD,则是先利用SAM 向底物引入ACP,底物中ACP 脱羧以后形成氨基丙基修饰。微菌素C 与多胺生物合成中,都涉及到了向底物中引入氨基丙基修饰,但采用了两种不同的生物合成策略。
3.1 亚精胺、精胺和热精胺合酶
多胺是一类带正电荷的小分子脂肪胺,其分子中至少含有两个氮原子[72]。多胺几乎存在于所有的生物体中,其种类主要有:腐胺(putrescine,Put)、亚精胺(spermidine,SPD)和精胺(spermine,SPM)[73]。多胺在细胞增殖和分化过程中起到重要作用[74],同时也有助于生物体适应环境胁迫[75]。亚精胺合酶(SPDS)催化脱羧基SAM(dc‑SAM)的氨基丙基转移到腐胺上形成亚精胺同时生成副产物MTA,其中dc‑SAM 由SAM 脱羧酶催化SAM 脱羧而生成[11]。精胺合酶(SPMS)继续催化亚精胺上的氨基丙基转移反应,从而生成精胺,该反应同样以dc‑SAM 作为氨基丙基供体[76]。在噬热菌中还存在另外一种亚精胺的生物合成通路,该过程涉及到TAAPT 催化的胍丁胺上的氨基丙基转移反应,TAAPT 是一类不同于SPDS 和SPMS 的氨基丙基转移酶[77-78]。精胺是一种对称的多胺,其结构可以表示为[343](数字表示氮原子之间的亚甲基的个数),而某些植物和细菌中的热精胺合酶(TSPS)可以将氨基丙基转移到亚精胺另一端的氮原子上,生成不对称多胺——热精胺[433][79]。
上述的腐胺、亚精胺、精胺和热精胺等都是线性的直链多胺,此外噬热菌中还含有支链多胺,如N4‑二(氨基丙基)亚精胺[3(3)(3)4]和N4‑氨基丙基亚精胺[3(3)4][80]。这两种支链多胺的生物合成过程中,涉及到一种特殊的氨基丙基转移酶——BpsA[81]。BpsA 能够催化底物亚精胺上连续两次的氨基丙基转移反应,第一次氨基丙基转移生成N4‑氨基丙基亚精胺[3(3)4],而后进一步以N4‑氨基丙基亚精胺作为底物发生第二次氨基丙基转移,得到最终产物N4‑二(氨基丙基)亚精胺(图7‑a)。SPDS、SPMS、TSPS 等氨基丙基转移酶催化反应的机理都是SN2 取代反应,而BpsA 则是通过乒乓机理催化反应,即BpsA 先与一分子的dcSAM结合,释放MTA,得到氨基丙基化的酶,修饰后的酶再与底物亚精胺(或N4‑氨基丙基亚精胺)结合,释放产物N4‑氨基丙基亚精胺(或N4‑二(氨基丙基)亚精胺),同时BpsA 恢复到最初状态,完成一次催化循环[82]。
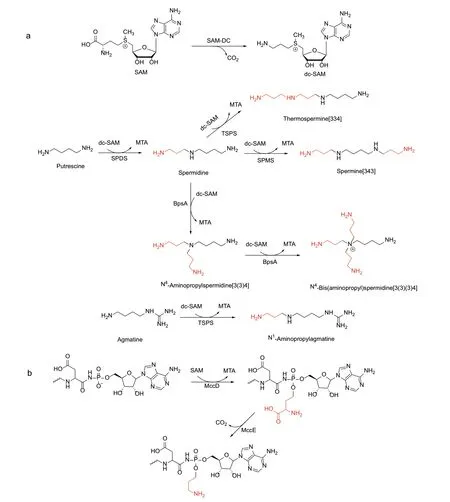
图7 两种不同的氨基丙基修饰策略Fig. 7 Two different strategies for aminopropyl modification
3.2 参与微菌素C生物合成的MccD
微菌素C(microcin C)是一种由大肠杆菌产生的肽酰核苷酸类抗生素[83],微菌素C 进入细胞后被氨肽酶水解成天冬氨酰氨基丙基腺苷酸,该物质可以抑制天冬氨酰‑tRNA 合成酶的活性,从而影响蛋白质的合成[84]。微菌素C 的化学结构是一个翻译后修饰的七肽,其中C 端天冬氨酸的α-羧基通过氨基磷酸酯键与腺苷相连,在磷酸基团上引入氨基丙基的修饰能够极大地提高微菌素C 的生物学活性[85]。微菌素C 的生物合成过程如下:首先,核糖体肽MccA 在ATP 依赖酶MccB 的作用下形成氨基磷酸酯键与腺苷相连[86],然后由ACP 转移酶MccD 催化在磷酸基团上引入ACP,最后由MccE 催化ACP 侧链脱酸[12],从而最终形成氨基丙基修饰(图7‑b)。MccD 和MccE 都拥有良好的底物宽泛性,能够向不同序列,不同长度的肽酰腺苷酸中引入氨基丙基修饰[12]。
4 总结与展望
综上所述,可以发现不同种类的ACP 利用酶在系统发育关系上距离较远,例如其中既有PLP 依赖酶也有SAM 自由基酶。还有一些ACP 利用酶与SAM 依赖的甲基转移酶序列相似性很高,都具有类似的结合SAM 的保守基序,仅是依靠活性口袋结构上的细微差别实现了二者对SAM 中C‑S 键的选择性切断。由于ACP 利用酶之间在序列上的共性较少,且部分ACP 利用酶与甲基转移酶在序列上的差异并不显著,导致对ACP 利用酶编码基因的预测比较困难。深入地认识和理解ACP 转移酶和甲基转移酶对SAM 中C‑S 键选择性不同的结构基础,有助于发现更多的ACP 利用酶。如果能够实现甲基转移酶到相应的ACP 转移酶的理性设计,这将是对现有的酶工具的极大丰富。从目前发现的ACP 转移反应的底物来看,主要集中在以RNA 和小分子为底物,以蛋白质为底物的翻译后修饰仅有EF2 的白喉酰胺修饰一例。对照SAM 依赖的甲基转移酶和SAM 自由基酶丰富的底物范围,我们有理由相信有更多的ACP 相关的蛋白质翻译后修饰,甚至DNA 修饰的存在。同时,从C‑S 键断裂的酶反应机制出发,目前发现的ACP 利用酶中大多以极性机制催化反应转移ACP。仅有Dph2 一例涉及ACP 自由基的产生。鉴于SAM自由基酶家族5'‑dA·实现的多样的反应类型,我们预测有更多ACP 自由基参与的反应存在。相信随着对该领域的深入和研究手段的日益丰富,会有更多ACP 利用酶和新颖的酶机制被发现。