非天然氨基酸的应用及生物合成策略
李海宁 张红兵 耿革霞 李冉 贾振华
(1. 河北经贸大学生物科学与工程学院,石家庄 050062;2. 河北省科学院生物研究所,石家庄 050081;3. 河北省药品职业化检查员总队,石家庄 050000)
蛋白质在细胞的生理过程中发挥着重要的作用,它们可以催化生物反应,调节基因表达和免疫反应,提供结构框架,调节运输系统等[1]。蛋白质通常由20 种天然氨基酸组成的,这些氨基酸具有不同的功能基团。然而,20 种天然氨基酸的功能基团数量和种类有限,不能满足化学、生物科学研究和应用中对蛋白质结构和功能的多样化需求。非天然氨基酸(unnatural amino acids,UAAs)由于其独特的功能基团和化学性质常被插入蛋白质中用来赋予蛋白质更高的活性和稳定性、作为蛋白质探针探索蛋白质结构变化、合成抗菌药物等。如Curnew 等[2]利用特定的正交系统将荧光性UAAs 插入丙型肝炎病毒的核心蛋白中,在不影响蛋白活性的情况下,实现蛋白的可视化。Salehi 等[3]设计合成了一种含有二苯丙氨酸的细胞穿透性多肽DipR5 可以与抗癌药物如阿霉素、喜树碱和姜黄素等结合使用,从而达到抗癌抗肿瘤目的。由于UAAs 广阔的应用前景,研究人员不断尝试开发和改进UAAs 的合成技术。目前UAAs 主要通过化学合成法生产,但化学合成存在污染严重、反应步骤复杂、生产成本高和对映体选择性差等缺点,限制了UAAs 的规模化生产。近年来,随着生物技术的不断变革和对环境的保护意识的增强,生物合成以其绿色高效、反应条件温和、成本低、产率高等诸多优点得到广泛关注。同时,随着代谢工程和合成生物学的飞速发展,微生物细胞工厂为UAAs 的生物合成及规模化生产提供了有效策略。
本文主要介绍了UAAs 在蛋白质中的应用领域,通过它们在蛋白质探针、酶工程、多肽药物和其他领域成功应用的实例展示了UAAs 的生物合成和应用价值,同时论述了基于代谢工程的UAAs 的生物合成策略,最后展望了在合成生物技术时代UAAs生物合成与应用面临的挑战和发展前景。
1 非天然氨基酸的应用
1.1 蛋白质结构和功能探针
蛋白质是生命活动存在的物质基础,参与运输、催化、调节等多种生命过程。定位蛋白质在体内分布,探究未知蛋白质之间的相互作用以及研究蛋白质的序列与结构功能关系等对揭示生命活动至关重要。
核磁共振(NMR)是一种常用的蛋白质结构解析方法。它可以获得蛋白质高分辨率结构,也可以广泛用于研究蛋白质在离体和细胞内构象和相互作用机制。但是,对于大分子量蛋白质,NMR 面临着信号峰过多、信号峰展宽、分辨率较低等问题,这些问题会影响构象信息的获取。为了解决这些问题,一种有效的方法是利用UAAs 进行定点标记,该方法可以显著减少信号数目,提高NMR 信号强度,降低数据采集和分析难度[4]。其中,含氟UAAs 是比较理想的NMR 观测对象,因为自然界中氟原子和氢原子具有相似的共价半径、强烈的NMR 信号、无背景信号干扰,并且对蛋白质结构影响较小[5]。通过在蛋白质的关键位点引入含氟原子UAAs,并观测其在蛋白质中的NMR 信号,可以获取蛋白质在相关生命活动中的构象变化信息[4]。例如,将(2S,4S)‑5‑氟亮氨酸掺入乳杆菌的二氢叶酸(DHFR)中,这是第一个将含氟脂肪族氨基酸用作19F NMR 探针的例子,为含氟UAAs 作为NMR 探针分析蛋白质的结构和功能开辟了新视角。另一个常用的含氟UAAs 是三氟甲基苯丙氨酸(tfmF),它能够被特异性引入到蛋白质的特定位点,实现蛋白质的位点特异性动态分析。Shi 等[6]应用19F 标记的tfmF 实现蛋白质的定点同位素标记,并结合NMR 方法研究了水溶性蛋白vinexinSH3 结构域和膜蛋白DAGK 的定点标记和动力学分析。同时还运用了19F tfmF 实现了大肠杆菌酪氨酸激酶的原位NMR 分析。
除了NMR 标记,荧光标记也是一种常见的蛋白质结构和功能探针。荧光标记也有助于探究生物大分子在细胞环境中的动态过程,实现细胞内生理过程的可视化。一些带有特殊官能团的UAAs 可以在不影响蛋白质性质的前提下标记蛋白质,为研究蛋白质的功能、构象变化及细胞内蛋白质的定位开辟了一条有效的途径。例如,通过引入荧光非天然氨基酸和融合发光蛋白,可以设计合成新型发光蛋白质探针。Yamaguchi 等[7]将荧光素酶作为Bret 供体,融合到麦芽糖结合蛋白的C 末端,并将BODIPY558 氨基苯丙氨酸插入到麦芽糖结合蛋白的结合位点附近的Tyr210 位点,作为Bret 受体。当加入麦芽糖后,荧光素酶和BODIPY558 的发射强度比提高了4.0 倍。这种通过融合发光蛋白和荧光非天然氨基酸合成的新型BRET/FRET 蛋白质探针,可以作为特定配体的生物成像和诊断检测的有价值的工具。另一种有用的UAAs 是光交联型非天然氨基酸,它们能够与邻近的氨基酸残基产生反应,实现光的交联反应。这种交联反应可用来观测动态变化的蛋白质相互作用和设计功能蛋白质,有助于生物过程的研究和可控的药物设计[8]。Chin 等[9]将光交联非天然氨基酸对苯甲酰基‑L‑苯丙氨酸(pBpa)插入蛋白质中,在紫外光激发下,pBpa 的二苯甲酮基团会与附近的C‑H 键发生交联,从而可以确定该氨基酸附近相互作用的伴侣蛋白信息。
1.2 提高酶催化活性和稳定性
酶是一种有效的生物催化剂,能够以高效率和选择性促进化学反应,近几十年来在制药、食品加工、生物燃料生产、农业等领域的应用日益增多,需求也随之增长[1]。然而,天然酶作为生物催化剂的一个主要挑战在于难以在恶劣条件下保持酶的稳定性和最佳活性,因此在酶工程中,提高酶活性、立体选择性、稳定性、底物范围和开发独特功能是主要的目标。传统上,酶工程主要由理性设计、定向进化和半理性设计三种策略来改善酶催化性能和稳定性,虽然取得了一定进展,但这种方法也仅仅局限于20 个天然氨基酸的使用。利用遗传密码扩展技术,将UAAs 以位点特异性或残基特异性的方式插入蛋白质中,突破了20 个天然氨基酸的限制,可以有效改善酶的性能,提高酶活性和稳定性[10]。
UAAs 在酶工程中的应用有两个方面引人瞩目,一是对酶催化活性的提升,UAAs 可以通过改变蛋白质的立体构象、电子分布、亲疏水性等因素,影响酶活性中心的形成和底物结合能力,从而提升酶活性。例如,磷酸三酯酶(PTE)可有效水解农药中的有机磷,为了突破其催化效率,Ugwumba 等[11]用L‑(7‑羟基香豆素‑4‑基)乙基甘氨酸替换PTE中的Tyr309,发现PTE 的催化效率提高了8-11倍。这是因为L‑(7‑羟基香豆素‑4‑基)乙基甘氨酸与产物侧链都带有负电荷,形成了较强的静电斥力。另一个常用于提升酶活性的UAAs 是对甲酰苯丙氨酸(pBzF4)。Li 等[12]在2018 年的研究中,用PBzF4 取代大肠杆菌高丝氨酸O‑琥珀酰基转移酶中的Phe21,使Km显著增加。转氨酶(TAMs)是有机合成中最有前途的手性氨基化合物的生物催化剂之一,将对苯甲酰苯丙氨酸(pBzF4)引入(R)‑TAM活性中心的Phe88 残基处,可以显著提高酶活性[13]。二是对酶稳定性的增强,UAAs 可以通过增强蛋白质内部或外部的相互作用力,提高蛋白质对温度、pH、有机溶剂等因素的抵抗能力,从而增强酶稳定性。例如,卤化非天然氨基酸,特别是氟化非天然氨基酸,除被用作蛋白质探针外,还经常被用于插入蛋白质中增强酶的催化活性和稳定性。这是因为卤原子可以形成卤键,从而增加蛋白质的热稳定性和溶剂稳定性。谷胱甘肽S 转移酶(GST)是一种解毒酶,它能将一分子谷胱甘肽与化合物偶联,促进其降解[10]。Parson 等[14]将大鼠GST 的4 个色氨酸残基全部替换为5‑氟色氨酸,结果表明,与未发生改变的GST 相比,Kcat增加了4 倍,Kcat/Km增加了两倍。将3‑氯酪氨酸和3‑溴酪氨酸分别插入GST 中,结果显示含有3‑氯酪氨酸的GST 具有更高的热稳定性。将对氟苯丙氨酸插入PTE 中,通过实验发现插入对氟苯丙氨酸的PTE 表现出更好的热稳定性,并且在65℃时仍具有显著的活性。同样地,将含氟非天然氨基酸如4‑氟苯丙氨酸、5‑氟色氨酸、3‑氟酪氨酸对来自南极洲假丝酵母脂肪酶的芳香族残基进行特异性氟化,结果表明该脂肪酶的活性周期也得到了延长。此外,将UAAs 引入金属酶中金属螯合的关键配体位置,也可以显著改变催化性能。例如,N-δ-甲基组氨酸被结合到几种金属酶中,以增强其活性。N-δ-甲基组氨酸作为肌红蛋白(Mb)中血红素的近端配体,可以导致血红素氧化还原电位和活性显著增加[15]。同样地,将N-δ-甲基组氨酸加入到修饰的抗坏血酸过氧化物酶中,也可以显著提高抗坏血酸过氧化物酶的催化活性。
UAAs 已在酶工程中得到广泛应用,但其发展仍受到众多因素限制,如大量UAAs 的合成路线复杂且成本高等,因此需要进一步寻找和发展更高效的创新方法,使UAAs 得到更广泛应用,创造出更多更稳定、更活跃、更具有化学功能的酶。
1.3 抗体药物偶联物(antibody‑drug conjugates,ADC)
抗体是体内获得性免疫应答的重要组成部分,对抗原具有优异的识别特异性和亲和力[16]。抗体药物偶联物是一种将抗体与其他毒性小分子或者治疗性药物通过一定方式连接到一起的复合物。该药物的原理是利用抗体部分特异性结合靶细胞表位的抗原,将高活性细胞毒药物运送到靶细胞内,释放细胞毒药物,阻止细胞分裂,达到杀死肿瘤细胞的目的,如图1 所示。该产品可有效提高药物的靶向性,实现向肿瘤等病灶组织精确递药,降低药物毒副作用,因此近几年备受青睐,成为研究热点。UAAs 因其独特的正交偶联性、部位特异性和低毒性被广泛应用于ADC 生产,并产生较好的治疗效果。插入蛋白质抗体中的UAAs 通常为乙酰苯丙氨酸、叠氮基甲基‑L‑苯基丙氨酸和叠氮赖氨酸。UAAs 带有的酮基、叠氮基官能团可与药物连接子发生化学反应,从而获得药抗比均一的ADC。Ambrx 公司的ARX788 是首个利用UAAs 开发的抗体药物偶联物,目前已处于临床研究阶段[17]。Kularatne 等[18]利用一种非天然氨基酸对乙酰苯丙氨酸(PAcF)定点修饰抗CXCR4免疫球蛋白G,并通过稳定的肟键将其与金黄色葡萄糖素偶联,制备了一种抗CXCR4‑Auristatin 抗体-药物结合物,该ADC 能够选择性地消除过表达CXCR4 受体的肿瘤细胞,且无明显毒性,有望用于治疗多种转移性恶性肿瘤。Zimmerman 等[19]建立了一个无细胞蛋白表达系统,通过定点插入优化的对叠氮甲基‑L‑苯丙氨酸(PAMF)来生产抗体药物结合物,并利用叠氮-炔环加成无铜点击化学,证明了PAMF 的定点结合修饰能够增强药物与肿瘤特异性的结合,从而达到杀死肿瘤细胞的目的。梁学军等[20]将非天然氨基酸pAF 引入抗人类表皮生长因子受体2(HER2)单克隆抗体分子中,并与毒性分子特异反应,制得抗HER2‑ADC。该ADC 在细胞体外和动物体内实验中对HER2 高表达的肿瘤细胞具有明显的抑制效果。目前,基于UAAs 偶联构建的ADC 数量占临床试验ADCs 的4%[21]。因此,我们相信基于UAAs 偶联构建的ADC 会有广阔的发展前景。

图1 抗体药物偶联物及其作用原理Fig. 1 Antibody-drug conjugates and principle of action
1.4 抗菌肽(antimicrobial peptide, AMP)
AMP 是一类具有抗菌活性的碱性多肽物质。它们通常具有强碱性、热稳定性和广谱抗菌等特点。由于抗生素的滥用,细菌的抗药性不断增强,因此AMP 对细菌的强力杀灭作用,特别是对某些耐药性病原菌的杀灭作用,引起了人们的关注。然而,抗菌肽在动植物体内含量极低,从动植物体内分离提取困难、耗时、成本高等问题一直是抗菌肽实现大规模生产并投入使用的最大障碍。因此,开展AMP基因工程研究具有重要意义。
AMP 是典型的阳离子和两亲性多肽。阳离子型抗菌肽通过与细胞膜上带负电荷的成分相互作用,增加了细胞膜的通透性,破坏其稳态,导致细胞膜溶解,释放细胞内容物,从而实现抗菌或其他抗性功能[22]。非天然氨基酸聚L‑赖氨酸(PLLs)在生理条件下可生物降解并带正电荷,已被用作抗菌剂,并且已被证明具有良好的抗菌活性。例如Pan 等[23]通过制备侧链上含有不同亚甲基数量的PLLs 同系物(如聚 L‑鸟氨酸(PLOs)、PLLs、聚 L-α,ζ 二氨基庚酸(PLHs))的星型多肽来调节抗菌剂的两亲性,从而实现最佳抗菌活性。他们随后利用铜绿假单胞菌对星状多肽进行了抑菌活性测试发现,非天然氨基酸聚 L‑鸟氨酸对铜绿假单胞菌有明显的抑制作用,并对由铜绿假单胞菌引起的小鼠皮肤烧伤创面感染具有良好的抗菌和创面愈合作用。因此非天然氨基酸聚 L‑鸟氨酸可作为抗菌肽,用于治疗生物被膜的相关感染。D’Souza 等[24]将抗菌肽 BuCATHL4B中的3 条色氨酸(Trp)侧链用非天然氨基酸 β-1‑azulenyl‑L‑丙氨酸替换后发现,该抗菌肽不仅保持了抗菌和杀菌活性,而且还提高了与人细胞的相容性和抗蛋白酶降解的稳定性。Salehi 等[3]还设计合成了一类含有非天然氨基酸二苯丙氨酸的细胞穿透性多肽(CPPs)DipR5,它具有携带多种分子的能力,是一种多功能药物传递系统,可以与抗癌药物如阿霉素、喜树碱和姜黄素等结合使用,从而起到抗肿瘤抗癌的作用。
这表明,UAAs 可以作为设计和开发新型功能多肽的有用工具。其独特的光谱特性,以及对细胞相容性和蛋白酶抗性的显著改善,使其可以应用于多种基础和治疗系统。随着合成生物学和人工智能等新型交叉学科的快速发展,不仅为AMP 的设计合成提供了全新的技术平台,也扩展了AMP 的医药应用前景。
1.5 其他应用
非天然氨基酸除应用于蛋白质探针、酶工程、抗体药物偶联物等之外,还作为手性砌块应用于药物前体、病毒疫苗、生物传感器等诸多领域。本课题组研究的D‑苯甘氨酸已大量用于半合成青霉素和半合成头孢菌素等,在重要β-内酰胺抗生素的合成中,它们已成为抗生素临床用药的主力军。近年来,多肽在智能纳米材料开发中取得了一定的进展,从生物材料、生物传感器到药物输送系统等。例如,在二肽中加入高丙氨酸或去甲丙氨酸创造了具有新晶体结构的微孔有机材料,用作药物载体和温室气体的吸收剂。UAAs 插入蛋白质结构中还可作为电化学生物传感器,左旋多巴L‑DOPA 是苯丙氨酸的类似物,含有儿茶酚部分参与可逆的双电子氧化还原过程,因此适合作为电化学标记。通过葡萄糖/半乳糖结合蛋白(GBP)来说明检测原理,当葡萄糖结合后,GBP 发生了显著的构象变化,表现为L‑DOPA的电化学性质的变化。Zeynaloo 等[25]将电活性GBP固定在金纳米颗粒修饰的聚合咖啡酸丝网印刷碳电极(GBP‑LDOPA/AuNP/PCA/SPCE)上,用于直接测量血糖水平,并使用电化学活性UAAs 作为标记进行验证。由此产生的无试剂GBP 生物传感器表现出高度的选择性以及对葡萄糖在微摩尔范围内的灵敏的亲和力,为新的生物传感方法奠定了基础。
将UAAs 插入蛋白质中,用于新型疫苗的开发也是UAAs 一种极有价值的应用。机体在受到病毒感染以及发生炎症时会通过氧化应激反应引发自身某些蛋白质中的Tyr 残基发生翻译后修饰形成硝基酪氨酸和磺基酪氨酸。研究人员发现硝基和磺基在体内具有较强免疫原性,因此一些含硝基或者磺基的UAAs, 包括p‑nito‑L‑phenylalanine(pNO2F)、3‑nitro‑L‑Tyrosine(3‑NO2Y)、p‑sulfo‑L‑phenylalanine(pSO3F)被认为可应用于治疗性蛋白疫苗的开发[26]。例如,将肿瘤坏死因子(TNF-α)中的Lys 和Tyr 定点突变成pNO2phe 后,打破了动物自身免疫耐受,产生了高效价抗体,被认为是一种有潜力的治疗性蛋白疫苗。除用作治疗性蛋白疫苗外,UAAs 还可用于减毒活疫苗的研发。通过在病毒复制的关键基因中引入提前终止密码子构建的突变病毒,在添加UAAs 的情况下该基因仍能完整表达从而完成病毒的复制和传代,但该病毒在正常细胞中因复制关键基因不能完整表达而无法复制传代,因而是一种复制缺陷型病毒。该病毒用作疫苗时既具有减毒活疫苗免疫效果还有安全性高的优点,因而是一种较为理想的活病毒疫苗[27]。具有部分UAAs 的应用如表1所示。

表1 非天然氨基酸的应用Table 1 Applications of unnatural amino acids
2 非天然氨基酸的生物合成
UAAs 具有巨大的应用潜力,因此其合成方式备受关注。目前,其合成方法主要有化学法和生物法两大类。化学法作为传统的合成方法,存在反应条件严苛、反应步骤复杂、原料成本高等问题。相比之下,生物法具有反应条件温和、能耗低、对映体选择性高等优点,更具吸引力。随着对代谢工程和合成生物学领域的不断发展,通过优化微生物工程菌整个代谢网络,提高其性能和稳定性,利用进化代谢和全局调控提高其生产能力,将其转化为生产可用的工程菌是当前生物合成技术研究热点[33]。
2.1 静态调控优化策略
代谢工程的目标是通过改变和调控宿主体内的关键代谢途径或引入新的代谢途径来提高目标产品的产量等[36]。当前已有研究在大肠杆菌(Escherichia coli)、谷氨酸棒杆菌(Corynebacterium glutamicum)等底盘生物中成功构建UAAs 的生物合成途径[37]。如4‑羟基异亮氨酸(4‑HIL)是有效预防和治疗Ⅱ型糖尿病及肥胖症的理想潜在药物[38],其生物合成是以L‑异亮氨酸和α-酮戊二酸为前体,由L‑异亮氨酸双加氧酶(L‑isoleucine dioxygenase,IDO)催化而成。然而在大肠杆菌和谷氨酸棒杆菌等底盘细胞中均不含IDO,因此应首先在菌株中表达外源IDO构建4‑HIL 合成途径。Shi 等[39]在L‑异亮氨酸产生菌C. glutamicum中异源表达IDO 基因,并引入4‑HIL合成途径,在不添加L‑异亮氨酸和α-酮戊二酸的情况下实现了从葡萄糖中从头合成4‑HIL,并通过改善底物供应和IDO 活性增强4‑HIL 的合成效率,使4‑HIL 产量提高到0.069 47 mol/L。Umutumwa 等[40]克隆了来自苏云金芽孢杆菌的IDO,实现了其在E.coliBL21(DE3)中的异源表达,然后通过对酶的结构及反应条件进行优化,反应32 h 后4‑HIL 产量达0.077 3 mol/L。
合理调控关键节点处的代谢分配是提高目标产物生物合成产量的关键。5‑氨基乙酰丙酸(5‑ALA)是一种多功能植物生长调节物质,可促进植物生长和提高作物产量,在医药领域,可以用于癌症诊断和治疗[41]。5‑ALA 的C5合成途径是以L‑谷氨酸为前体合成的。研究表明,谷氨酰tRNA 还原酶(GluTR,由hemA基因编码)和谷氨酰‑1‑半醛氨基转移酶(GSA‑AM,由hemL基因编码)是5‑ALA C5合成途径的关键酶[42]。通过对5‑ALA 代谢通路的关键酶基因进行调控,可有效提高5‑ALA 的产量。Kang等[43]将来自鼠伤寒沙门氏菌的hemA基因的N 端编码Thr‑2 和Leu‑3 氨基酸之间插入两个编码赖氨酸的密码子,进一步在E. coli中过表达突变型基因,5‑ALA的产量提高到0.18 g/L。另外,魏敏华等[44]在研究影响5‑ALA 的关键因素时发现,敲除编码L‑谷氨酸转运蛋白的基因阻断胞内L‑谷氨酸的外排,同时将5‑ALA 合成关键酶GluTR 和GSA‑AM 按比例组装至DNA 脚手架上,以减小中间代谢产物的传递空间,可使5‑ALA 产量提高35.3%。
此外,还有许多代谢工程策略可以用来提高UAAs 的合成效率和产量,如阻断产物分解代谢、敲除竞争性旁路、解除转录和反馈抑制以及调节辅因子供应和产物转运等。例如,L‑2‑氨基丁酸(L‑ABA)可通过苏氨酸脱氨酶催化L‑苏氨酸生成α-酮丁酸(2‑KB),再经亮氨酸脱氢酶催化而制得。通过定点突变高丝氨酸脱氢酶基因和苏氨酸脱氢酶基因,可有效解除L‑苏氨酸和L‑异亮氨酸的反馈抑制,保证L‑苏氨酸的充足供应,从而提高L‑ABA 的产量[45]。其他常见UAAs,如L‑高丝氨酸、鸟氨酸、反式‑4‑羟基脯氨酸、5‑羟基色氨酸等也已通过运用上述代谢工程策略使生产效率和产量成功得到提高,其合成途径如图2 所示。
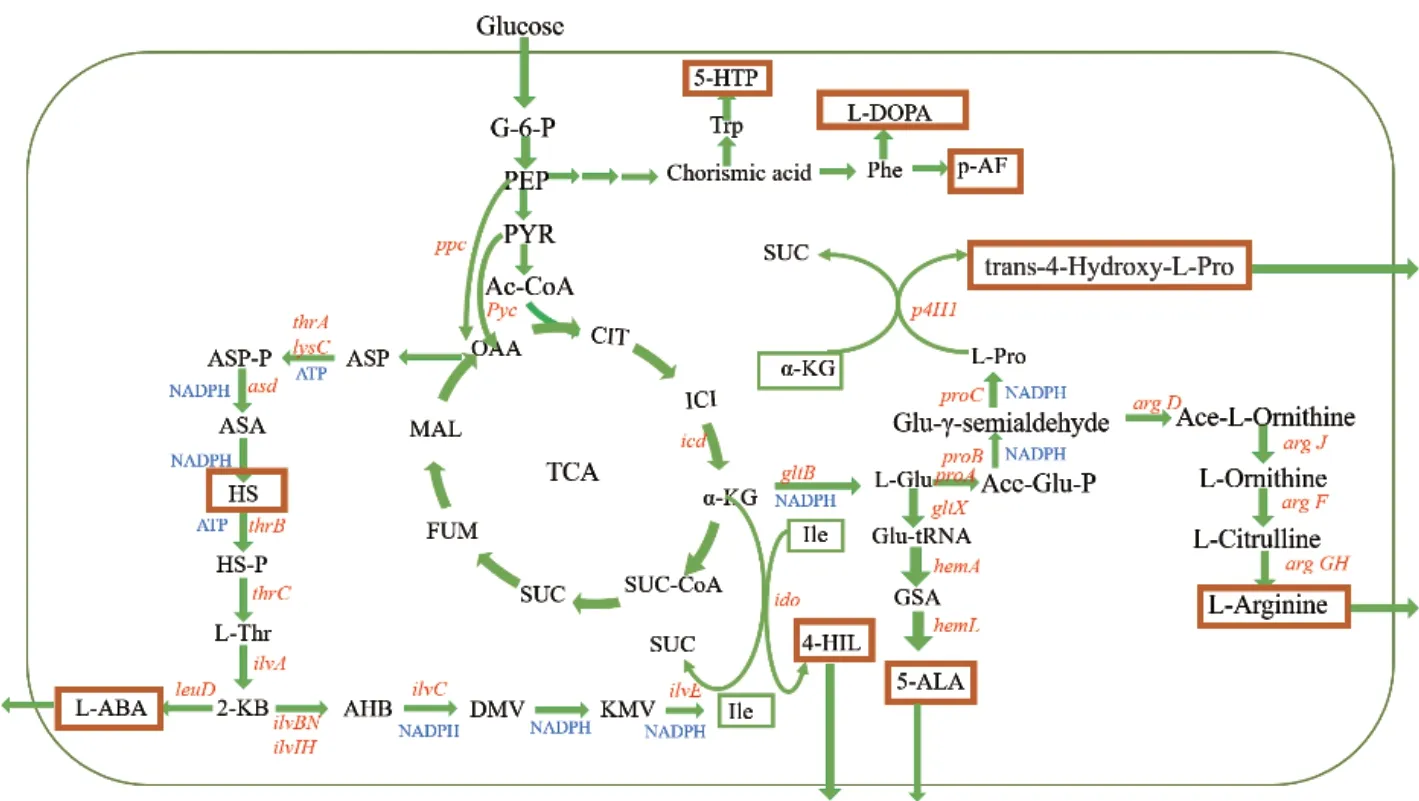
图2 非天然氨基酸的生物合成途径Fig. 2 Biosynthetic pathway of UAAs
2.2 动态调控优化策略
动态调控作为合成生物学的一项重要生物技术具有显著的技术优势和细胞经济性[33]。传统的静态调控通过对产物合成途径中的关键基因过表达或旁路竞争途径相关基因进行敲除,使代谢流精准高效的流向产物合成途径。这种调控策略虽然在一定程度上可以提高产物产量,但同时可能会抑制细胞内代谢活动,影响细胞正常生长[46]。此外,异源途径的引入也会给细胞带来负担和毒性,降低产物合成速率和得率。因此需要更先进的调控策略,在保证细胞正常生长的前提下,优化目标产物的生产速率和得率。
动态调控策略是指通过感知细胞内外各种信号,动态调节蛋白质或基因的表达水平,从而实现对代谢流的精确控制,从而获得最佳的目标产品合成效率。根据不同的调控策略特点,动态调控可分为代谢物响应、群体感应响应、环境响应和蛋白质水平调控四种类型[47]。近年来,在UAAs 的生物合成中已成功应用了这些策略。代谢物响应的核糖开关可以感知细胞内外某些代谢物或产物的浓度变化,来调节相关基因或蛋白质的表达水平。这种策略可以实现对代谢流量的实时反馈和自适应调节,具有反应时间快,对细胞负担小及灵活性高的特点[48]。例如,来文梅等[49]为提高4‑HIL 的产量,将Lys‑OFF核糖开关整合到Lys 合成途径的关键基因dapA序列上游,动态弱化Lys 的合成,使Lys 的产量降低46.7%。同时利用Ile 激活型传感器Lrp‑PbrnFEN 动态激活4‑HIL 合成途径中ido基因的表达。最后,利用强启动子PbrnFE7 动态控制增强α-酮戊二酸和O2供应途径中关键基因odhI 和vgb的表达,通过这种多层次的动态调控,使4‑HIL 产量高达0.166 mol/L。Zhou 等[50]在巴氏梭菌中设计改造了一种高效的甘氨酸抑制型核糖开关,并将其整合到5‑ALA C4合成途径中,使其能够感知前体甘氨酸浓度来动态调控5‑ALA 脱水酶的表达,从而实现了5‑ALA 的产量提升。
群体感应系统(QS)是细菌用于监控自身群体密度的环境信号感受系统。这种策略可以通过感知细胞群体密度的变化,来调节相关基因或蛋白质的表达水平,具有信号传递迅速、调控效果高和稳定性高等特点。随着合成生物学的大力发展,QS 的应用研究在动态调控领域受到广泛关注。Gu 等[51]利用具有激活和抑制双重调控功能的Eas‑QS 系统,构建了一种双功能动态调控开关,并将其用于动态调控5‑ALA 的生物合成,实现了前期菌体快速生长,后期快速积累产物。最终,使5‑ALA 的产量比静态调控提高12 倍。
总之,动态调控在UAAs 的合成中具有显著优势,能实现对代谢流量的精确控制和优化分配。目前,动态调控还存在一些挑战和局限性,如调控网络的复杂性、生物元件的匮乏等。随着合成生物学的不断进步,相信动态调控将在UAAs 的生物合成中发挥更大的作用。4‑HIL 和5‑ALA 的动态调控如图3 所示。
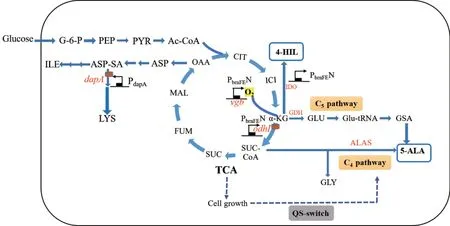
图3 4-HIL 和5-ALA 的动态调控Fig. 3 Dynamic regulation of 4-HIL and 5-ALA
2.3 发酵优化策略
在生物生产中,微生物的发酵策略是影响产品产量和糖酸转化率的重要因素之一[30]。顺式‑4‑羟基-脯氨酸(CHOP)和反式‑4‑羟基-脯氨酸(THOP)是两种具有很高药用价值的手性结构UAAs,近年来,其生物合成受到广泛关注。张博文等[52]和李强等[53]分别构建了CHOP 和THOP 的细胞工厂,并对其进行了发酵优化,实现了UAAs 的高效生产。张博文等[52]进行发酵优化时发现,在2.5 g/L 的底物浓度下,CHOP 产量达到最大值,随后开始下降。为了避免底物浓度过高抑制细胞活性,他们后期采用分批补料的方式使底物浓度在合适的范围内,通过这种发酵策略,在最优发酵条件下发酵60 h 后,CHOP 产量达到120 mg/L,较发酵优化前得到明显提升。李强等[53]为了评估THOP 细胞工厂的生产性能,也采用了分批补料的方式,在5 L 发酵罐中进行发酵实验时发现,随着发酵时间延长,细胞生物量逐步增加,最终OD600达到70,在进行葡萄糖分批补料发酵40 h 后,THOP 产量达到48.6 g/L,糖酸转化率和平均生产强度分别达到21.6%和1.22 g/(L·h),为THOP 的发酵生产提供了理论支持。部分常见的UAAs 的生物合成策略如表2 所示。
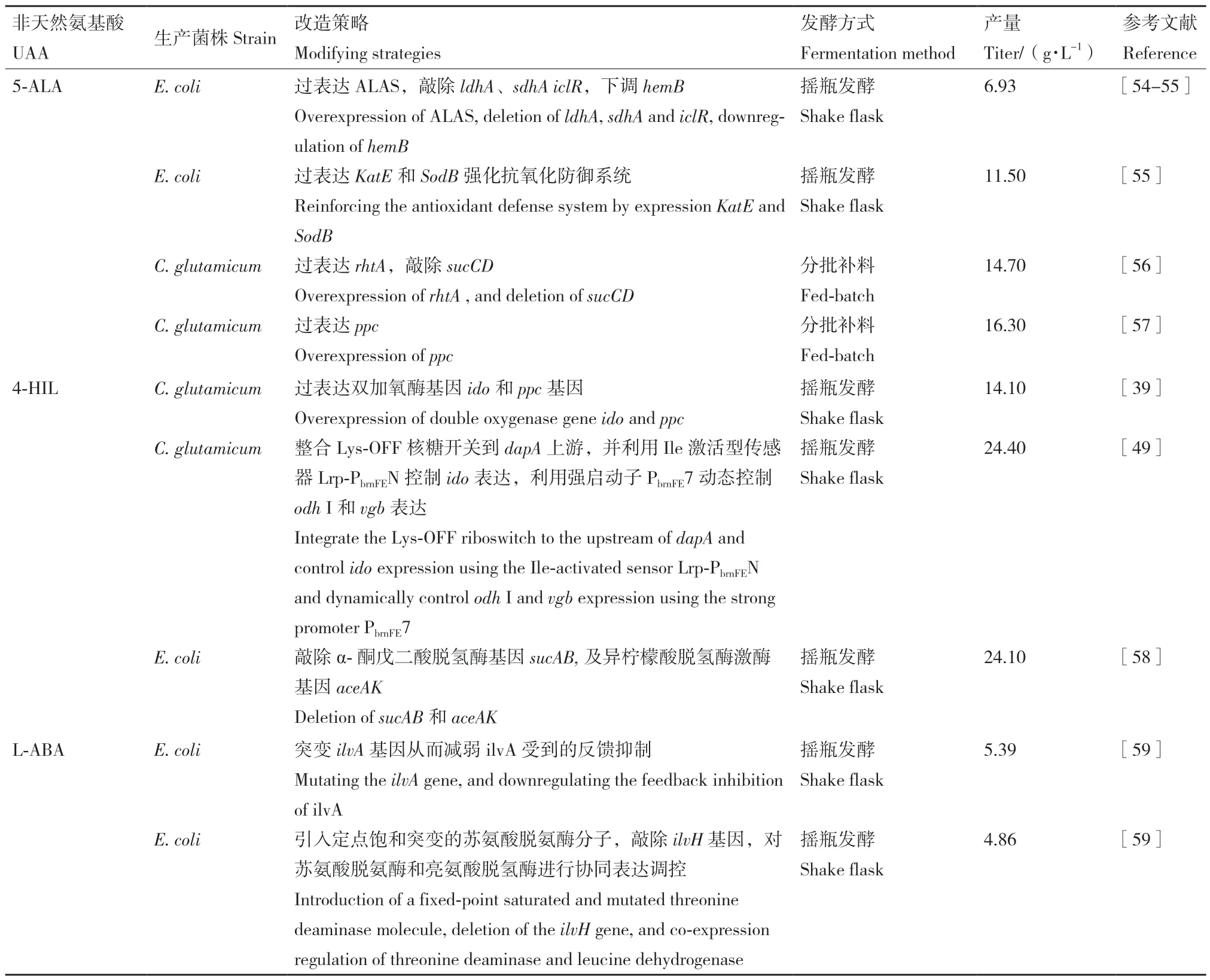
表2 非天然氨基酸的生物合成Table 2 Biosynthesis of UAAs
3 总结与展望
UAAs 是一类在医药、农药、食品、材料等众多领域具有重要价值和广阔前景的化合物。尤其在合成蛋白质中,它们打破了20 种天然氨基酸的限制,赋予了蛋白质更稳定的性能和更广阔的应用。UAAs在酶改造、蛋白质药物、生物传感器等领域的应用效果令人惊叹。然而,UAAs 的合成仍面临着巨大的挑战。目前,UAAs 的生产方式主要依赖化学法,这种方法不仅污染严重且导致UAAs 的价格昂贵。随着生物技术的突破和合成生物学的发展,UAAs 的生物合成已取得了显著的进展。通过对代谢工程静态和动态调控策略深入研究以及核糖开关、群体感应系统、转录因子-启动子等技术手段的应用,使UAAs 的生产效率和产量得到大幅提升。
但总体来说,当前动态调控技术仍然存在一些不足和局限性,如动态调控元件种类少、响应范围有限、底物谱和响应阈值窄等。因此利用动态调控策略合成UAAs 还需要继续深入研究和优化。此外,目前仅有少数UAAs 的代谢途径得到解析和利用,因此需要借助合成生物学、蛋白质工程、转录组学等学科进行深入研究来进一步挖掘更多UAAs 的代谢途径和关键酶。除此之外,将UAAs 位点特异性插入到蛋白质中的遗传密码扩展技术也有待发展和突破,此技术仍存在密码子和相互正交RS/tRNA 对匮乏和插入UAAs 种类限制等挑战。目前,国内UAAs 的市场需求还很大,应充分挖掘和利用UAAs的生物合成途径及其在蛋白质中的应用潜力。我们相信,随着合成生物学、生物化学和理性设计等技术手段的不断完善和创新,高效绿色的UAAs 生物合成路线将会得到广泛应用,同时计算模拟辅助遗传密码扩展技术也会不断成熟和优化,将UAAs 更多地应用到蛋白质及多肽药物中。