植物光系统 II(PSII)应答非生物胁迫机理研究进展
程爽 ULAANDUU Namuun 李卓琳 胡海玲 邓晓霞 李月明王竞红 蔺吉祥
(1. 东北林业大学园林学院,哈尔滨 150040;2. 上海师范大学天华学院,上海 201815)
全球气候变化加剧了非生物胁迫发生的频率和程度,植物生长发育会受到一系列环境因子(温度、干旱、盐和重金属等)的影响,并且形态与生理过程发生变化以适应胁迫逆境,如光合与呼吸作用、生物膜稳定性、基因表达与分子调控网络改变等[1]。其中,光合作用是植物进行物质转化和能量代谢的关键途径,对其生长发育起着至关重要的调节作用。光系统 II(PSII)是光合作用中最脆弱的部分,其稳定性决定植物的正常生长发育。因此,探究非生物胁迫下PSII 的变化尤为重要。
光合作用的光化学反应是由两个包括光合色素在内的光系统完成的,即光系统 I(PSI)和光系统II(PSII)。光合色素吸收光能后,会引起电荷分离和光化学反应,一方面将水氧化,释放氧气;另一方面进行电子传递,将NADP+还原成还原型辅酶II(triphosphopyridine nucleotide, NADPH)( 图1)。PSII 存在于光合生物的类囊体膜中,是一种多亚基色素-蛋白质复合物,包含光反应中心(reaction center, RC)、捕光叶绿素a/b 结合蛋白(light‑harvesting complex, LHC)以及放氧中心复合物(oxygen‑evolving complex, OEC)[2]。当植物面对逆境胁迫时,PSII结构和功能均会发生改变,PSII 天线复合体中的激发能量传递和反应中心的电子传输受到抑制,导致PSII 反应中心失活[3]。PSII 活性降低和电子传递链(electron transport chain, ETC)的过度还原还会导致光氧化现象的发生[4]。与此同时,植物可以通过光呼吸消耗过量NADPH[5]、非光化学猝灭(non‑photochemical quenching, NPQ)[6]、D1 蛋白周转以及PSI 和PSII 的环式电子传递(cyclic electron flow,CEF)等[7]途径,来形成光保护机制,避免植物受到逆境胁迫的伤害。
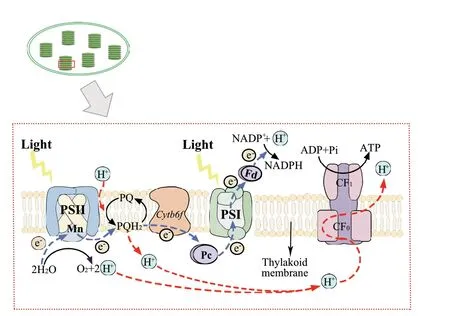
图1 叶绿体光合电子传递过程Fig. 1 Photosynthetic electron transport in chloroplasts
一般来说,PSII 会对逆境胁迫较为敏感,而叶绿素荧光技术作为一种可以快速、无损检测植物光合性能的方法,在分析植物PSII 光化学活性、电子传递能力及光能利用方面发挥着重要的作用[8],并且在小麦[9](Triticum aestivumL.)、棉花[10](Gos‑sypiumspp)、 水稻[11](Oryza sativaL.)、 玉米[12](Zea mays)等植物中被广泛应用。通过分析荧光诱导动力学曲线(chlorophyll fluorescence kinetics curve,OJIP),可以有效地探究不同环境胁迫对PSII 和光合电子传递链组分的生理状况,更深入了解植物的原初光化学反应以及PSII 反应中心电子氧化还原状态[13]。因此,基于叶绿素荧光参数以及荧光动力学曲线,分析植物在非生物胁迫下PSII 电子传递效率和能量分配比率,可以更明确植物的光吸收和保护机制。
近年来,PSII 作为光合机制中最易受影响的部分,非生物胁迫对其影响备受关注。基于此,本文对植物光系统 II(PSII)应答非生物胁迫,如温度、干旱、盐以及重金属的机理研究进行了归纳,并提出了研究展望,旨在为更深入理解逆境胁迫下的植物光合适应机理提供理论依据。
1 温度胁迫对植物PSII 的影响
在逆境胁迫下,植物的光合色素易发生降解,这不仅会降低捕光天线的工作效率,还会影响PSII的结构和功能。其中,短期温度胁迫会破坏质体内光合色素的生物合成,导致光合色素(Chl)积累减少;长期胁迫则会触发Chl 的降解,甚至会对其造成不可逆的损害。PSII 复合体极易受到温度的影响,即使是在短时间的高温胁迫下,PSII 的反应中心(RC)和放氧中心复合物(OEC)也会受到抑制,并且后者较前者更为敏感[14]。OEC 结构由该亚基和其他3种PSII 外在蛋白(PsbP、PsbQ 和PsbR)组成,但高温会抑制水氧化,同时会使外在蛋白从OEC 复合体中分离,因此,OEC 的供体位点会成为温度胁迫时损伤的主要靶位点[15]。捕光叶绿素a/b 结合蛋白(LHC)参与光能的吸收和运输,其表达水平的变化会直接影响光系统的活性[16]。逯久幸等[17]研究发现,LHC 结合基因在低温处理后下调表达,这可能会导致捕光复合体的捕光面积减少,降低光能吸收,减少过剩光能对秋菊(Dendranthema morifolium)叶片产生的损伤。
温度胁迫下PSII 电子传递受到影响,其原因一方面是PSII 结构的完整性受到破坏,另一方面是类囊体膜的流动性有所变化,导致PSII 光捕获复合物移位。前人研究表明,35-45℃可诱导电子的循环运输,加快类囊体膜的流动性,损害细胞内稳态和植物的代谢[18]。通过快速叶绿素荧光诱导曲线(OJIP曲线),可以有效地判断温度胁迫下PSII 反应中心的变化。尹赜鹏等[19]研究发现,随着温度的升高,在J 点的相对可变荧光强度(VJ)和在K 点的相对可变荧光强度(VK)均有不同程度的增加,VJ上升说明光合电子传递链中QA到QB的电子传递受阻,还原态QA积累量逐渐增多。VK的增加被认为是PSII 电子供体侧放氧复合体OEC 活性受到伤害的特异性标志,高温导致番茄(Solanum lycopersicumL.)幼苗叶片PSII 光化活性降低的原因,主要与PSII 供体侧OEC 的功能及PSII 受体侧QA向QB的电子传递受阻有关,特别是供体侧更为敏感。植物处于高温胁迫下,还会导致细胞色素Cytb6/f 复合物上的质体醌(PQH2)氧化位点的电子转移受到抑制。因此,高温通过降低PSII 受体的氧化性能来影响光合作用,并降低PSII 和PSI 的光合电子传输效率。低温主要通过降低叶片PSII 的实际量子产量(ФPSII)和光化学猝灭系数(qp),引起叶片光合速率下降。李书鑫等[20]基于OJIP 曲线对玉米幼苗叶片响应低温胁迫的研究结果发现,胁迫下WK显著增加了44.7%,而OEC 则减少了13.1%;这表明低温胁迫会造成玉米叶片供体侧损伤。与此同时,低温还会造成ψO、ψEO分别减少6.82%、29.7%,这也进一步证实了在PSII 中电子传递受阻从而抑制电子传递,影响植株的光合能力。
温度胁迫抑制PSII 的活性,导致PSII 光化学效率的下降和光抑制的发生。随着高温胁迫程度和胁迫时间的增加,黄瓜(Cucumis sativusL.)叶片单位PSII 反应中心吸收的光能(ABS/RC)、捕获用于还原QA的能量(TRo/RC)和耗散掉的能量(DIo/RC)均有所升高,而单位PSII 反应中心捕获的用于电子传递的能量(ETo/RC)则降低,这表明天线色素吸收和捕获的光能增加,但用于电子传递的能量减少,出现PSII 的光抑制[21]。PSII 反应中心的D1 蛋白是发生光合抑制的初始位点,低温会抑制参与PSII 光损伤修复循环蛋白质的从头合成以及产生成熟D1蛋白的前体加工,使PSII 的光抑制明显增加[22]。Murata 等[23]分别研究了低温胁迫对光损伤和修复过程的影响发现,低温抑制PSII 的光修复,但不影响对PSII 的光损伤。而且低温胁迫下还会诱导活性氧(reactive oxygen species, ROS)的产生,间接引起细胞膜损伤,因此温度胁迫下PSII 光抑制也有部分原因是PSII 能量过剩造成的。
2 干旱胁迫对植物PSII 的影响
干旱胁迫对光系统的影响表现在类囊体基粒空泡化且皱缩变形,从而导致捕获光子的PSII 解体[24]。缺水条件下NADP 的再生会受到影响,导致电子传递链过度减少。与此同时,PSII 放氧中心复合物(OEC)在干旱胁迫下成为主要受损位点[25]。PSII 核心蛋白D1、D2 和补光色素蛋白LHCII 的稳态水平,在短期干旱胁迫下也会显著降低。Pandey等[26]研究发现,随着干旱胁迫程度的增加,PSII‑LHCII 和PSII 二聚体超复合物的丰度减少,而LHCII 单体增加,Sárvári 等[27]也发现了类似结论。这是由于干旱胁迫下植物类囊体的堆积松散,PSII中心复合物发生解离,从而导致了PSII 反应中心核心蛋白减少。除此之外,前人研究发现,干旱胁迫不仅会对PSII 的反应中心造成损害,还会影响PSII光化学[28]和蛋白质磷酸化[29]。Chen 等[30]对拟南芥(Arabidopsis thalianaL.)响应干旱胁迫的研究发现,PSII 蛋白的磷酸化水平在短期干旱胁迫下没有变化,但长期干旱胁迫则导致其水平显著降低。
干旱胁迫会使植物PSII 光化学效率降低,电子转移受阻。PSII 的最大光化学效率Fv/Fm 和效能指数PIABS,均是反映植物PSII 光化学活性的重要指标。Liu 等[31]研究发现,随着干旱时间的延长,桑树(Morus albaL.)叶片的Fv/Fm、效能指数PIABS和PItotal值均呈降低趋势,其中PIABS和PItotal值与CK相比分别降低了37.5%、46.2%,这说明干旱胁迫会导致PSII 光化学活性的降低。另外,PSII 的量子产率(ФPSII)经常被用来预测线性电子传输的速率。Miao 等[32]研究发现,随着干旱强度的增加,紫参(Rubia yunnanensis)幼苗中ФPSII、qP、ETR 值均趋于降低,这表明PSII 反应中心开放的比例降低,用于光化学反应中电子转移的叶绿素捕获光能减少,光化学量子产率下降。质体醌(PQ)是光系统 II 与细胞色素之间的溶脂性电子载体,Luo 等[33]研究发现,小麦幼苗干旱胁迫后对PSII 的损害,是由于PQ 池减少引起的线性电子传输受阻。叶绿素荧光(chlorophyll fluorescence, ChlF)除了可以用于表示光能的吸收传递外,还可以被用来表达反应中心的供体侧和受体侧的氧化还原状态。在标准化OJIP 曲线上,烤烟(Nicotiana tabacumL.)幼苗的VJ和VK在干旱胁迫下均有不同程度的增加,说明干旱胁迫下PSII 光化学活性的降解与PSII 供体侧和受体侧电子传输受阻有关[34]。此外,有研究发现,干旱胁迫通常与高温协同出现,在孙欧文[35]的研究中发现绣球(Hydrangea macrophylla)的Fv/Fm 和Fv'/Fm'随高温干旱胁迫程度增加而减小,重度复合胁迫后Fv'/Fm'达最小值,这说明复合胁迫显著降低了PSII反应中心的活性,且比单一胁迫更为明显。
光合生物中光抑制是不可避免的,但光合生物能够通过快速有效地修复PSII 来克服光损伤。因此,光抑制的程度取决于PSII 的光损伤与光修复之间的平衡[36]。干旱胁迫会使PSII 天线色素吸收的能量流向光化学的部分减少,以热耗散和荧光形式散失的能量增加。Liu 等[37]研究发现,拟南芥通过增加自身NPQ 水平,耗散掉多余的光能并降低光化学反应效率,来避免受到干旱胁迫的危害。在绿豆(Vigna radiata)中,干旱胁迫降低了ETR( II)的同时也使NPQ 显著增加,表明干旱胁迫使PSII 受体侧电子的积累增加,导致非光化学猝灭增加[38]。NPQ 的增加可能是由于NPQ 的光保护成分增加或非调节光抑制过程。因此,通过引发NPQ 依赖性能量的耗散机制,可以有效保护PSII 功能,维持PSII 光化学活性[39-40]。
3 盐胁迫对植物PSII 的影响
盐胁迫也是制约植物生长与产量的重要非生物胁迫因子。盐胁迫下Na+毒性会对光系统产生比渗透压更为严重的氧化应激,这种盐诱导的氧化应激会破坏PSII 反应中心、氧进化复合体和奎宁受体的还原活性,从而导致PSII 活性降低[41-42]。Mehta等[43]对小麦的研究发现,盐胁迫造成的损害在PSII 的供体侧比受体侧更为突出,当胁迫解除时受体侧可以完全恢复,而供体侧仅可恢复80%。Yin等[44]研究发现,与对照相比,NaCl 胁迫下在K 点的相对可变荧光强度(VK)增加了14.34%,这表明NaCl 胁迫导致PSII 供体侧活性受到抑制和OEC 损伤。因此,盐胁迫造成的离子胁迫和渗透胁迫会使PSII 系统反应中心受到损伤,降低植物的光合电子传递效率以及PSII 的反应中心活性。
高浓度的盐胁迫不仅会破坏类囊体的结构,降低光合能力,还阻碍类囊体膜上PSII 反应中心电子从供体侧向受体侧传递,降低光化学效率[45]。Salim等[46]研究结果表明,盐胁迫导致大麦的吸收(ABS/RC)、捕获(TRo/RC)和电子传递(ETo/RC)能量通量均显著降低,其中ETo/RC 下降最为显著,与对照相比下降了约39%。这表明胁迫下反应中心的电子转移降低,降低了PSII 的初级光化学反应。一般来说,正常生长的植物PSII 的最大光化学效率(Fv/Fm)较为稳定,只有在受到胁迫时才会出现明显变化。周晓瑾等[47]对裸果木(Gymnocarpos przewalskii)的研究发现,其Fv/Fm、ΦPSII 和ETR 值均随着NaCl浓度的增加呈显著下降趋势,表明盐胁迫影响了裸果木叶片的电子传递速率和光化学量子产率,PSII复合体受到破坏,使植物体内有机物质积累减少,这也与刘晓龙等[48]在水稻上的研究结果一致。另外,随着盐浓度的增加,桑树幼苗叶片的ETo/RC和ETo/CSm 显著降低,DIo/RC 和DIo/CSm 升高,说明在盐胁迫下,叶片用于电子转移的吸收能量减少,而用于热耗散的能量增加,这对降低PSII 中多余的激发能,保护电子传递链起到了积极的作用[49]。除单盐胁迫外,植物还会受到盐碱复合胁迫的危害。张云鹤等[42]的研究表明,低浓度混合盐碱胁迫下水稻幼苗叶片受到的抑制较小,PSII 受损较轻;当混合盐碱胁迫浓度升高到120 mmol/L 时,较高浓度的混合盐碱使光系统 II 反应中心受到严重损伤,显著降低叶片的光能利用率,最终导致植株生长受到抑制。
植物光合作用受到盐胁迫时,光合电子传递链上的过剩电子以及过剩的能量会导致活性氧的积累,从而导致过氧化损伤的加剧[50]。刘美岑等[51]研究发现,甜瓜(Cucumis melo)幼苗具有主动响应NaCl胁迫的适应机制,低浓度处理下通过调节气孔开度、维持高叶绿素含量、提高抗氧化酶活性,从而保持较高的PSII 电子传递功能,减缓盐胁迫对光系统的抑制作用。随着NaCl 处理浓度的升高,2 个甜樱桃(Prunus aviumL.)砧木的NPQ 呈现逐渐升高的趋势[52],与对照相比,在150 mmol/L NaCl 胁迫下分别显著增加了73.2%和117.9%。因此在盐胁迫下植物通过降低PSII 原初光能转换效率和抑制电子传递效率,以减少用于光化学电子传递的份额,从而减轻光合器官受损伤的程度;同时PSII 反应中心会启动保护性调节机制,通过增加热耗散来消耗过多激发能,从而实现自我保护。
4 重金属胁迫对植物PSII 的影响
一些金属元素如镉(Cd)、铜(Cu)、汞(Hg)、铅(Pb)、锌(Zn)等同样会对植物生理代谢过程产生破坏[53]。许多研究表明,重金属进入植物体内会影响补光天线蛋白复合物对光能的捕获和传递。LHC II b 为主体捕光色素复合物,在植物体内主要以三聚体的形式存在,LHC II b 三聚体结构的形成是高效光能捕获的前提。Janik 等[54]研究发现,Cd胁迫下黑麦(Secale cerealeL.)幼苗中LHCII b 复合物的含量较对照相比显著降低,这是因为Cd 会降低LHC II b 的聚集度,三聚体结构减少,单体和寡聚体结构变多,进而降低对光能的捕获效率。除此之外,重金属还会对PSII 活性产生不利影响,D1 和D2 作为PSII 的核心蛋白,在Cd 胁迫下其含量显著下降,但不同品种间的下降存在差异,可能是因为不同水稻品种在Cd 胁迫下具有不同的抗性[55]。高浓度的重金属还会与PSII 供受体侧蛋白结合,破坏蛋白功能,从而导致反应中心两侧产生不平衡的氧化还原状态。前人研究发现,进入植物体内会与PSII 供受体侧蛋白中的‑SH 结合,强烈抑制光合电子传递链,使反应中心两侧产生不平衡的氧化还原状态,并产生过量的ROS 攻击PSII 反应中心[56]。Pb 与PSII 蛋白结合可以诱导QB复合酶的结构改变,从而影响PSII 复合物的稳定性[57]。
重金属不仅会影响PSII 的结构和功能,还会影响PSII 和PSI 的光合电子传递。重金属会抑制植物的PSII 光能捕获,出现高qp、低ΦPSII 的现象,进而阻碍PSII 供受体侧的电子传递。植物的最大光化学效率Fv/Fm 在重金属胁迫下表现一定程度的下降,在甜高粱(Sorghum bicolor)[58]、榉树(Zelkova serrata)[59]、水稻[60]等中均发现Fv/Fm 随胁迫程度增加而降低。前人研究发现,低浓度的Hg 刺激叶绿素合成,改善PSII 反应中心结构,从而提高光合效率,而高浓度的Hg 则抑制PSII 化学活性和光合电子传递效率[61]。重金属会破坏电子传递链的多个作用点,Chen 等[62]分析了L、K、J 和I 点的相对可变荧光变化发现,Cu 和Zn 胁迫处理叶片的VJ均显著高于对照,说明QA向QB的电子转移受到了抑制。Zhang 等[63]研究发现,随着Pb 和Cd 浓度的增加,桑树VJ和VK均有一定程度的增加,这表明Pb和Cd 都可以抑制PSII 供体侧的OEC 活性,并且抑制PSII 受体侧的电子转移。但VJ和VK在Pb 和Cd胁迫下的变化并不一致。Pb 胁迫下桑叶VJ显著低于Cd 胁迫,而VK则相反,说明Pb 胁迫对PSII 供体侧OEC 的损害更大,Cd 胁迫主要破坏PSII 受体侧QA向QB的电子转移过程;因为Pb 胁迫对桑叶PSII 供体侧的损害程度大于Cd 胁迫,所以Pb 胁迫降低了桑叶PSII 受体侧的电子压力。
植物体内过量的重金属离子还会诱导光抑制量子产率增加,从而打破光抑制与光修复的平衡。植物叶片中PSII 的光抑制不仅与其供体或受体的损伤有关,还与QA的还原程度密切相关。姚广等[64]的研究发现,随着Pb 胁迫程度的加深,玉米PSI 和PSII 的活性均不断下降,PSI 的功能减弱进一步阻止了PSII 向PSI 的传递,增加了QA的还原程度,从而加重了PSII 的光抑制。除了NPQ 途径,环式电子流(cyclic electron flow, CEF)也可以缓解植物在逆境胁迫下的光抑制。杨富文[65]研究表明,CEF 可以增加ΔpH 来驱动合成更多的ATP,从而增加ATP NADPH 产生比,增强PSII 中OEC 的稳定性,缓解光抑制。因此,NPQ 与CEF 是植物PSII 应对不利环境下缓解光抑制的两种重要调节方式[66]。
5 总结与展望
温度、干旱、盐、重金属等非生物胁迫,是限制全球作物生产力的重要制约因子。尽管植物在应对非生物胁迫时自身具有一定的调节能力,但PSII性能的稳定对提高其抗逆能力尤为重要。基于目前本课题组对植物逆境生理的研究发现,施加外源激素、接种丛枝菌根真菌(AMF)等能显著提高非生物胁迫下植物的光合能力,增强PSII 的稳定性;并且综合运用多组学技术对植物光系统抵御逆境胁迫的分子机制做出了进一步阐述。总体而言,逆境胁迫都会干扰PSII 的结构与功能,使电荷分离和能量转换速度变慢,光反应中心和外部抗氧化体系的功能也受到影响。不利环境条件下抑制植物叶片电子传递的位点往往是PSII 的电子供体侧和受体侧。植物自身具有一定的调节机制,如NPQ、CEF 等途径都可以缓解逆境胁迫下PSII 的光抑制。本文对国内外非生物胁迫如温度、干旱、盐以及重金属下植物PSII 的研究进行了归纳与总结,基于现有研究存在的问题,未来还需从以下3 个方面进行深入探究:
(1)叶绿体类囊体膜中的色素-蛋白质复合物是植物进行光能吸收、传递和转换的关键部位,因而一直是针对PSII 进行研究的热点。目前对组成PSII 复合体的核心蛋白组分(D1、D2、CP43、CP47、LHCII 复合体)的研究较为详细,已经在空间结构、能量传递及分子生物学方面取得了许多重要的成果[67-68],但叶绿体类囊体蛋白质组中的大量未知蛋白的功能还有待鉴定。因此,随着膜蛋白提取分离效率的提高及蛋白质检测技术的改进,探究更多低丰度蛋白将会有助于对处于非生物胁迫下植物PSII 的功能及结构进行深入了解,同时也可以为PSII 响应逆境胁迫研究提供重要的理论依据。
(2)叶绿素荧光可以测量光合反应中水的光解、电子传递、类囊体膜上的pH 梯度形成以及ATP 合成等过程。大多数关于叶绿素a 荧光发射的研究都是基于多相荧光瞬态来获得荧光动力学参数,但由于影响叶绿素荧光的因素较多,使其对处于非生物胁迫下植物的监测研究变得更为复杂。另外,对于各叶绿素荧光参数在生物学意义上还存在很多争议且使用鉴定混淆不清,有待统一规范。因此,解析胁迫环境下制约ChlF 因素的关键机理,可以进一步解释PSII 在逆境胁迫下荧光动力学参数变化的分子机制。
(3)PSII 是发生光抑制的原初部位,有关植物PSII 光抑制的研究已然取得了重大突破,目前已发现植物体存在多种光抑制的保护机制,但并不是每种机制都同等重要,并且在防御光破坏的主要机制上还存在种间差异。此外,尽管现阶段有关光抑制的研究都是围绕PSII 开展的,但并不是说光抑制只发生在PSII,仍有部分植物光抑制发生在PSI,对PSII 毫无影响[69-71]。从以上事实和目前的研究现状可以看出,非生物胁迫下植物光合作用的光抑制是一项极其复杂的研究,仍有许多问题亟待解决,还需进一步探讨。