植物PRR 免疫受体功能研究进展
叶红 王玉昆
(广东省粤北食药资源利用与保护重点实验室 韶关学院生物与农业学院,韶关 512005)
植物在长期的生存过程中一直在与来自环境中的各种不利因素进行斗争,病害就是这些不利因素中的重要一员。植物病害的危害不言而喻,其可在全球范围内造成极其严重的经济、社会和生态后果[1]。感染植物的病原体是多种多样的,包括细菌、真菌、卵菌、线虫和食草动物等[2]。但目前地球上的植物依然呈现出欣欣向荣的景象,这主要得益于植物拥有一套非常复杂的免疫系统。植物免疫系统在与病原体的长期斗争中得到协同进化,最终达到并维持在一个相对稳定的状态,保护植物抵御绝大多数的病害侵袭[3]。
2006 年,Jones 和Dangl[4]提出了植物免疫的“Zigzag”理论模型。该模型建立由微生物/病原体相关分子模式(microbe/pathogen‑associated molecular patterns, M/PAMP)触发免疫反应(PAMP‑triggered immunity, PTI),效应子触发敏感性(effector‑triggered susceptibility, ETS)和效应子触发免疫(effector‑triggered immunity, ETI)组成的四步免疫应答机制。该模型涵盖了植物不同的免疫系统并阐明了PTI 和ETI 如何在功能和进化上与效应子产生作用。
存在于细胞表面和细胞内的各类免疫受体是植物感知病原体侵染时释放的各种信号的结构基础。模式识别受体(pattern recognition receptors, PRRs)定位于细胞表面,属于植物第一层免疫防御体系。核苷酸结合域和富亮氨酸重复序列受体(nucleotide‑binding domain and leucine‑rich repeat containing receptors, NLRs)存在于细胞内,属于植物第二层免疫防御体系。PRRs 可感知MAMP、PAMP 和宿主产生的损伤相关分子模式(damage‑associated molecular patterns, DAMP)。当感知到处于质外体(apoplasm)的分子模式时,PRRs 则激活PTI。研究表明,PRR信号参与了细胞质Ca2+和质外体活性氧(reactive oxygen species, ROS)爆发、Ca2+依赖性蛋白激酶(Ca2+‑dependent protein kinases, CDPKs)、丝裂原活化蛋白激酶(mitogen‑activated protein kinase, MAPK)级联反应、防御激素网络以及广泛的转录、翻译和代谢重编程等免疫反应[2,5]。
病原体进化出多种机制来抑制或者逃避PTI。通过分泌效应蛋白(effectors),这些效应蛋白可以直接或间接地操纵、攻击PTI 信号途径的关键组分,从而增强效应蛋白激活的感病性(ETS)[5]。相应地,植物进化出了NLRs 介导的胞内防御体系,通过感知侵入胞内的效应物,启动具有特异性的免疫反应ETI,从而将效应蛋白引起的病害扼杀[6]。依据上述的“Zigzag”理论模型,PRRs 与NLRs 具有明显的联系,二者介导的免疫反应信号通路有相互重叠的部分但又具有一定的区别[2]。关于NLRs 介导的免疫反应机制已有较好的总结[7-8],此处不再赘述。本文以PRRs 介导的免疫反应为重点,结合近年来人们在PRR 功能研究方面取得的研究成果,对PRR及其参与调控植物对生物和非生物免疫应答机制进行综述。
1 PRRs 类型及特征
PRRs 是植物先天性免疫防线的受体。由先天性免疫产生的基础抗性是植物抵御大多数病原体侵袭的根本原因。绝大多数PRRs 定位于植物细胞膜上,是一类由宿主编码的蛋白质[9]。目前普遍认为PRRs主要分为类受体蛋白(receptor‑like proteins, RLPs)和类受体蛋白激酶(receptor‑like protein kinases,RLKs)两大类[10-11](图1)。多数植物的PRRs 属于RLKs。RLK 蛋白含有一个胞外结构域,作为MAMP或DAMP 的结合位点,其次含有一个单跨膜结构域和一个细胞质蛋白激酶结构域,能在细胞内信号转导中起作用[12]。许多RLKs 能够响应生物胁迫,也有些被证明对植物发育是不可缺少的[2]。RLP 蛋白结构与RLK 相似但有一定区别。RLP 蛋白缺少细胞质激酶结构域,取而代之的是一个很短的细胞质结构域,且不具备信号传导能力,故RLP 蛋白通常需要与RLK 或其他膜蛋白(共受体,coreceptors)相互作用才能在膜上传递信号[13]。
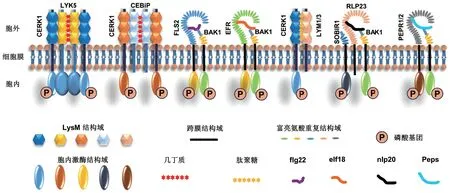
图1 植物中主要PRR 受体及共受体结构Fig. 1 Structures of main pattern recognition receptors and coreceptors in plants
RLKs 和RLPs 通过胞外结构域与配体结合并将信号传递到细胞内。PRRs 携带多种类型的胞外结构域,如富含亮氨酸重复序列(leucine‑rich repeats,LRRs)、凝集素(lectins)和lysin‑motifs(LysMs)[14]。通过对350 种植物的PRRs 数量进行研究发现,PRRs 的分布具有一定的物种特异性,其数量在不同物种中有明显差异,其中包含LRR 结构域的LRR‑RLKs 和LRR‑RLPs 是植物中最大的RLK 和RLP 基因家族。LRR‑RLKs 可进一步分为20 个亚组,每个亚组参与不同的生物学过程[15]。LRR‑RLPs 基因家族成员数量在不同植物中也存在明显差异。
2 PRRs 与MAMPs 的识别
作为细胞表面受体,PRRs 能够识别来源于真菌、细菌、卵菌、寄生植物和食草动物的分子模式,也有一些PRRs 可以识别自身的一些分子,如DAMPs和植物内源性肽[3]。多数PRRs 与其共受体结合激活下游免疫反应,也有一些PRRs 不直接参与识别,而是作为共受体和免疫信号的负调节子发挥作用[2]。得益于结构生物学技术,植物中一些受体和MAMPs的结构得到精确解析,相关的结果推动了植物免疫受体与配体结合机制的研究。
2.1 PRRs与真菌源MAMPs的识别
目前,真菌源MAMPs 主要有几丁质(chitin)、乙烯诱导木聚糖酶(ethylene‑inducing xylanase, EIX)、内多聚半乳糖醛酸酶(endopolygalacturonases, PGs)等[3]。几丁质是真菌细胞壁主要组成成分,为真菌所特有,其由N‑乙酰基葡萄糖聚合而成。几丁质及其片段(几丁质低聚糖或N‑乙酰壳寡糖)是典型的真菌MAMP,在单子叶植物和双子叶植物中都会引发各种防御反应,这表明在广泛的植物物种中存在感知这些低聚糖的保守机制[16]。多年来,人们一直在努力鉴定不同植物的膜组分中几丁质低聚物的高亲和力结合位点。第一个几丁质结合蛋白CEBiP(chitin elicitor‑binding protein)从水稻(Oryza sativa)悬浮细胞中利用亲和层析法得到[17]。研究最清晰的LysM‑PRRs 是CERK1(chitin elicitor receptor kinase 1),最初在拟南芥(Arabidopsis thaliana)中被发现与几丁质诱导的免疫反应有关。CERK1 被认为是主要的几丁质受体,它由具有三串联LsyM 的细胞外结构域、跨膜结构域、近膜结构域和细胞内丝氨酸/苏氨酸激酶结构域组成,其突变体不发生几丁质诱发的PTI 反应[18]。晶体结构研究表明几丁质低聚物(1,4‑b‑glcnac 的聚合物)能与CERK1 二聚体的LysM结构域结合。在几丁质低聚物中,四聚体和五聚体直接以高亲和度结合LysM 结构域,但却很少或没有激活免疫反应,而七聚体和八聚体虽表现出最高的免疫活性,但与CERK1 的亲和力较低。高聚几丁质可以同时结合两个或多个CERK1 分子,而CERK1分子的聚集诱导其胞质激酶结构域的转磷酸化,进而导致下游级联信号激活[16,19]。
CERK1 与高聚几丁质的亲和力较低,含有LysM 结构域的受体LYK5(lysin motif receptor kinase 5)与高聚几丁质的亲和力要高得多。几丁质与LYK5 的结合对于LYK5 和CERK1 的异二聚化是必不可少的,是启动几丁质触发的免疫反应所必需的,说明LYK5 是拟南芥的主要几丁质受体[20-21]。LYK4是另一种参与几丁质信号传导的LysM‑RLK,它也与LYK5 和CERK1 相互作用,并且对几丁质低聚物具有一定的结合亲和力[21-22]。LYK5 和AtLYK4 的胞内激酶结构域均无活性,因此,二者需要与CERK1结合并利用CERK1 的胞内激酶活性来进行几丁质信号转导。这些结果说明,CERK1 是几丁质信号转导的共受体,而不是直接受体[16]。葡萄糖的乙酰化修饰影响几丁质激发子的活性。壳聚糖是完全去乙酰化的几丁质,在植物中引起相当弱的防御反应,而活性乙酰化壳聚糖低聚物需要聚合4-6 个N ‑乙酰氨基葡萄糖[23-24]。许多真菌病原体在进入宿主时,通过几丁质去乙酰化来逃避宿主免疫系统的感知。去乙酰化的几丁质可能与CERK1 具有一定的结合亲和力,因为去乙酰化几丁质处理能够阻碍细胞中CERK1‑LYK5 受体复合体对壳寡聚物的识别[25]。
水稻CERK1 能够识别几丁质,但不能结合几丁质,而细胞膜糖蛋白CEBiP 能够以高亲和力结合几丁质[17,26]。CEBiP 是植物中第一个被发现的几丁质受体,其结构中含有3 个串联LysM 结构域和一个短的跨膜结构域,但缺少发挥信号转导的胞内结构域[17,27]。大量研究表明,在识别和结合几丁质后,CEBiP 二聚体招募CERK1 形成免疫复合体,进一步导致CERK1 同二聚化,随后CERK1 被磷酸化并激活免疫反应[27-28]。此外,另外两个含有LysM 结构域的RLPs,即LYP4(lysin motif‑containing protein 4)和LYP6,能够以中等亲和力结合可溶性几丁质和不溶性蟹壳几丁质,且二者为防御应答所必需[29]。
除了几丁质, 植物PRRs 还能识别其他真菌源MAMPs 从而触发免疫反应。在拟南芥中,RBPG1(RESPONSIVENESS TO BOTRYTIS POLYGALACTURONASES 1, 属于LRR‑RLP) 能够识别多种活性和非活性PGs,并通过与SOBIR1(SUPPRESSOR OF BIR1)互作激活免疫反应[30-31]。在番茄(Lycopersicon esculentum)中,Eix1 和Eix2属于LRR‑RLP,二者均能结合EIX,但只有Eix2 能介导免疫反应。Eix1 是Eix2 的诱饵受体,其需要与BAK1(BRI1‑ASSOCIATED RECEPTOR KINASE 1)互作激活免疫反应[32-33]。
2.2 PRRs与细菌源MAMPs的识别
细菌源MAMPs 包括鞭毛蛋白肽(flagellin peptide)、ax21、转录延伸因子(elongation factor Tu,EF‑Tu)、肽聚糖(peptidoglycans, PGNs)、结瘤因子(nod factors)和脂多糖(lipopolysaccharide, LPS)等[3]。细菌鞭毛蛋白肽有多种类型,例如丁香假单胞菌(Pseudomonas syringae)来源的N 端含22 个氨基酸残基的flg22,大肠杆菌(Escherichia coli)来源的含有15 个氨基酸残基的flg15 以及flgII‑28[34-38]。拟南芥FLS2(FLAGELLIN‑SENSITIVE 2)是植物中研究较为透彻的LRR‑RLK 类PRR。蛋白结构分析表明,FLS2 螺旋结构内表面的保守位点和非保守位点分别识别flg22 的C‑末端和N‑末端片段并进行结合,而共受体BAK1 除了与FLS2 直接结合,还通过识别FLS2 结合的flg22 的C 末端与FLS2 形成复合体,进而激活下游免疫反应[39]。在番茄中,FLS2 仅识别flg15,而FLS3 却识别flgII‑28[37-38]。这些结果表明植物对同一类型MAMPs 进化出多个PRRs,有效地增强对同一病原物的识别和防御。有些细菌为了逃避宿主免疫受体的识别从而将鞭毛蛋白肽进行了糖基化修饰,并高度聚集形成复杂的结构来避免鞭毛蛋白肽直接暴露。本氏烟草(Nicotiana benthamiana)能合成分泌型β-半乳糖苷酶BGAL1(β-galactosidase 1)并促进糖基化鞭毛蛋白的水解和释放,进而激发免疫反应[40-41]。
在鞭毛蛋白受体基因FLS2突变的植物中,flg22处理没有引发免疫反应,但用细菌粗提取物处理后植物依然具有免疫能力,表明细菌提取物中含有不同于鞭毛蛋白的MAMP。随后的研究证明EF‑Tu(elf18/elf26 epitope)就是此类MAMP。EF‑Tu 在所有细菌中都是高度保守的,且在大肠杆菌中其N 端被乙酰化修饰。拟南芥能特异性地识别EF‑Tu 的N端前18 个乙酰化氨基酸残基组成的短肽elf18,并完全激活免疫反应[42]。进一步研究发现,LRR‑RLK型蛋白ERF(EF‑Tu receptor)是elf18 的受体[43]。同flg22 类似,elf18 也被包裹在EF‑Tu 复杂的蛋白结构中,但植物是如何使elf18 从复杂蛋白结构中暴露出来进行识别,有待进一步研究[43]。
水稻受体激酶Xa21 是最早在植物中克隆的受体激酶之一,它能使水稻对引起白叶枯病的病原菌X. oryzaepvoryzae(Xoo)产生抗性。Xa21基因在很长一段时间内被认为是1 个抗性基因,但现在被证明是一种LRR‑RLK 型PRR,该受体的配体是由Xoo分泌的硫酸化肽ax21,能够激活Xa21 介导的免疫反应[44]。
肽聚糖(PGNs)是植物中具有免疫刺激活性的细菌细胞壁的主要成分,由交替的β-1,4 糖苷键连接的N‑乙酰葡糖胺(GlcNAc)和N‑乙酰胞壁酸(MurNAc)残基组成。在拟南芥中,PGNs 起PAMP的作用,由LysM‑RLP 型受体蛋白LYM1 和LYM3识别。LYM1 和LYM3 缺少胞内结构域,需要和CERK1 组成协同体系介导下游免疫反应,但CERK1不能直接识别PGNs,而LYM1 和LYM3 也不能识别几丁质[45-48]。在水稻中,LYM3 的同源蛋白LYP4和LYP6 不仅可以识别PGNs,也可以识别几丁质[19]。这些结果说明不同植物中PRRs 的功能有差异,且其拥有的免疫识别系统具有物种差异性。
此外,结瘤因子作为主要的根瘤信号分子,能够促使豆类发育新的植物器官根瘤。在豆科植物百脉根(Lotus japonicus)中,拥有LysM 结构域的受体蛋白NFR1(nod factor receptor 1)和NFR5 通过识别根瘤菌分泌的结瘤因子使豆科植物与根瘤菌互惠共生[49-52]。
脂多糖是革兰氏阴性菌细胞壁的主要成分,由脂质A、核心寡糖和O‑抗原组成。虽然人们早就知道LPS 可以激活植物的免疫反应,但目前还没有发现LPS 的受体。研究人员通过筛选对LPS 反应有缺陷的拟南芥突变体发现,G 型凝集素RLK LORE(lipooligosaccharide‑specific reduced elicitation)是LPS 引发免疫反应的必须因子。然而,最近的一项研究表明,在植物免疫过程中LORE 识别的配体为中链3‑羟基脂肪酸(medium‑chain 3‑hydroxy fatty acids, mc‑3‑OH‑FAs),而不是LPS。游离3‑OH‑C10:0 对LORE 外结构域具有结合亲和力,表明它是LORE 的配体[53]。
2.3 PRRs与卵菌源MAMPs的识别
尽管当前对破坏性卵菌病原,如马铃薯晚疫病病菌(Phytophthora infestans),进行了深入的研究,但人们对植物中识别卵菌源MAMPs 受体的认识依然有限。卵菌源MAMPs主要包括卵菌细胞壁成分β-1,3‑和β-1,6‑葡聚糖,葡聚糖-壳聚糖和纤维素结合激发子凝集素等。此外,转谷氨酰胺酶GP42、疫霉菌丝体中的二十碳多烯酸和疫霉木葡聚糖特异性内切葡聚糖酶XEG1,也被认为是卵菌源MAMPs[3,54]。坏死和乙烯诱导肽(necrosis and ethylene‑inducing peptide 1, Nep1)样蛋白(Nep1‑like proteins, NLPs)广泛存在于卵菌、真菌和细菌中。大多数NLPs 在双子叶植物中作为细胞毒素诱导坏死和乙烯(ethylene,ET)产生,其序列中相对保守的20-24 个氨基酸位点, 即nlp20 和nlp24, 为相应的MAMPs[55-56]。nlp20 在十字花科植物中触发非坏死的防御反应。拟南芥中LRR‑RLP 型受体 RLP23 为nlp20 受体,该受体与SOBIR1 和BAK1 形成受体复合体激活免疫反应[57]。近期的相关研究报道了本氏烟草中LRR‑RLP型受体RXEG1 的晶体结构。该受体可识别来自大豆疫霉菌(Phytophthora sojae)的XEG1。蛋白结构分析显示,XEG1 的特异识别主要由位于RXEG1 氨基端和羧基端环出区介导。这两个环结合到XEG1 的活性位点凹槽上,抑制其酶活性,从而抑制烟草中疫霉菌感染。此外,XEG1 的结合促进了RXEG1 与LRR 型共受体BAK1 的结合,从而引发RXEG1 介导的免疫反应[58]。
卵菌病原菌分泌的激发素可诱导烟草坏死和病原菌抗性。在野生马铃薯(wild potato)中,LRR‑RLP85(ELR)能够广泛识别一系列卵菌源激发素,如P. infestans分泌的INF1,但ELR 与激发素的结合尚缺乏直接证据[59]。ELR 能够与BAK1/SERK3 结合,从而在栽培马铃薯(cultivated potato)中激活对P. infestans的抗性。在本氏烟草中,BAK1/SERK3 和SOBIR1 都是激发素触发细胞死亡所必需的,表明ELR‑BAK1‑SOBIR1 复合物在激发素感知和信号传导中具有重要作用[60]。
2.4 PRRs与DAMPs的识别
DAMPs 是植物受到生物或非生物胁迫后产生损伤而产生的自身性分子模式。对DAMPs 的识别能够增强MAMPs 触发的免疫反应,从而更加高效地实现植物对病原菌的防御[3,61]。高迁移率族蛋白(high‑mobility group box protein, HMGB)对植物和动物均具有免疫原性。在拟南芥中,HMGB3 在组织细胞受感染损伤时释放,引发类PTI 反应,但其相应的受体仍然不明确[62-63]。细胞外ATP(eATP)也能触发植物免疫反应。在拟南芥中,L 型凝集素类受体激酶 DORN1/LecRK‑I.9 识别在损伤或病原体攻击时释放的eATP 从而诱导类PTI 反应[64-65]。寡聚半乳糖醛酸(oligogalacturonides, OGs)是植物细胞壁果胶片段,在植物受到真菌或昆虫啃食后经植物多聚半乳糖醛酸水解而来。OGs 由与细胞壁紧密相连的受体WAK1(CELL WALL‑ASSOCIATED KINASE 1)和WAKL(WAK‑like)识别[66-69]。研究发现PEPRs 也参与了OG 的感知和下游信号的激活[70]。此外,角质单体和纤维素衍生低聚物(如纤维二糖)也具有免疫原性,但其相应的受体尚未确定[71]。
目前,几种内源性肽也被视为DAMPs,其在昆虫啃食或抵抗病原体过程中由前体加工产生或由损伤细胞释放[71]。在番茄中,18 氨基酸肽系统素触发茉莉酸依赖的免疫信号,使植物产生食草动物抗性[72]。富羟基脯氨酸系统素(hydroxyproline‑rich systemins, HypSys)是一种含18 个氨基酸的糖基化肽,也在茄科植物中介导了食草动物的防御[73]。在拟南芥中,RLK7(receptor‑like kinase 7)以依赖于BAK1 的方式识别PIP1 和PIP2 从而激活免疫防御[74]。RALF(RAPID ALKALINIZATION FACTOR)肽也是一种DAMP,包括免疫刺激和免疫抑制类型,能在PTI 信号传导中调节不同的配体-受体复合物。FER(FERONIA)受体能够识别RALF 肽[75]。
植物激发子肽(plant elicitor peptide, Peps)是植物中研究较为详细的DAMPs。拟南芥中含有8 种不同的Peps(Pep1-Pep8)。Pep1-Pep8 的激发活性位点位于其前体蛋白PROPEP 的C 端,能够被LRR‑RLK 型受体PEPR1/PEPR2 识别,但需招募共受体蛋白BAK1 激活免疫反应[76-79]。此外,玉米中含有5 种Peps。Pep1 调控玉米抗病原菌防御反应,引起JA 和ET 的合成和防御标记(如PR 蛋白和苯并恶嗪类植物抗菌素)的积累[80]。
3 PRRs 介导的PTI 下游信号
通过PRRs 对不同模式的感知,植物才能启动PTI。PTI 反应的输出由一些细胞的和生理的信号直接反映(图2)。这些信号包括质膜离子通量的变化,胞质Ca2+浓度增加、胞外ROS 水平的增加、丝裂原活化蛋白激酶(mitogen‑activated protein kinase,MAPK)激活,以及后续的ET 和水杨酸(salicylic acid, SA)等植物激素产生、气孔关闭、胼胝质沉积、转录和代谢重编程等[71]。
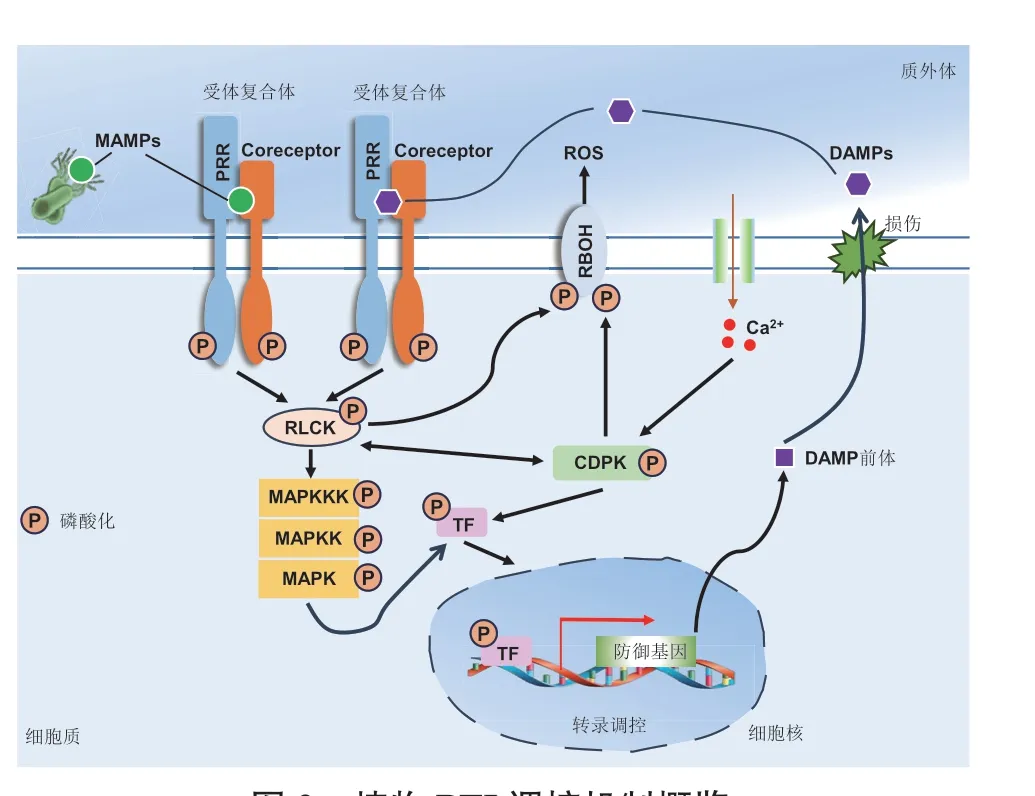
图2 植物PTI 调控机制概览Fig. 2 An overview of pattern-triggered immunity(PTI)in plants
3.1 PTI中的质膜离子通量变化
在识别MAMPs 后,胞内Ca2+浓度短时间内快速上升,为植物PTI 激活后的典型特征。对于不同MAMPs 的刺激,胞内Ca2+浓度和持续时间均有所差异,从而调控不同的下游信号途径[81-83]。细胞内Ca2+浓度升高依赖于Ca2+‑ATPases 和Ca2+转运蛋白的主动运输以及Ca2+通道的被动运输。Ca2+通道蛋白CNGC2(cyclic nucleotide gated channel 2)、CNGC4 和CNGC9 被证明分别参与了拟南芥和水稻中MAMPs 识别引起的胞质Ca2+爆发。此外,CNGC19 通过依赖Pep 受体PEPR 的方式参与拟南芥的先天免疫反应[84]。拟南芥中另一种Ca2+通道OSCA1.3 在免疫过程中控制气孔关闭。在感知到MAMP 时,OSCA1.3 被BIK1 快速磷酸化[85]。Ca2+转运也需要能量依赖性Ca2+泵,如内质网型Ca2+‑ATPase(ECAs) 和自我抑制型Ca2+‑ATPase(ACAs)。 在拟南芥中,ACA4、ACA8、ACA10、ACA11、ACA12 和ACA13 参与PTI 介导的胞内Ca2+的转运[86-88]。
除Ca2+的通量变化,H+内流和K+、Cl-外流也是植物PTI 的早期反应之一。这些反应产生迅速,使植物细胞外碱化和细胞膜去极化[3,89-90]。H+‑ATPases(AHAs)在静息细胞中介导H+从细胞质流出从而建立细胞膜电位,但模式诱导的AHA 失活允许H+沿电化学梯度流入胞内,同时Cl-和K+外排,导致细胞外碱化[90-91]。在拟南芥中,当PTI 发生时,AHA 的活性受特定位点的磷酸化和去磷酸化调控[92-93]。FER 对AHA 的磷酸化导致其失活从而造成细胞外碱化[92]。相反,PTI 中的AHA 激活能够阻止细胞外碱化并使气孔关闭[94-95]。
3.2 PTI中的ROS爆发
ROS 作为信号分子,其爆发是植物PTI 相应的重要标志[3]。模式诱导的胞外ROS 的产生需要细胞膜定位的NADPH 氧化酶RBOHD(respiratory burst oxidase homolog)和过氧化物酶PRX33(peroxidase 33) 及PRX34[96-99]。PRX33 和PRX34 受细胞分裂素受体ARR2 的调控, 促进SA 或MAMP 介导的ROS 爆发[100]。RBOHD 一方面受到Ca2+依赖蛋白(Ca2+‑dependent protein kinases, CDPKs)CPK5、CPK6、CPK11 和CPK4 的磷酸化修饰而激活,另一方面,也能由BIK1(botrytis‑induced kinase 1)的磷酸化修饰而激活,且两种激活方式在RBOHD 上的作用位点不同。BIK1 不仅能够促使胞质Ca2+爆发,也能促进RBOHD 与G 蛋白三聚体XLG2‑AGB1‑AGG1/AGG2 互作,从而确保RBOHD 激活。G 蛋白三聚体XLG2‑AGB1‑AGG1/AGG2 能够介导BIK1的稳定和积累[101-105]。这些发现表明Ca2+、ROS 和BIK1 之间存在一个正反馈的信号放大机制,从而增强PTI[3]。值得注意的是,CPK28 通过磷酸化BIK1导致其蛋白降解,且有研究发现PBL13(AvrPphB SUSCEPTIBLE1‑LIKE 13)通过与RBOHD 的互作来负调控ROS 的积累,表明在PTI 中ROS 的水平受到精细调控[106-107]。在水稻中,磷酸化的RacGEF1(Rac GDP/GTP exchange factor 1)激活并与Rac1 共同发挥作用,通过与RBOHB 的直接互作诱导ROS 的产生,从而介导真菌的抗性[108-111]。
3.3 PTI中的MAPK信号转导
MAPK 级联信号转导是PTI 响应的早期反应之一。植物通过MAPK 信号途径中一系列顺序磷酸化,将受体或受体复合体的磷酸化信号传递至特定底物,从而调控特定抗性基因表达,使植物获得免疫抗性[3]。在拟南芥中,几丁质诱导CERK1 磷酸化PBL27,进而PBL27 磷酸化MAPKKK5,由此表明,LYK5/LYK4‑CERK1 几丁质受体复合物,与由MAPKKK5‑MKK4/MKK5‑MPK3/MPK6 组 成 的MAPK 级联存在直接联系[112-113]。目前研究认为,拟南芥中主要存在MEKK3/MEKK5‑MKK4/MKK5‑MPK3/MPK6 和MEKK1‑MKK1/MKK2‑MPK4 两条信号途径[3]。MPK3/MPK6 磷酸化的1‑ 氨基环丙烷‑1‑羧酸合成酶2(ACS2)和ACS6 促进了植物对flg22 应答时ET 的合成[114]。MPK3/MPK6 在PTI中也能磷酸化一些诸如BES1(BRASSINOSTEROID INSENSITIVE1‑ETHYL METHANESULFONATE‑SUPPRESSOR 1)、ERF104(ethylene response factor 104)、WRKY33、VIP1(VirE2‑INTERACTING PROTEIN1)转录因子和VQ 蛋白(VQ‑motif‑containing proteins, VQPs)[115-120]。 细胞周期蛋白依赖性激 酶Cs(cyclin‑dependent kinase Cs, CDKCs) 的MPK3/MPK6 磷酸化,以及随后CDKC 对RNA 聚合酶IIc 末端结构域的磷酸化,直接介导了防御相关基因的转录激活[121]。MPK3/MPK6 和MPK4 通过磷酸化mRNA 结合蛋白TZF9 和PAT1 来调控细胞质加工体中mRNA 的质量[122-123]。MPK3 对PTI 负调控因子PUB22(plant U‑box(PUB)type E3 ligase 22)的磷酸化抑制了PUB22 自泛素化和降解[124]。flg22 诱导的MPK4 磷酸化转录抑制因子ASR 导致防御相关基因的抑制[125]。MAPKKK5 功能丧失导致MPK3/MPK6 在CERK1‑PBL27 磷酸化传递(phospho‑relay)中的激活,增强了flg22 诱导的MPK3/MPK6激活[113]。MAPKKK7 能够与FLS2 结合,并通过未知途径减弱flg22 诱导的防御[126]。此外,铜绿假单胞菌和绿脓杆菌分泌蛋白酶PrpL 和ArgC,分别诱导MAPK 以不同的模式激活[127]。进一步的研究表 明,RLCK185‑MAPKKK18/24‑MKK4‑MPK3/6 和RacGEF1‑Rac1 是水稻中的两条介导CERK1 依赖的几丁质信号[70,126-127]。
4 PRRs 在植物抗盐胁迫中的作用
不同的非生物胁迫通常引起植物细胞膜和不同亚细胞膜结构的流动性、完整性和功能的改变,从而产生DAMPs。尽管精确的感知机制仍然不明确,但胁迫信号通常能够引起与PTI 类似反应,从而使植物减轻非生物胁迫的破坏性影响[2]。
盐胁迫是植物生长发育面临的重大挑战之一。在高盐度条件下,植物细胞壁往往发生软化和重塑,其完整结构遭到破坏[2]。RLKs 能够感受细胞壁的完整性,并在细胞壁遭到破坏时引发类PTI 防御[128]。类受体激酶THE1(THESEUS1)能够和MIK2/LRR‑KISS 及FEI2 互作对拟南芥根的生长和耐盐性进行调控[129-130]。FER 能够抑制ABA 信号和盐胁迫下对离子毒性的耐受性[131]。此外,FER 在盐胁迫诱导的细胞壁软化恢复中也发挥重要作用[2]。
盐胁迫诱导的损伤传感和信号传导涉及Pep‑PEPR 通路。Peps 是前体蛋白PROPEP 的一部分,被认为是一种损伤信号,能够结合并激活胞外Pep受体蛋白PEPRs,从而激活类PTI。PROPEP 在受到生物和非生物胁迫后释放到细胞外,从而被PEPR1/PEPR2 识别并结合[2,132]。在拟南芥中,过表达盐胁迫响应基因PROPEP3及Pep3 处理都可以引发拟南芥对盐胁迫的抗性,且二者都是通过受体蛋白PEPR1 发挥作用[133]。进一步的研究表明,过表达PEPR1和PEPR2的植株对盐胁迫的耐受性增强,表明在没有外源Pep 处理的情况下,内源性PEPR途径也能参与调控植物对盐胁迫的耐受性[134]。
几丁质受体CERK1 的表达受到盐胁迫诱导。cerk1突变体的耐盐性降低,其比野生型更容易受到NaCl 的影响。在NaCl 处理后,cerk1突变体的胞质Ca2+浓度增加,且CERK1 能够与Ca2+通道蛋白ANN1(ANNEXIN 1)相互作用,共同介导NaCl 诱导的Ca2+依赖的胞内信号。该结果表明,CERK1 可能参与盐胁迫损伤感知和信号传导[135]。
5 PRR 受体鉴定进展
上述各个发现较早的PRR 受体的功能,经过大量研究均取得了较大进展(表1)。研究人员在新的PRR 受体鉴定方面一直进行着不懈的努力。近年来,植物中新的PRR 受体的鉴定研究也取得了一些进展。

表1 植物模式识别受体Table 1 Plant pattern recognition receptors
植物PRRs 包括许多RLPs,但许多RLPs 的功能依然不明确。近期研究发现拟南芥RLP 蛋白RLP53 与PTI 有关。rlp53突变体对致病菌(包括真菌、卵菌和细菌)的易感性增强。RLP53 组成性地与SOBIR1 结合,并以病原体诱导的方式与共受体BAK1 相互作用。此外,糖基磷脂酰肌醇(GPI)锚定蛋白LLG1(LORELEI‑LIKE GPI‑ANCHORED PROTEIN1)与RLP53 相互作用,并介导RLP53 在质膜中的积累[136]。
在番茄中,MRK1(multiple resistance‑associated kinase 1)编码一种新的LRR‑RLK 型受体蛋白,其表达受温度胁迫和病原体攻击显著诱导。敲除MRK1降低了植株对冷胁迫和热胁迫的耐受性,并导致CBF1(C‑repeat binding factor 1)和HsfA1a(heat shock transcription factor a‑1a)的表达抑制[137]。
6 总结与展望
综合上述研究结果不难发现,研究者们在MAMPs/DAMPs 的细胞外受体识别和相应的免疫信号调节过程,以及PRRs 具体功能方面均取得了实质性进展。同时可以明确的是,一系列具有不同特征和功能的PRRs 及共受体在特异性的免疫识别中不可或缺,而且在胁迫损伤引起的PTI 中也发挥极为重要的作用。相比各种病原菌引发的PTI 机制研究,对植物如何适应有益或共生微生物,同时保持对致病微生物免疫力的机制仍然知之甚少。未来,应在植物识别有益和共生微生物并如何共存方面进行大力研究。同时,应进一步明确PTI 信号途径的核心调控因子的作用,阐明不同PRRs 介导的PTI的共性环节和差异性环节。有些PRRs 在植物中以多成员的家族形式出现,从数量上看,存在一定的冗余性。但目前仅对个别成员进行了研究,其他成员的具体功能及是否存在功能上的冗余有待进一步研究。目前,组学研究技术已经取得了长足的进步,未来应充分利用组学分析获得植物更多的PRRs 受体信息并进行鉴定,同时也要对免疫反应发生时胞内基因簇的变化进行探究,进一步丰富PTI 下游信号调控网络。迄今,植物受体识别的结构基础研究不是十分透彻,其相应的结合机制有待进一步研究。未来可借助结构生物学手段,进一步解析受体及配体的结构,明确受体识别的生物学机制。此外,面对日益恶化的生存环境,由胁迫引起的植物免疫应答机制也应该进行充分研究,这对深入理解植物适应环境并与环境因子互作的机制有重要意义。因此,未来应更加注重PRR 受体在抗病农作物种植资源创制方面的实际应用,借助基因工程手段进行抗病、抗逆相关品种的创制和选育,这对于植物适应环境和人类解决食物来源问题具有重大意义。