UBE2W过表达促进结肠炎小鼠结肠细胞的增殖
王少鑫,崔立红,李 辉,刘新尧,李晓伟,王晓辉
解放军总医院第六医学中心消化内科,北京100048
UBE2W是近年来新发现的一种泛素结合酶(E2),在泛素化修饰中发挥作用。本实验室前期研究发现细胞水平上UBE2W过表达后可以抑制TNF-α诱导的核因子κB(NF-κB)转录活性[1],而NF-κB是重要的核转录因子和调控通路,在各种生理或病理条件下会发生多种激酶翻译后修饰,如泛素化、磷酸化及SUMO化等[2-4],据此参与泛素化调节过程的UBE2W,可能通过对NFκB通路的调控,在炎症、免疫以及肿瘤等疾病过程中发挥重要作用[5-7]。目前,关于UBE2W的研究多集中于分子结构及蛋白相互作用方面,对于其具有的生物学功能,尤其炎症性疾病中可能发挥的作用未见有报道。
目前对于UBE2W在炎症性疾病中如何发挥作用知之甚少。本研究利用DSS诱导的结肠炎小鼠模型模拟炎症性肠病过程,观察过表达UBE2W对小鼠结肠炎症的影响,结果表明UBE2W可能通过促进结肠细胞的增殖,加快炎症状态下结肠粘膜的修复过程,有利于小鼠结肠炎症的恢复,对小鼠结肠具有保护作用,此研究发现对于炎症性肠病的病情评价和预后判断具有重要意义。
1 材料和方法
1.1 材料
1.1.1 实验动物 选取24只雄性C57BL/6小鼠,体质量20~22 g,6周龄,将所有小鼠均饲养于SPF级无菌环境中。动物建模实验在北京唯尚立德公司完成,所需试剂包括:DSS(MP),相对分子质量为36 000~50 000;体内转染所需腺病毒由上海泰儿图生物科技有限公司合成,分别为AAV2/9-CMV-bGI-EGFP-WPRE-pA和AAV2/9-CMV-bGI-Ube2w-myc-WPRE-pA。
1.1.2 试剂 实时荧光定量PCR(RT-PCR)需用的逆转录及PCR 扩增试剂盒(TaKaRa),实验中所需引物具体序列见表1,均由Invitrogen 公司合成。免疫印迹实验(Western blotting)需用抗体包括:UBE2W 抗体(1∶500;Thermo Fisher);α-Tubulin 抗 体(1∶2000;Sigma)。Myc抗体(1∶1000;Santa Cruz)。病理学免疫组化分析所需抗体:Ki67和BrdU(Sigma)。

表1 RT-PCR所需引物序列Tab.1 Primer sequences for real-time PCR analysis
1.1.3 实验细胞 人胚肾细胞293T 和结肠癌细胞HCT116以及转染所需质粒myc-vector 和myc-ube2w均来源于军事医学研究院国家生物医学中心。转染试剂为Lipofectamine 2000(Invitrogen)。CCK-8(Cell Counting Kit-8)试剂盒(Dojindo)。
1.2 方法
1.2.1 结肠炎动物模型鉴定 选用14只C57BL/6雄鼠,随机分成2组:一组给予2.5%DSS喂养5 d,后恢复正常饮水3 d(结肠炎组);另一组持续给予正常饮用水喂养8 d(正常组)。两组小鼠同时处死,建模过程中观察小鼠体质量变化,脱颈法处死小鼠后取两组小鼠结肠末端置于RNAlater中,并于-80 ℃冰箱保存。
在另一组实验中,任选同笼10只6周龄雄鼠,随机尾静脉注射腺病毒AAV2/9-CMV-bGI-Ube2w-myc-WPRE-pA或AAV2/9-CMV-bGI-EGFP-WPRE-pA,每只各100 μL(1×1011),即UBE2W过表达组小鼠和对照组小鼠各5 只。注射3 周后所有小鼠喂养5 d 2.5%DSS,再正常饮水4 d处死。在此过程中记录每天小鼠体质量情况,小鼠处死前4 h 掺入BrdU,即腹腔注入BrdU(100 mg/kg)。实验结束后取全结肠拍照、测定结肠长度,然后固定于10%福尔马林。
1.2.2 结肠炎症严重度评价 根据病理平片测量小鼠全结肠溃疡的数目与溃疡大小进行评分,最终结肠炎病理组织学评分为两者评分之和[8]。
1.2.3 RT-PCR检测 将小鼠结肠组织自冰箱中取出后放入预冷的研钵中研磨至粉末状,然后进行PCR常规操作流程,即提取总RNA、合成cDNA、反转录PCR,PCR循环条件为(95 ℃30 min、95 ℃5 s、60 ℃31 s),共为40个循环。
1.2.4 Western blotting 实验 首先进行蛋白样本的制备,具体过程为将冻存的结肠组织研磨呈粉末状,再经裂解液充分裂解、沸水变性等过程,以备Western blotting待用。将充分裂解处理后的组织样本按Western blotting操作流程依次进行SDS-PAGE电泳、PVDF膜转印、一抗和二抗封闭杂交,及显影过程。一抗分别为抗UBE2W兔多抗(1∶500),鼠抗Myc抗体(1∶1000),微管蛋白抗体(1∶2000)为内参。
1.2.5 病理组织学实验 HE染色按常规实验流程,包括结肠组织包埋,切片以及染色过程。免疫组织化学Ki67和BrDU染色过程为:将福尔马林保存的结肠组织取出后进行切片、二甲苯和酒精预处理、随后经H2O2孵育、抗原修复、Ki67和BrdU一抗和二抗孵育后DAB显色,最后苏木素染核、封片。
1.2.6 细胞增殖实验 将293T和HCT116细胞分别培养于含10%胎牛血清的DMEM培养基和RPMI 1640培养基中,培养箱条件为室温37 ℃,5%CO2。将细胞种于12孔板中,利用lipofectamine 2000每孔转染质粒mycvector或myc-ube2w(1.0 μg),转染24 h后消化细胞接种于96孔板中继续培养,在不同时间点24、48、72、96 h分别加入CCK-8试剂,孵育2 h,直至细胞呈紫色晶体,将孔板放入酶标仪中,检测吸光度值A450nm,记录后生成细胞生长曲线。
1.3 统计学分析
采用统计软件SPSS 17.0 分析,计量资料采用均数±标准差表示,组间比较行t检验;计数资料采用百分率表示,组间比较行卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 评价UBE2W在结肠炎组织中的表达水平
正常小鼠和结肠炎小鼠的结肠呈现明显不同组织学表现(图1A),结肠炎组小鼠其结肠长度较正常小鼠明显缩短,结肠表面完整性破坏,粘膜表明可见不同程度的粘膜脱落、溃疡形成,粘膜明显水肿增厚,在粘膜、甚至粘膜下层有大量炎性细胞浸润,符合结肠炎表现,病理组织学证实小鼠结肠炎模型构建成功。RT-PCR结果显示,结肠炎组中UBE2W的mRNA水平明显低于正常组(P<0.05,图1B),而Western blotting检测也呈现类似结果(P<0.05,图1C)。
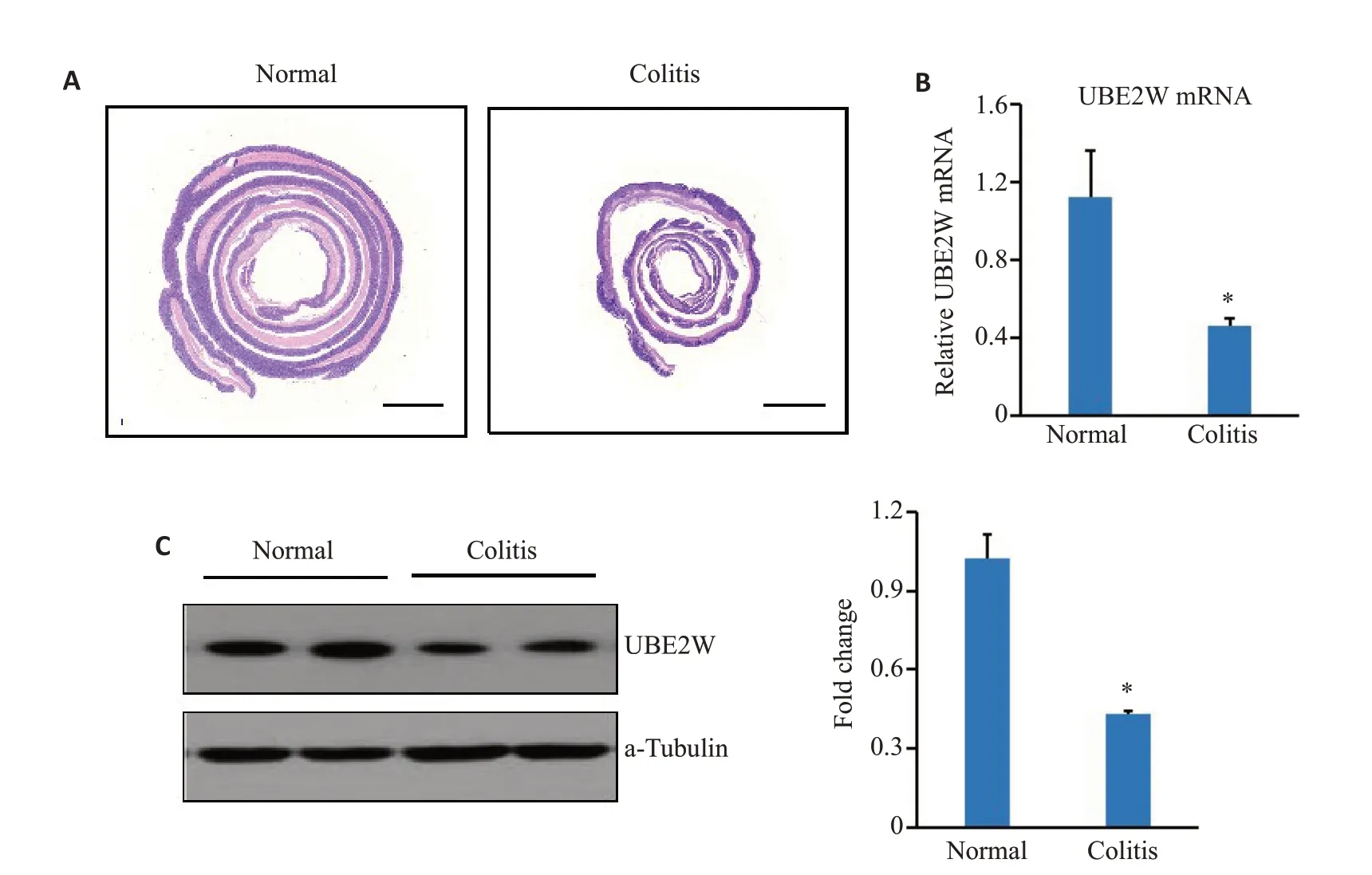
图1 UBE2W在结肠炎组织中表达减低Fig.1 UBE2W mRNA and protein expressions are decreased in mouse colitis tissue.A:Colon pathology in mice with DSS-induced colitis.B:UBE2W mRNA expression.C:UBE2W protein expression.*P<0.05 vs normal group.
2.2 UBE2W过表达能够减轻结肠炎小鼠体质量丢失和结肠缩短程度
Western blotting检测显示,腺病毒感染小鼠可稳定表达myc-UBE2W蛋白,模型构建成功(图2B)。UBE2W过表达组小鼠结肠炎过程中体质量丢失明显少于对照组(图2C),在第9天和第10天最为明显(P<0.05)。实验结束时测量小鼠全结肠长度,结果显示UBE2W过表达小鼠全结肠明显长于对照组(P<0.05,图2D)。
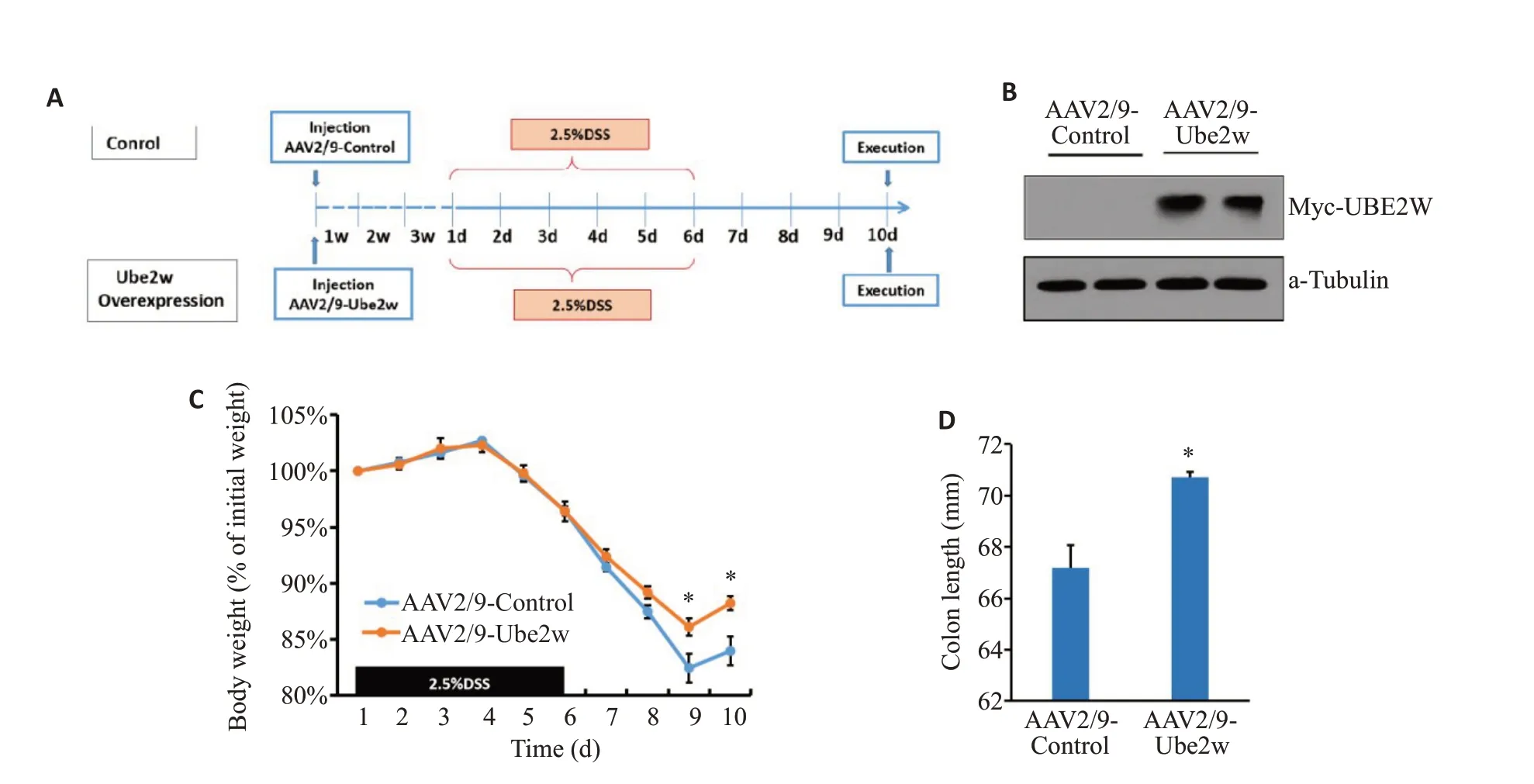
图2 过表达UBE2W减轻了小鼠的结肠炎症程度Fig.2 UBE2W overexpression decreases severity of colitis in mice.A: Establishment of mouse models of DSS-induced colitis.B:UBE2W protein expression.C:Body weight change of colitis mice.D:Colon length of colitis mice.*P<0.05 vs control group.
2.3 UBE2W 过表达减轻小鼠结肠炎的粘膜损伤
HE染色结果显示,在结肠炎恢复期两组小鼠粘膜损伤程度明显不同,UBE2W过表达组小鼠结肠粘膜溃疡数目及溃疡范围均较对照组明显减轻,粘膜层增厚不甚明显,结肠炎症程度评分少于对照组(P<0.05,图3)。

图3 UBE2W 过表达减轻了DSS诱导的结肠粘膜损伤Fig.3 UBE2W overexpression alleviates DSS-induced colonic mucosal damage in mice.A:HE staining.B:Histological scores in the two groups.*P<0.05 vs control.
2.4 在细胞水平,过表达UBE2W能够促进细胞增殖
293T细胞过表达Ube2w后在不同时间点吸光度值A450nm逐渐增加,在72 h和96 h时明显高于载体转染细胞,差异有统计学意义(P<0.05,图4),在HCT116细胞中亦呈现类似结果。
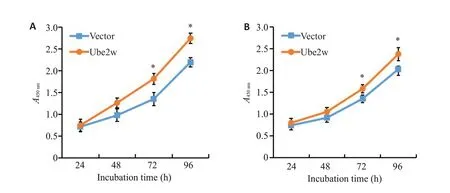
图4 细胞水平上UBE2W的过表达加速了细胞增殖Fig.4 UBE2W overexpression promotes proliferation of 293T cells (A) and HCT116 cells(B).Growth curve was drawn based on the absorbance of the cell culture.*P<0.05 vs Vector.
2.5 UBE2W过表达促进结肠炎小鼠细胞增殖
免疫组织化学检测结果显示,UBE2W过表达组小鼠结肠粘膜细胞Ki67 阳性细胞数明显高于对照组(87.4%vs74.4%),UBE2W 过表达小鼠结肠细胞中BrdU阳性细胞数也明显高于对照组(35%vs15.6%),差异均有统计学意义(P<0.05,图5)。
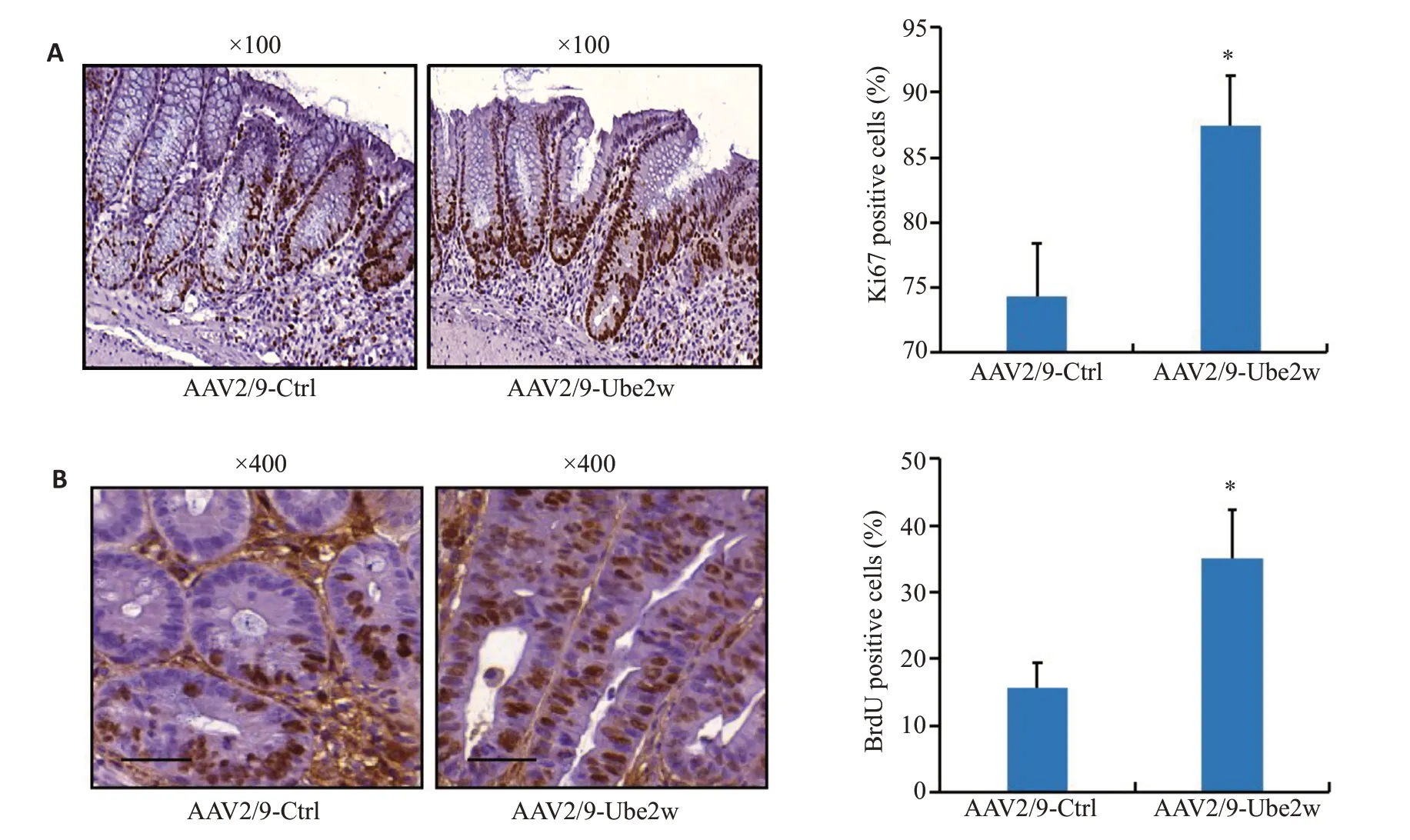
图5 过表达UBE2W促进了小鼠结肠细胞增殖Fig.5 Overexpression of UBE2W promotes colon mucosal cell proliferation in colitis mice.A: Ki67 staining and positive cells(%).B:BrdU staining and positive cells(%).*P<0.05 vs control.
3 讨论
NF-κB在感染等免疫应答中发挥关键作用。泛素化作为一种常见的蛋白质修饰形式,其活化过程参与了包括细胞增殖、凋亡、信号转导和炎症、免疫等几乎一切生命活动的调控过程[9-12]。UBE2W是在前期实验室对NF-κB相关泛素调节酶进行通量化筛选时偶然发现的一种新型E2合成酶[13]。目前研究发现UBE2W可以与ataxin-3协同作用调节泛素连接酶;与FANCL相互作用并调节Fanconi贫血蛋白FANCD2的单泛素化;还能够与TRIM5α相互作用锚定Lys63连接的泛素链并限制逆转录过程;UBE2W缺失则可以逆转Rnf4突变细胞对DNA损伤的超敏反应。但关于UBE2W在炎症中的作用仅限于本实验室的前期发现,UBE2W参与NF-κB转录活性的调节,低水平UBE2W还可能增加小鼠结肠炎易感性[14]。那么前期结果是否可以推测UBE2W就能够保护小鼠、减轻结肠炎症过程呢?为进一步验证此假设,本研究利用结肠炎小鼠模型,观察过表达UBE2W后小鼠的结肠炎症变化,并进行了病理组织学分析,探讨引起炎症变化的可能机制。
本研究采用腺病毒感染的方式,将UBE2W整合到小鼠体内建立小鼠体内UBE2W 过表达模型,并经Western blot验证成功,证实腺病毒感染可以在体内将外源转染的UBE2W稳定过表达,腺病毒转染可以作为建立体内动物模型的重要工具。在结肠炎症反应过程中,粘膜屏障功能破坏,如粘膜破损、炎症反应及粘膜上皮细胞的修复均被认为是炎症性肠病重要的病理生理基础。在结肠粘膜屏障功能破坏后,肠腔内细菌移位可产生反复的炎症反应,粘膜损伤后大量炎性产物、坏死物质覆着于破损粘膜表面,在恢复期时结肠炎症粘膜周围组织细胞会不断增殖、以修复破损粘膜。DSS诱导的结肠炎小鼠模型重塑了炎症性肠病的病理生理过程。本研究发现结肠炎小鼠的结肠组织中UBE2W表达减少,提示低水平UBE2W可能加重结肠炎,而UBE2W过表达小鼠在结肠炎恢复期时结肠粘膜破损明显减轻,此结果提示高水平UBE2W可能促进了结肠粘膜的恢复过程。但在此过程中,UBE2W如何保护结肠粘膜,从而减轻炎症反应,其中的机制尚不清楚。为探求可能的原因,本研究在细胞水平上检测了过表达Ube2w对细胞增殖的影响,发现过表达Ube2w能够加速细胞增殖,而且在小鼠结肠组织中增殖相关抗原Ki67及掺入处于增殖状态的BrdU阳性细胞数亦明显高于对照组,因此本研究细胞和动物水平均证实高水平UBE2W能通过加速细胞增殖,进而促进了结肠炎症的恢复。这一结果也提示UBE2W减轻了小鼠结肠炎症,可能成为一种炎症性肠病的病情评价和判断预后的新型标志物。
目前,关于慢性炎症与肿瘤相关已逐渐被研究证实,在多种因素共同作用下通过转录因子途径、可溶性介质(化学因子、细胞因子)和肿瘤组成部分(如肿瘤相关巨噬细胞)调控炎症反应,持续炎症反应又可能增加基因不稳定,导致肿瘤的发生[15]。本研究结果表明UBE2W能够加速结肠细胞增殖、促进炎症恢复,对炎症性肠病的病情评价具有重要意义,但关于其促进细胞增殖的相关机制尚未明确,有报道结肠炎过程中可通过诸多通路如Notch通路、ERK通路、STAT3相关通路、NF-kB通路以及Wnt通路等参与细胞增殖的调控[16-20],肠道菌群失调、免疫细胞功能不稳定也可能通过影响细胞增殖在结肠炎进展中发挥作用。尽管现尚无资料证实UBE2W在结肠炎和正常人结肠组织中表达存在差异,但有研究表明,克罗恩病(CD)患者中高表达的miRNA与转录后修饰酶之间存在相互作用,可能解释了CD发病的部分机制,其中hsa-miR-181d的高表达下调了UBE2W mRNA水平[21],而hsa-miR-181d已被证明参与TGF诱导的上皮细胞向间充质转化、癌细胞迁移、癌变和转移,且在结肠癌中高表达[22,23]。TGF-beta作为一种由肠上皮细胞和粘膜T细胞分泌的调节细胞因子,可通过促进分泌性免疫球蛋白A(IgA)产生,增强肠道免疫屏障,发挥抗炎和黏膜保护作用。因此,推测UBE2W可能通过miRNAs介导调控TGF-β信号通路在炎症性肠病甚至癌变中发挥作用,hsa-miR-181d参与ube2w转录后水平的调控,进而影响蛋白质表达水平,使UBE2W作为泛素调节网络成员参与IBD发生过程。目前尚未有关于UBE2W在人结肠炎和结肠癌中的临床报道,也为进一步的深入研究提供了线索和思路。
结合最新研究报道,UBE2W作为一种DNA损伤修复中至关重要的蛋白质编码基因,高表达UBE2W可能促进了乳腺癌肿瘤细胞浸润和转移[24];而UBE2W的下调能够促进细胞凋亡及精子形成减少[25];且可能作为关键基因参与青春期重度抑郁症的分子调节[26]。这些新发现均提示UBE2W在参与炎症反应过程外,在肿瘤和自身免疫性疾病中也发挥作用。至于在炎症诱导肿瘤中UBE2W如何发挥作用,是否加速了结肠恶性肿瘤的进展,还有待进一步证实。

