PML/RARa 阳性APL 缓解后继发PML/RARa 阴性AML 1 例报道
柴国静 南英博 赵海利 马香书 赵 鹏 李金丫
(河北省人民医院检验科 河北省分子医学重点实验室 河北省医学检验临床医学研究中心,河北 石家庄 050000)
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)作为急性粒细胞白血病中的特殊类型,发病凶险,常常并发弥散性血管内凝血,大部分患者通过早期诊断,予以亚砷酸和全反式维A酸(all-trans retinoic acid,ATRA)治疗可完全缓解,核型恢复正常,但仍有5%~30%的患者在完全缓解后复发[1]。多数APL患者在完全缓解后2~5年内复发[2],复发时一般t( 15;17)会再次出现,而部分患者核型会发生变化。现报道1例PML/RARα阳性的AML患者缓解3年后,复发成PML/RARα阴性急性髓系白血病(acute myeloid leukemia,AML)伴t(11:19)的病例。
1 病例介绍
患者,女,26岁,因双下肢淤癍、牙龈出血5 d于2019年4月5日第1次入院。血常规示:白细胞计数2.31×109/L,中性粒细胞计数0.96×109/L,血红蛋白77 g/L,血小板计数18×109/L。骨髓穿刺示:粒系比例明显增高,以异常早幼粒细胞为主(91.5%),见图1。血象示:异常早幼粒细胞易见(36.0%),形态同骨髓。白血病融合基因筛查示:PML/RARα阳性。荧光原位杂交:PML/RARα融合基因阳性,免疫分型结果符合AML免疫表型。
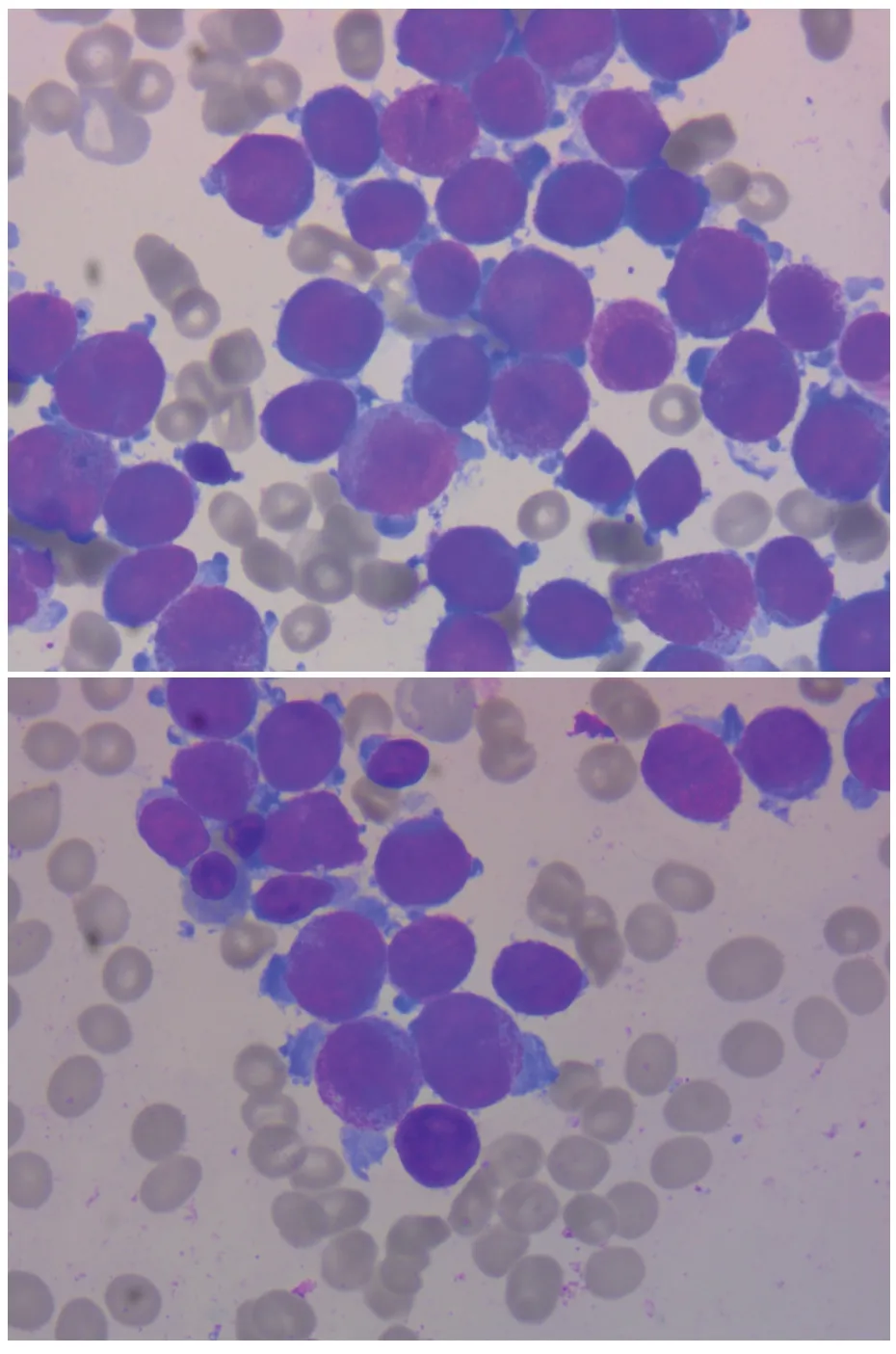
图1 初诊时骨髓涂片异常早幼粒细胞(瑞-吉染色,×1 000)
骨髓病理学检查示:骨髓增生活跃(90.0%),细胞成分单一,局部细胞幼稚,核淡染,有小核仁,考虑AML,MPN-白血病基因突变筛查检测到FLT3-ITDins≈65 bp基因位点插入突变。综上,诊断为:APL(中危),后给予维A酸联合三氧化二砷诱导治疗,间断输注冷沉淀补充纤维蛋白原,输注红细胞改善贫血,输注血小板防止出血。2019年5月6日复查骨髓象示:原始粒细胞0.5%,早幼粒细胞0.5%,提示骨髓完全缓解;2019年5月23日骨髓象示:早幼粒细胞2%,PML/RARα融合基因阴性,各项检验未见异常。后规律给予吡柔比星联合阿糖胞苷治疗方案。2019月6月24日—2021年6月18日,患者无明显不适,骨髓穿刺结果未见异常。
2022年5月,患者无明显诱因出现乏力,伴活动后心慌、头晕,2022年5月21日查血常规示:白细胞计数11.7×109/L,中性粒细胞计数2.7×109/L,血红蛋白65 g/L,血小板计数33×109/L。
2022年5月23日行骨髓穿刺术,骨髓图像检查示:1)取材、涂片、染色良好,粒(+),油(+);2)骨髓增生明显活跃,粒系65%,红系1.5%;3)粒系比例正常,原始粒细胞较多见(约占14.5%),过氧化物酶染色呈阳性(阳性反应物呈粗颗粒聚集状,图2、图3),早幼粒细胞比例增高,多数形态未见明显异常,偶见早幼粒细胞核分叶状;4)红系受抑,成熟红细胞大小不一;5)淋巴细胞比例减低,为成熟淋巴细胞;6)单核细胞比例增高,原幼单核细胞多见(约占22%)。过氧化物酶染色呈阴性或弱阳性(图3);7)血小板少见,低倍镜下全片可见巨核细胞3个,油镜下可见淋巴样小巨核细胞。
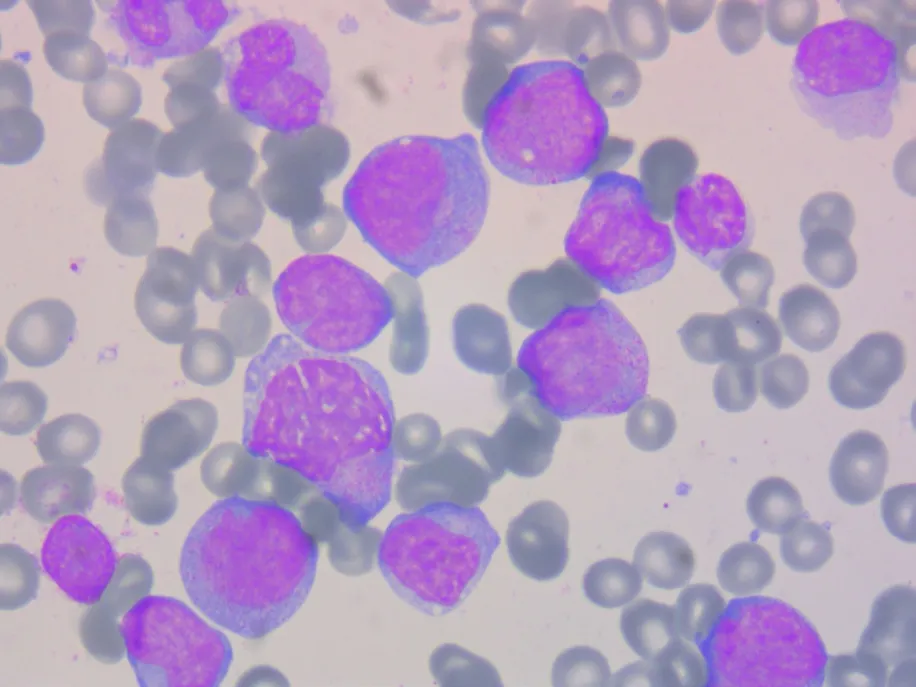
图2 复发时骨髓涂片原始细胞(瑞-吉染色,×1 000)
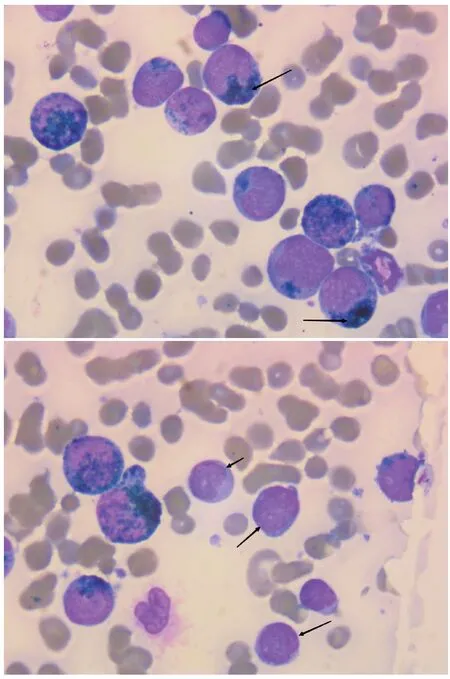
图3 复发时骨髓涂片原始细胞(过氧化物酶染色,×1 000)
将患者骨髓送二代基因测序和染色体检查。染色体检查结果显示,20个细胞中有20个为t( 11;19)(q23.3,p13.1),可见克隆性异常。43种融合基因筛查结果显示,MLL-ELL阳性,PML/RARα阴性。
2 讨论
APL是一种急性非淋巴细胞白血病,与弥散性血管内凝血有关,患者及时治疗后,生存期很长。然而,有研究结果显示,大多数单用ATRA伴或不伴化疗的患者会复发;单用三氧化二砷治愈率较高(约65%)[3-5]。APL有特定的细胞形态和细胞遗传学特征,90%的患者可检出t( 15;17)异常,该易位形成PML/RARα融合基因,这是APL高度特异性的细胞遗传学特征[6]。大多数患者经过治疗后可完全缓解,核型恢复正常,但也有部分患者出现缓解后复发,复发时,一般t( 15;17)会再次出现,但也有患者复发时核型会发生变化。已有病例报道显示,t( 15;17)粗颗粒状M3型APL在复发时发展为t( 3;6)无t( 15;17)的M3型[7],t( 15;17)的APL复发后核型演变成ins( 17;15)[8],t( 15;17)的APL患者治疗后继发AML部分分化型,出现t( 8;21)(q22;q22)染色体异常和NRAS基因突变[9]。
从骨髓形态上分析,APL患者出现缓解后复发,一般骨髓象仍然以异常早幼粒细胞为主,过氧化物酶染色呈阳性。但本病例复发时原始细胞形态有所改变,未发现典型的粗颗粒异常早幼粒细胞,检出胞核较规则,胞质颗粒较细小的原始细胞,过氧化物酶染色部分呈阳性,部分阴性或弱阳性,结合细胞形态学和细胞化学染色综合分析,原始细胞部分为原始粒细胞,部分为原幼单核细胞。分子生物学PML/RARα融合基因阴性,出现新的染色体易位t( 11;19),而原来的t( 15;17)未检出,以往未见报道,患者预后较差,故临床建议患者行骨髓移植。
APL缓解后复发的危险因素包括高白细胞(白细胞>10 000个/μL),FLT3-ITD基因突变,年龄>55岁,存在PML/RARAbcr3异构体(M3V)[10]。有34%~45%的APL患者会发生FLT3突变,该突变是患者复发和影响长期生存率的危险因素[11]。本例患者存在FLT3-ITD基因突变,预后3年后复发。
染色体易位的MLL-ELL基因,t( 11;19)(q23.3,p13.1),常见于AML,伴MLL融合基因的AML在形态和免疫分型上通常为急性粒单核细胞白血病或急性单核细胞白血病[12]。本例患者在缓解后复发,出现了新的基因突变,但初诊时未检测到。原始细胞形态也发生了改变,原始细胞核形较规则,没有异常早幼粒细胞扭曲、折叠状态,呈分瓣样。结合细胞化学染色发现部分为原始粒细胞,部分为原始幼稚单核细胞,符合急性粒单细胞白血病形态,与文献[12]报道相符。
本病例缓解后继发另外一种类型的AML,可能有以下几个原因:1)化疗药物诱导的继发性白血病;2)白血病细胞起源与能分化为APL和非M3型AML的共同干细胞,开始以APL形式出现,复发则以另外一群原始细胞,即非M3型AML出现;3)同一患者3年中发生2种不同类型的白血病,纯属偶然。这个现象的出现还需要进一步临床病例的积累和研究。

