MRI 在椎体骨质疏松和转移瘤压缩性骨折诊断中的应用价值
李 雪
(高邮市人民医院放射科 江苏 扬州 225600)
椎体为脊柱主要受力结构,多为松质骨,皮质为薄壳样结构,强度低。椎体中部上下、终板附近应力集中现象明显,在压缩负荷下,如压力不均、前缘应力降低,则容易发生骨折[1]。本病发生原因复杂,常见如脊柱外伤、骨质疏松、骨转移瘤等[2]。近年来,随着人口老龄化进程加快,本病发生率不断上升。对脊柱压缩性骨折早期明确诊断,可为后期治疗工作开展提供可靠依据,但不同类型压缩骨折临床表现近似,根据临床表现难以明确诊断,误诊风险很高[3-4]。近年来,影像学检查在椎体骨折诊断中已经有了较多应用,MRI 则为常用方法,软组织分辨率高,尤其MRI 弥散加权成像(DWI)的应用,能进一步明确受累节段的信号特征[5-6]。该次研究选择高邮市人民医院2020 年1 月—2022 年12 月收治椎体压缩性骨折患者102 例,就骨质疏松与转移瘤性压缩骨折的MRI 影像学特征进行了对比分析,报道如下。
1 资料与方法
1.1 一般资料
选取高邮市人民医院2020 年1 月—2022 年12 月收治的脊柱椎体骨质疏松压缩性骨折患者58 例(对照组)与转移瘤压缩性骨折患者44例(观察组)。对照组中男23例,女35 例;年龄51 ~89 岁,平均年龄(64.38±7.10)岁;累及椎体72 个。观察组中男20 例,女24 例;年龄48 ~91 岁,平均年龄(65.17±6.94)岁;累及椎体59 个。两组基础资料差异无统计学意义(P>0.05),有可比性。研究符合《赫尔辛基宣言》中的伦理准则。
纳入标准:①满足椎体骨质疏松性或转移瘤压缩性骨折诊断标准[7-8];②均进行MRI 检查;③临床资料完整;④患者均知情同意。排除标准:①未获得明确诊断者;②其他类型骨折者;③脊柱外伤者;④图像质量差者;⑤造影剂过敏者。根据疾病类型差异分组。
1.2 方法
所有患者均采用飞利浦1.5T MRI 检查。检查前摘除金属异物,仰卧于扫描床上,先常规进行T1WI、T2WI矢状位与T2WI 横断位扫描。参数设定:TR 4 000 ms,TE 116 ms,层厚5 mm,视野25 ~30 cm。经患者肘静脉注射对比剂,开展T1WI 矢状、横断、冠状位增强扫描,DWI 予单次激发SE-EPI 序列,层厚、层距分别为7.0 mm、1 mm,TR 1 700 ms,TE 81 ms。配合呼吸导航回波、心电门控扫描,弥散系数控制为300 s/mm2。对扫描图像传输至工作中,计算机重建表观弥散系数(apparent diffusion coefficient, ADC)图,测量病灶位置ADC 值。
1.3 观察指标
①两组椎体与椎体后缘形态比较:椎体形态及判断标准如下,楔形,椎体后缘较前缘高;凹陷形,前后缘高度相当,中间变小;扁平形,前后缘与中部高度相当,椎体前后径变大;倒楔形,前缘高度较后缘高。椎体后缘形态及判断标准:成角,椎体后凸>50°;膨隆,椎体皮质后部弧形后凸压迫硬膜囊;膨大,存在明显膨大改变。②两组椎弓根及椎体信号比较:对比椎弓根T1WI低信号率、破坏率,并对比椎体T1WI 低信号、T2WI 高信号与DWI 低、高信号率。③两组椎管软组织比较:对比结节肿块率与环形增厚率。④两组ADC 值比较:根据ADC 图测量病灶位置ADC 值。
1.4 统计学方法
采用SPSS 21.0 统计软件处理数据,符合正态分布的计量资料以均数±标准差(± s)表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组椎体与椎体后缘形态比较
观察组椎体楔形、凹陷形率低于对照组,扁平形、倒楔形率高于对照组(P<0.05);椎体后缘成角率低于对照组,膨隆率、膨大率高于对照组(P<0.05),见表1。
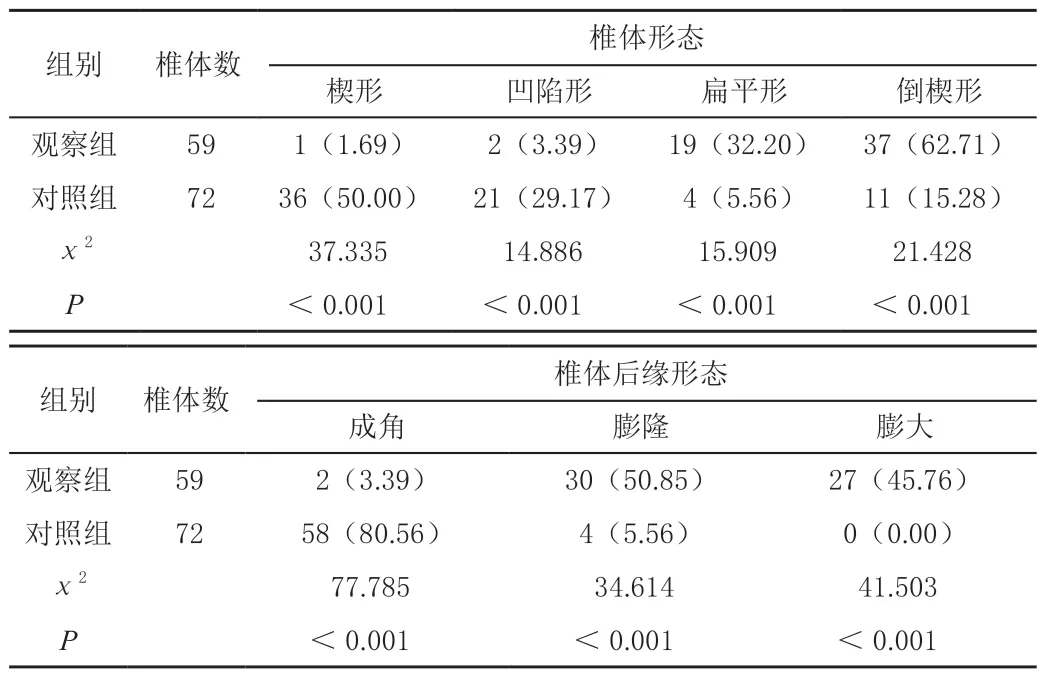
表1 两组椎体与椎体后缘形态比较[n(%)]
2.2 两组椎弓根及椎体信号比较
观察组椎弓根T1WI 低信号率、破坏率高于对照组(P<0.05);椎体T1WI 低信号、T2WI 高信号率及DWI 高信号率高于对照组(P<0.05);DWI 低信号率低于对照组(P<0.05),见表2。
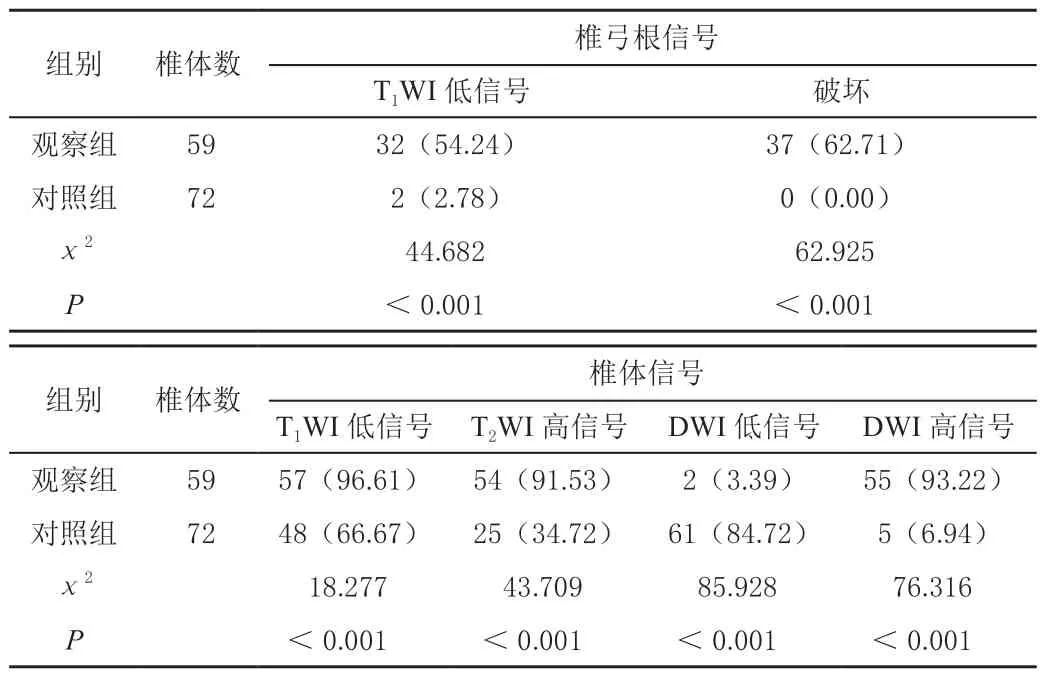
表2 两组椎弓根及椎体信号比较[n(%)]
2.3 两组椎管软组织比较
观察组椎管软组织结节肿块率、环形增厚率均高于对照组(P<0.05),见表3。

表3 两组椎管软组织比较[n(%)]
2.4 两组ADC 值比较
观察组ADC 值为(1.35±0.42)mm2/s,显著低于对照组的(2.17±0.58)mm2/s(t= 9.080,P<0.001)。
3 讨论
椎体压缩性骨折为临床常见骨折类型,发病率高,好发于老年人群,女性发病率略高于男性。椎体压缩性骨折常见骨质疏松性与转移瘤性[9]。其中骨质疏松患者因椎体骨量降低,在外力作用下,椎体压缩变形、重建,可出现骨折线及骨髓水肿[10]。转移瘤因肿瘤不规则、浸润生长,可造成局部轻度膨隆,骨皮质与骨小梁均会出现局限性吸收,进而造成椎体压缩,肿瘤突破骨皮质后,可产生软组织肿块[11]。脊柱椎体骨质疏松或发生转移瘤时,骨内病理变化存在差异,故而发生压缩性骨折后,影像学表现也存在差异[12]。MRI 为临床常用影像学检查方法,目前在压缩性骨折诊断中已经有了一定应用,其对细微骨折检出率高,软组织分辨率高,能有效检出椎体骨折。
骨质疏松压缩性骨折发生后,椎间盘受到压迫,并膨入疏松椎体上缘,另因椎体前后缘皮质和椎间小关节影响,椎间盘椎体中部膨入现象明显,临床常见楔形、凹陷型,椎体前后上下角较突出,椎体后缘多成角[13-14]。而转移瘤压缩性骨折,因椎静脉解剖,椎体多从后部分开始破坏,常见倒楔形,随着病情进展,整体椎体可出现塌陷,进而发生扁平改变。而转移瘤可造成骨小梁、皮质等破坏,故而可出现膨胀性生长特征[15]。本次研究中,观察组椎体楔形、凹陷形率低于对照组,扁平形、倒楔形率高于对照组;椎体后缘成角率低于对照组,膨隆率、膨大率高于对照组(P<0.05),该次结果证实,在形态上,骨质疏松性骨折常见楔形、凹陷形,最后成角率高;转移瘤性骨折常见扁平形、倒楔形,椎后膨大明显。
椎体骨质疏松患者在长期重力影响之下,多个椎间盘可发生压缩变形,在损伤较轻微时,椎体信号普遍正常,且一致性较好。而在外力作用下发生压缩性骨折后,可出现骨折线、骨折水肿等。外力轻微时,椎体内损伤范围局限、移位不明显,骨折线不严重,周围水肿局限,较少出现全椎体的信号异常[16]。而转移瘤性压缩骨折为肿瘤导致,骨折破坏较大时,即可发生压缩骨折,肿瘤病灶及骨折线周围多伴水肿,信号异常问题较为普遍,尤其以T1WI 低信号最为常见[17]。转移瘤患者除T1WI 低信号外,T2WI 为高信号,信号不均,扫描存在不均匀强化,累及椎体周围软组织肿块伴明显强化。本次观察组椎弓根T1WI 低信号率、破坏率高于对照组;椎体T1WI 低信号、T2WI 高信号率及DWI 高信号率高于对照组;DWI 低信号率低于对照组(P<0.05),也说明骨质疏松与转移瘤压缩骨折MRI 信号特征存在显著差异。
骨质疏松压缩性骨折患者临床常见椎弓根信号异常以及软组织肿块。而转移瘤性压缩骨折患者椎体后肿瘤侵入性生长,很容易侵入相连的椎弓根,损害皮质后,可侵入周围软组织,形成肿块。椎体、附件交界区域可形成明显组织肿块,而随着病情进展,容易出现环形增厚。MRI 检查软组织分辨率高,故而能较好识别软组织病变。本次研究中,观察组椎管软组织结节肿块率、环形增厚率均高于对照组(P<0.05),则说明转移瘤性压缩骨折椎弓根长伴结节性肿块或环形增厚软组织。陈运奎等[18]研究中,转移瘤性压缩骨折结节肿块率与环形增厚率均高于骨质疏松性压缩骨折(P<0.05),也佐证了本次研究结论。骨转移瘤患者因肿瘤细胞浸润侵袭细胞间质与骨髓内,可明显阻碍水分子的自由运动,扩散速度将明显降低,ADC 值可明显降低。本次研究中,观察组ADC 值(1.35±0.42)mm2/s 低于对照组的(2.17±0.58)mm2/s(P<0.05),则说明骨转移瘤患者ADC 值明显升高。
综上所述,对骨质疏松和转移瘤压缩性骨折予MRI检查能有效识别椎体与椎体后缘形态、椎弓根及椎体信号、椎管软组织特征的差异,配合ADC 值可辅助临床鉴别诊断。

