Fe3+ 浓度对全钒液流储能装置电解液电化学性能的影响研究
李 伟
(中国特种设备检测研究院 北京 100029)
“十四五”时期是我国实现“3060”双碳目标的关键时期,我国正在积极有序地推进碳达峰碳中和,加快构建新型能源体系。而新型储能作为大规模发展新能源的重要支撑基础,能够帮助解决能源系统中的能源转换、电力调节等问题,提高新能源的可靠性和经济性,正逐步成为我国实现能源转型、推动经济发展的战略性新兴产业[1]。
作为一种新型电化学储能技术,全钒液流电池因为其安全性高、使用寿命长、电解液可循环利用、环境污染低等特点,是较为适合用于大规模能源储存的商业化液流电池,在可再生能源储能并网、偏远地区供电、需求侧管理和微电网方面均有广泛应用[2-4]。其主要通过储存在正极电解液(VO2+/VO2+)和负极液(V3+/V2+)中不同价态钒离子的相互转化实现能量存储和释放,电解液既是电池的活性物质又是储能物质,因此电解液的电化学行为对电池性能具有决定性影响[5-7]。由于目前全钒液流电池电解液主要通过还原钢铁冶炼中间产物V2O5获得,因此常含有Fe3+、Cr3+、Mn2+等少量杂质离子。黄斐[7-8]等已经研究了Cr3+和Mn2+等对全钒液流电池正极电解液电化学性能的影响,但尚未发现关于Fe3+影响的相关研究。
本文利用循环伏安和电化学阻抗技术对含有不同Fe3+浓度正极电解液的电化学性能进行了研究,探讨了Fe3+浓度对全钒液流电池正极电解液电化学特征的影响。
1 实验
1.1 电解液和电极预处理
VOSO4-H2SO4溶液利用VOSO4、分析纯浓硫酸和去离子水配制,其中VO2+浓度为1.0 mol·L-1,硫酸浓度为3 mol·L-1,将分析纯Fe2(SO4)3添加到上述基本溶液,得到含有不同Fe3+浓度的测试溶液,其中Fe3+含量分别为0 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1、400 mg·L-1和600 mg·L-1。工作电极采用石墨电极,工作面积为圆形,直径为0.6 cm,测试前用2000#砂纸打磨至表面光滑,清洗后放置于去离子水中超声波清洗30 min 后取出,干燥后使用。
1.2 电化学性能测试
电化学性能测试采用三电极体系,其中工作电极为上述石墨电极;辅助电极为铂电极,面积4 cm2;参比电极为饱和甘汞电极(SCE)(文中电位没有说明均相对于SCE)。CV 电压范围为0.2 ~1.2 V,扫描速率依次为0.005,0.010,0.020,0.040,0.060,0.080和0.100 V.s-1。EIS 的交流扰动信号为10 mV,测试频率范围为10 mHz ~100 kHz。
2 结果与讨论
2.1 循环伏安曲线分析
图1 展示了在0.100 V·s-1扫描速率下,含不同Fe3+浓度的VOSO4正极电解液的循环伏安曲线,形状均类似,一对氧化还原峰非常明显,氧化还原峰电流密度与Fe3+浓度变化呈现一定规律性,说明Fe3+的添加能够影响电极反应过程。
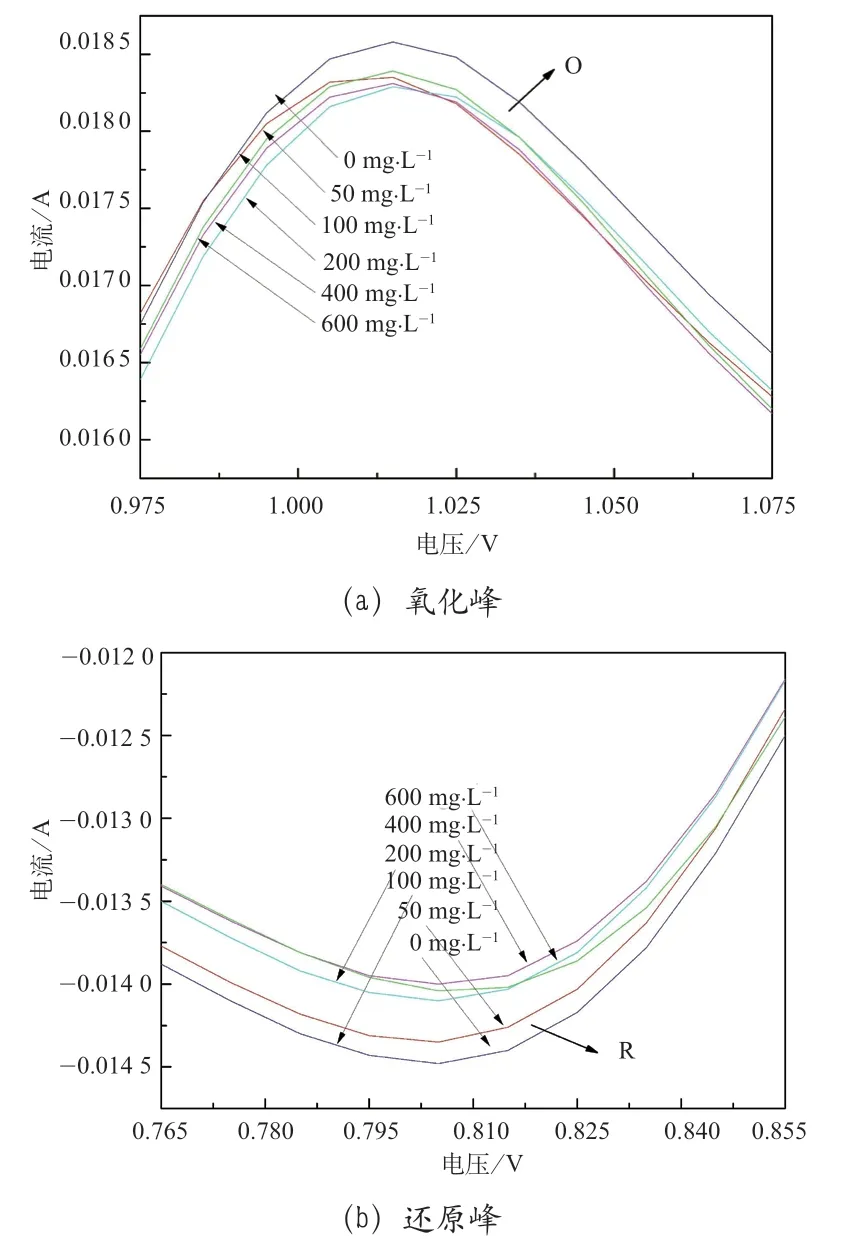
图1 0.100 V·s-1 扫描速率下的循环伏安曲线
1.0 V 左右的氧化峰对应的反应为VO2+氧化成VO2+,见式(1):
0.8 V 左右的还原峰对应的反应为VO2+还原为VO2+,见式(2):
将不同扫描速率下的氧化峰(IpO)与还原峰(IpR)的峰值电流密度及其比值总结如图2 所示,用以研究Fe3+浓度与反应可逆性之间的关系。
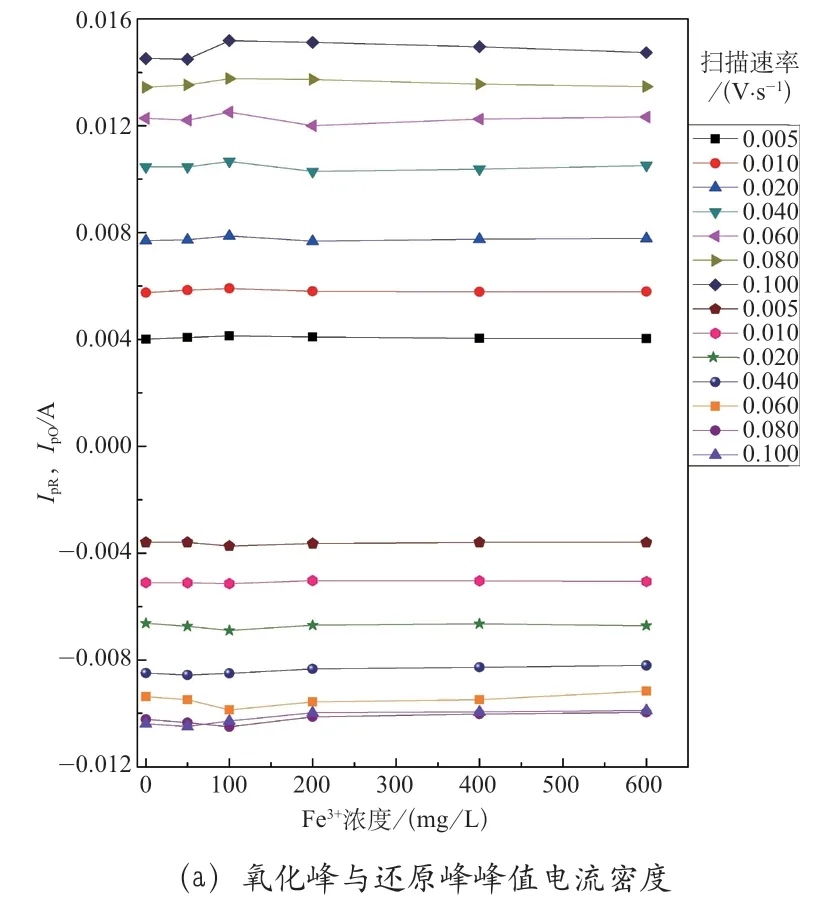
图2 Fe3+浓度对不同扫描速率下氧化峰与还原峰的峰值电流密度及其比值的影响
总体来说,不同扫描速率下的峰值电流密度的绝对值随着Fe3+浓度的增大,都具有相似的变化趋势。当Fe3+浓度从0 增大至50 ~100mg·L-1时,峰值电流密度的绝对值有所提高,提高幅度为2%~3%,当Fe3+浓度从100 mg·L-1增大到600mg·L-1时,峰值电流密度又逐渐减小,最大减小幅度为Fe3+浓度为0 时峰值电流密度的3.52%。实验结果表明,浓度为50 ~100 mg·L-1时,Fe3+可以促进VO2+/VO2+电对的反应活性,随着Fe3+浓度的继续增大,这种促进作用逐渐受到抑制,逐渐降低VO2+/VO2+电对的反应能力。另外,随着Fe3+浓度增大,氧化峰与还原峰的峰值电流的比值呈现先减小后增大的趋势,在Fe3+浓度为50 ~100 mg·L-1时,氧化峰与还原峰的峰值电流的比值更接近1,表明浓度为50 ~100 mg·L-1时,Fe3+可以促进VO2+/VO2+氧化还原反应的可逆性和电池效率。
图3 为Fe3+浓度为50 mg·L-1时正极电解液在不同扫描速率下的循环伏安曲线。随着扫描速率的增大,峰值电流也逐渐增大,但是氧化还原峰的曲线形状较为对称,氧化还原峰的电位差最小为110 mV,在60 ~200 mV 之间,说明在石墨电极上VO2+/VO2+电对的反应为准可逆过程[6-10]。理论上,准可逆反应的扩散系数D介于可逆反应(D1)与不可逆反应(D2)之间。根据实验结果,D1和D2可以分别由式(3)和式(4)计算[6-8]:

图3 Fe3+浓度为50 mg.L-1 时正极电解液在不同扫描速率下的循环伏安曲线
式中:
Ip——氧化还原峰峰值电流密度,A;
n——电子转移个数;
A——工作电极面积,cm2;
D——扩散系数,cm2·s-1;
α——传递系数;
Co——电解液浓度,mol·mL-1;
v——扫描速率,V·s-1。
结合实验条件和前期实验结果,式(3)和式(4)可以变换为:
式中:
k——氧化还原峰峰值电流对扫描速率平方根的直线斜率,由二者线性回归得到,只与峰值电流密度和扫描速率相关。
图4 为在含不同Fe3+浓度正极电解液的循环伏安曲线中氧化峰峰值电流与扫描速率的关系,由图4 发现峰值电流与扫描速率的平方根呈线性关系;Fe3+浓度与回归直线斜率k的关系如图5 所示,随着Fe3+浓度的增大,k值先减小后增大。
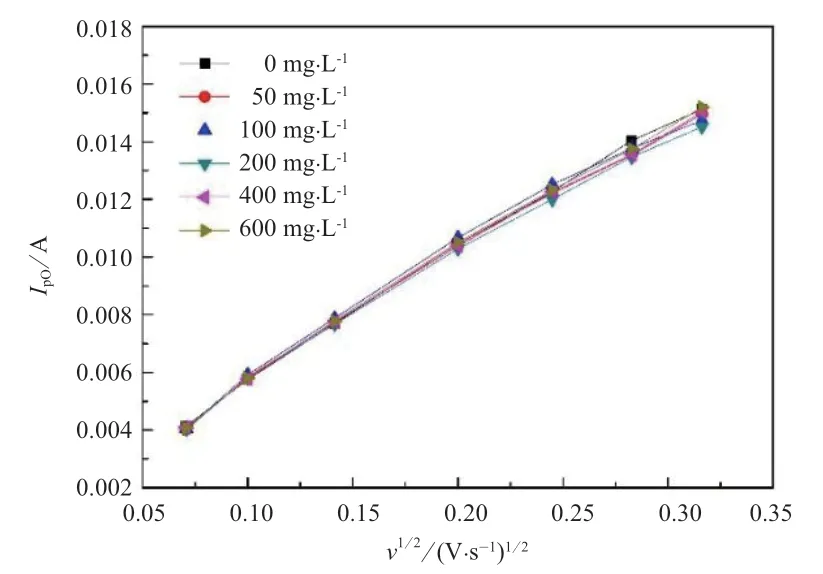
图4 不同浓度Fe3+正极电解液的循环伏安曲线中氧化峰峰值电流与扫描速率的关系
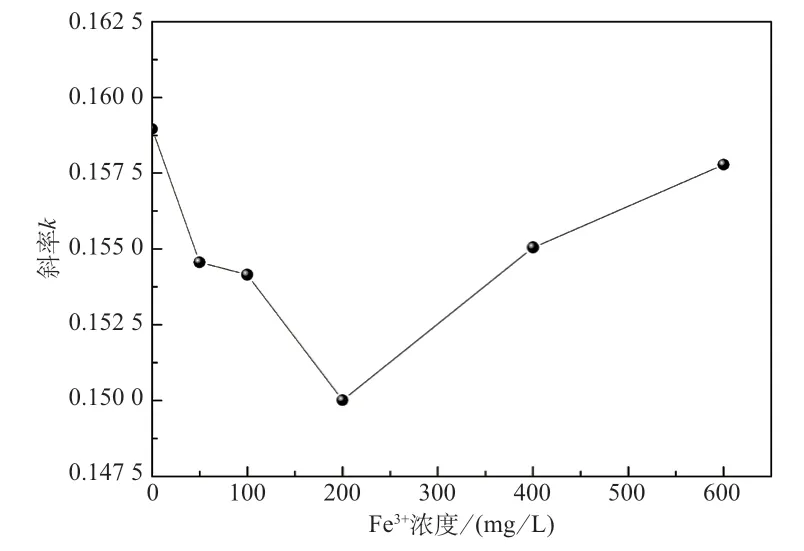
图5 Fe3+浓度与回归直线斜率k 的关系
由于D1和D2与k值具有如式(7)和式(8)的关系,表明在不同Fe3+浓度正极电解液中的钒离子扩散系数也随Fe3+浓度先减小后增大。
由式(7)和式(8)计算的D1和D2见表1,当Fe3+浓度由0 增大至200 mg·L-1时,扩散系数D1由3.49×10-7cm2·s-1减小到3.11×10-7cm2·s-1,D2由4.95×10-7cm2·s-1减小到4.42×10-7cm2·s-1,较参照溶液中分别下降了5%、11%;随后随着Fe3+浓度的增大,扩散系数逐渐增大。
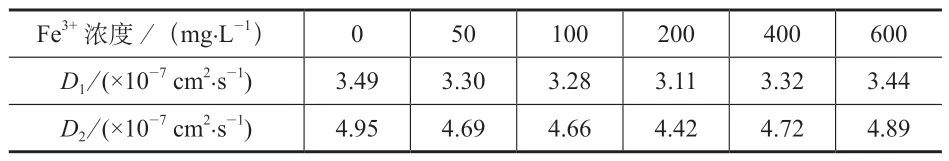
表1 Fe3+浓度对钒离子扩散系数D1 和 D2 的影响
2.2 电化学阻抗谱分析
采用电化学阻抗谱方法对Fe3+浓度在正极电解液电极反应过程中的影响开展进一步研究,Nyquist 曲线如图6 所示,阻抗谱由高中频区的半圆弧和低频区的斜线组成,其中Zre为Warburg 阻抗的实部,Zim为Warburg 阻抗的虚部。随着Fe3+浓度增大,半圆弧与斜线之间的过渡区逐渐变得不明显。半圆弧位于高中频区,对应着溶液、界面和电极反应阻抗,斜线位于低频区,对应着钒离子扩散的Warburg 阻抗。图7 为等效电路,其中溶液欧姆阻抗用Rs表示,界面阻抗用Ri表示,电荷转移阻抗用Rct表示,钒离子的Warburg阻抗用W表示。界面容抗由常相位角原件(Constant Phase Element,CPE)替代。
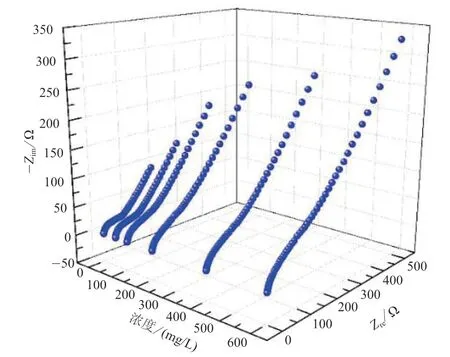
图6 Fe3+浓度对正极电解液电化学阻抗谱的影响

图7 电化学阻抗谱模拟等效电路
图8 为利用如图7 所示的等效电路对电化学阻抗谱的拟合结果与实验值的对比,发现计算值与实验值重合度良好,表明该等效电路能够很好地反映在电极表面发生的电化学反应。图9 为利用ZSimpWin 软件模拟计算的等效电路各参数的结果,发现Rs随着Fe3+浓度的增加变化不大;Fe3+浓度增大到50 mg·L-1时,界面电阻Ri明显减小,当Fe3+浓度超过100 mg·L-1,又会随Fe3+浓度的增大逐渐增大;Rct在Fe3+浓度大于100 mg·L-1时显著增大,当Fe3+浓度达到600 mg·L-1时,Rct增大到参照电解液中的Rct的250%左右;W随Fe3+浓度的增大而先增大后减小,当Fe3+浓度小于100 mg·L-1时W随Fe3+浓度的增大而增大,随后又逐渐减小。根据EIS 参数的变化,发现当Fe3+浓度小于100 mg·L-1时,能够减小界面电阻、电荷转移电阻,从而提高电化学反应的活性;而当Fe3+浓度超过100 mg·L-1时,界面电阻、电荷转移电阻和离子扩散阻抗显著增大,对电极反应不利。
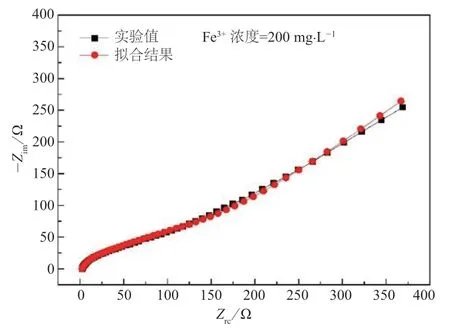
图8 等效电路拟合结果与实验值的对比
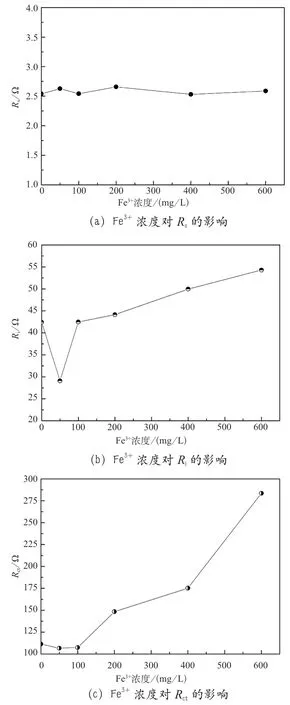
图9 Fe3+浓度对电化学阻抗参数的影响
2.3 机理探讨
基于上述分析,VO2+/VO2+电极反应过程受Fe3+浓度的影响,主要是通过其对电荷转移过程、电极界面行为和钒离子扩散的影响。控制VO2+/VO2+电极过程的是扩散和电化学反应的联合作用,而影响后者的因素复杂。Fe3+影响VO2+/VO2+电极反应的可能原因有[5,8,11-12]:
1)Fe3+促进电极表面膜的形成,增加电极反应阻抗,影响电极表面的离子传递过程;
2)钒有空d 轨道,钒离子之间极易缔合,在稀硫酸溶液中,V4+的存在结构如图10(a)所示,在浓硫酸溶液中,V4+更倾向于以如图10(b)所示的二聚体结构存在,这种缔合作用对Fe3+较为敏感,Fe3+能够通过与SO42-的强作用破坏二聚体结构,从而促进钒离子的扩散行为。
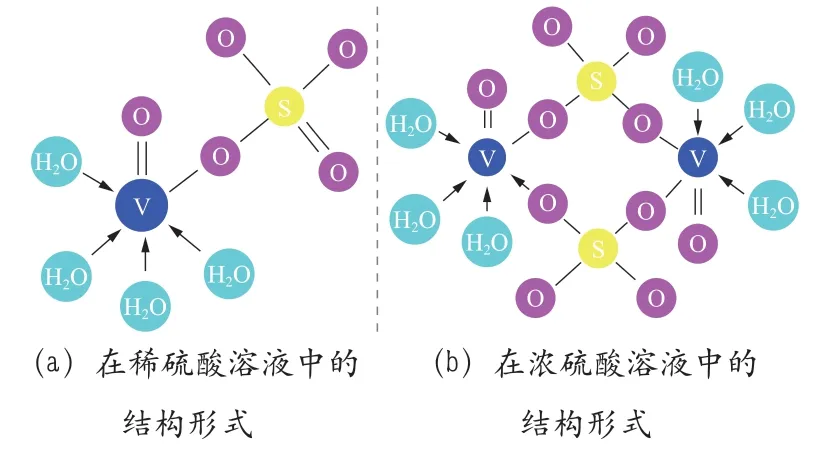
图10 V4+在硫酸溶液中的存在形式
虽然表面膜的形成阻碍了钒离子的扩散,但是Fe3+通过抑制钒离子缔合能够使钒离子扩散变得容易,因此在两方面因素的综合作用下,W随Fe3+浓度的增大而呈现先增大后减小的变化趋势。
3 结论
利用CV 和EIS 对Fe3+浓度影响VO2+/VO2+电极过程的规律进行了研究。循环伏安结果表明,Fe3+浓度低于100 mg·L-1时,能够提高电极反应的活性和可逆性,但是阻碍了钒离子的扩散;当Fe3+浓度超过100 mg·L-1,电化学活性逐渐受到抑制,而钒离子的扩散行为又逐渐受到促进。电化学阻抗谱结果表明,随Fe3+浓度增大,溶液电阻没有明显变化,界面电阻与电荷转移电阻随Fe3+浓度的增大,先减小后增大;钒离子扩散Warburg 阻抗呈双阶段变化,在Fe3+浓度小于100 mg·L-1时W随Fe3+浓度的增大先增大,随后又逐渐减小。综合实验结果,Fe3+浓度在一定范围内可以减小界面和电荷转移电阻,阻碍钒离子的扩散;随后界面和电荷转移电阻随Fe3+浓度的增大而增大,而钒离子扩散阻抗逐渐减小;因此Fe3+在电解液中存在最佳浓度范围。为了保证正极电解液的电化学活性,Fe3+浓度需要控制在100 mg·L-1以下。

