大鼠BMG吸附MSCs修复骨缺损的可行性及有效性研究
卢志华 孙煜喆 许丁文
在临床骨科研究中,关于骨缺损修复的研究较为困难,临床对使用人工合成骨、自体骨移植、异体骨移植等方式进行骨缺损修复[1-3]。其中自体骨移植为修复骨缺损的最好方式,但自体骨来源获取较为困难,可限制临床自体骨移植的使用。临床研究中,关于修复骨缺损的研究逐渐增多,多采用组织工程的方法构建新生骨组织,且种子细胞的选取和培养为骨组织工程学中的重要步骤,骨髓间充质干细胞(mesenchymal stem cell,MSCs)既可修复关节软骨面的缺损,也可修复包括软骨下骨的关节软骨缺损,是最佳理想的种子细胞的选择[3-5]。临床骨组织工程学的研究,载体选择具有重要作用。同种异体骨基质明胶(bone matrix gelatin,BMG)是异体骨经过脱钙等一系列过程处理后的产物,含有在加工处理过程中未被破坏的骨形态发生蛋白骨成形蛋白(bone morphogenetic proteins,BMPs),而BMPs 是具有成骨诱导活性的一组生长因子,有利于骨的生长和再生[6-7]。基于此,本研究以MSCs 为种子细胞,以大鼠BMG 为载体,探讨大鼠BMG 吸附MSCs 修复骨缺损的可行性及有效性,以期为临床构建骨缺损的修复提供参考,现报道如下。
1 材料与方法
1.1 一般材料
54 只成年雄性美国斯泼累格·多雷(sprague-dawley,SD)大鼠[浙江省中药研究所有限公司,SYXK(浙)2023-0025],无特定病原体级(specific pathogen free,SPF),购自实验动物中心,SD 大鼠体质量为231~284 g,平均(257.25±12.87)g,饲养于温度为22~23℃、湿度为60%的无菌环境中,光照为12 h 光照/黑暗周期,所有大鼠经过5 d 适应期后进行实验。本研究获得扬州市职业大学医学院动物保护委员会批准。
1.2 方法
1.2.1 BMG 的制备
取SD 大鼠,解剖分离四肢长骨,去除软组织,用蒸馏水反复冲洗清除骨髓组织,依次进行脱钙、脱脂、冻干和灭菌处理,并保存于4℃冰箱中备用。
1.2.2 MSCs 的分离与培养
取SD 大鼠,100 g/L 水合氯醛麻醉,采用75%乙醇浸泡20 min,无菌条件下取出两侧肱骨和股骨,刮除软组织、骨膜和干骺端的软骨部分,剪去骨骺端,骨髓用含10%胎牛血清的l-dmem 完全培养基洗涤,混合均匀后接种于细胞专用培养瓶,并加入10%的灭活FBS,放入含有5% CO2的37℃培养箱中继续培养,当细胞的融合度至80%~90%时,采用0.25%的胰蛋白酶对细胞进行消化处理,后实施传代培育,按1∶3 的比例传代扩增。
1.2.3 骨缺损模型的制备
100 g/L 水合氯醛腹腔麻醉后(3 mL/kg),无菌暴露双侧桡骨中段按照长骨缺损临界值制成5 mm 节段性缺损。
1.2.4 实验分组
共有18 只大鼠骨缺损模型制备失败,将制备成功36只大鼠分为每组18 只,对照组BMG 植入,实验组MSCs经荧光标记后与BMG 共同培养植入。均不予以内外固定,逐层缝合伤口。
1.3 观察指标
(1)分别于术后1、2、3 周、1、2 个月处死大鼠2 只,比较各组成骨效应。(2)观察术后2个月取骨缺损区组织形态,采用荧光染料标记实验组骨缺损区的骨痂,判断骨痂来源。
1.3.1 骨缺损区放射学评分检测
术后1、2、3 周、1、2 个月麻醉下行左侧前肢正侧位X 射线检查。后根据X 射线片评分标准对X 射线进行评分[8]。0 分:无骨形成,可见骨连接线,缺损区未形成骨髓腔;2 分:新生骨占缺损区域的50%,可见部分骨折线,缺损区骨髓腔形成再通;4 分:新生骨占缺损区域的100%,未见骨折线,缺损区骨髓腔形成再通后腔内皮质骨形成。
1.3.2 骨缺损修复组织学评分检测
术后1、2、3 周、1、2 个月截取大鼠修复部位标本,固定于40 g/L 多聚甲醛中,并进行脱水、包埋处理,制作5 张切片,切片厚度为0.5 μm,后进行苏木精-伊红染色(hematoxylin-eosin staining,HE staining),光学显微镜下对组织的结构与细胞的形态进行观察,并按照组织学评分标准对各组标本进行评分[9]。1 分:缺损区域受到新形成的结缔组织(含有毛细血管、成纤维细胞、巨噬细胞、新形成的胶原纤维)填充,且结缔组织较疏松;2 分:密集结缔组织处,具有较多的大量分化细胞,且纤维有序排列;3 分:形成较多新骨,结缔组织分化形成骨基质、骨单位;4 分:产生骨组织。
1.4 统计学方法
采用SPSS 19.0 统计学软件进行数据分析处理。计量资料以()表示,采用t检验;正态分布检验和方差齐性检验采用Kolmogorov-Smirnov 检验与Levene 检验;计数资料以n(%)表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组成骨效应比较
对照组类骨样组织形成量较实验组同期标本明显较少,且骨量与成熟程度均明显低于实验组。见表1、图1。
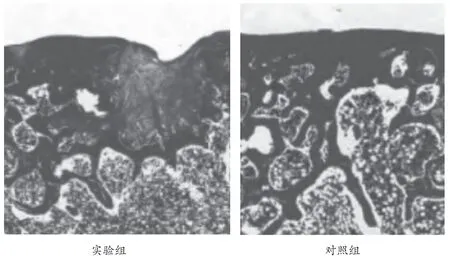
图1 术后2 个月检测情况(×100)。对照组BMG 部位可见骨组织形成,但骨量与成熟程度较低,具有炎性细胞浸润;实验组毛细血管及结缔组织增多,形成大量新骨。

表1 实验组与对照组成骨效应比较
2.2 两组荧光染料标记情况比较
通过荧光染料标记确认,胫骨骨缺损区的骨痂来源于MSCs。见图2。
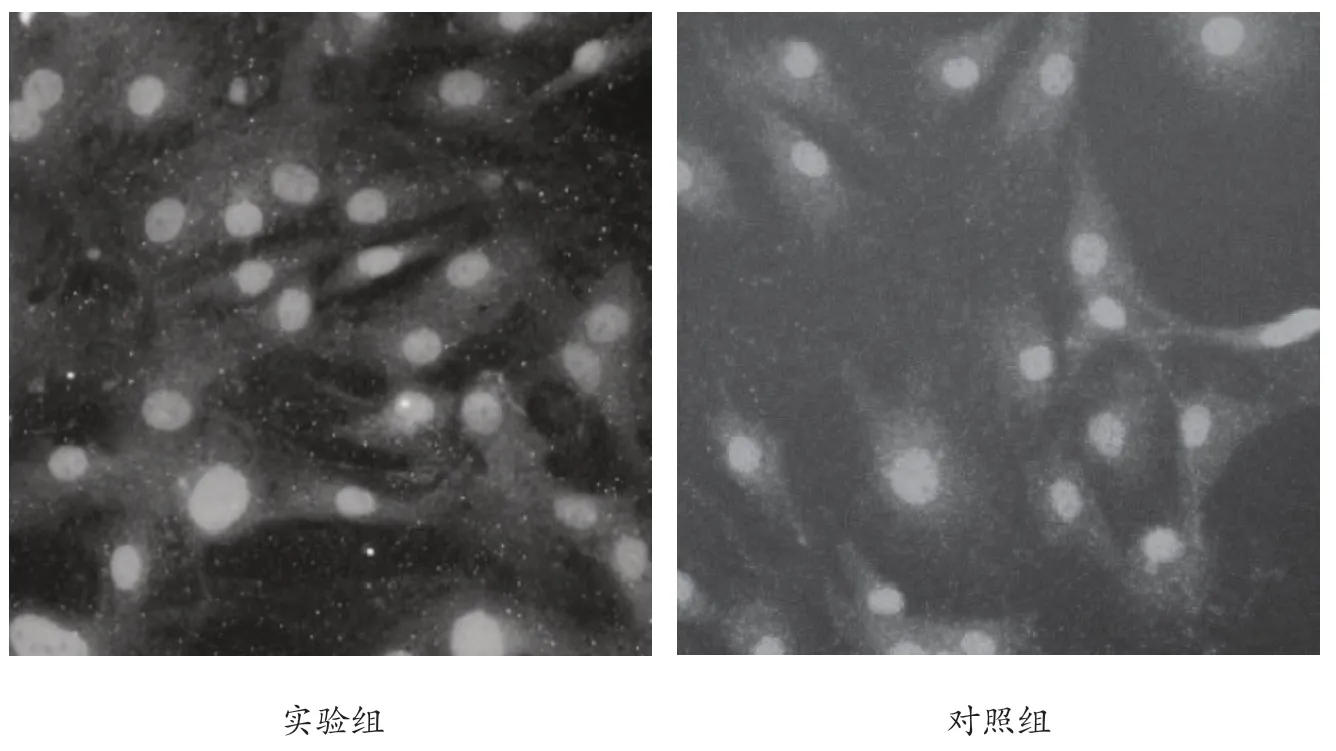
图2 术后2 个月二脒基苯基吲哚(diamidinyl phenyl indole,DAPI)染色组织切片荧光染料标记情况(×150)。对照组胫骨骨缺损区的骨痂形成较少,缺损区边缘带有少量骨痂组织;实验组胫骨骨缺损区形成大量骨痂。
2.3 两组大鼠骨缺损区放射学评分比较
与对照组比较,实验组1、2、3 周、1、2 个月放射学评分较高,差异有统计学意义(P<0.05)。见表2。
表2 实验组与对照组大鼠骨缺损区放射学评分比较(分,)

表2 实验组与对照组大鼠骨缺损区放射学评分比较(分,)
2.4 两组大鼠骨缺损修复组织学评分比较
与对照组比较,实验组1、2、3 周、1、2 个月组织学评分较高,差异有统计学意义(P<0.05)。见表3。
表3 实验组与对照组大鼠骨缺损修复组织学评分比较(分,)
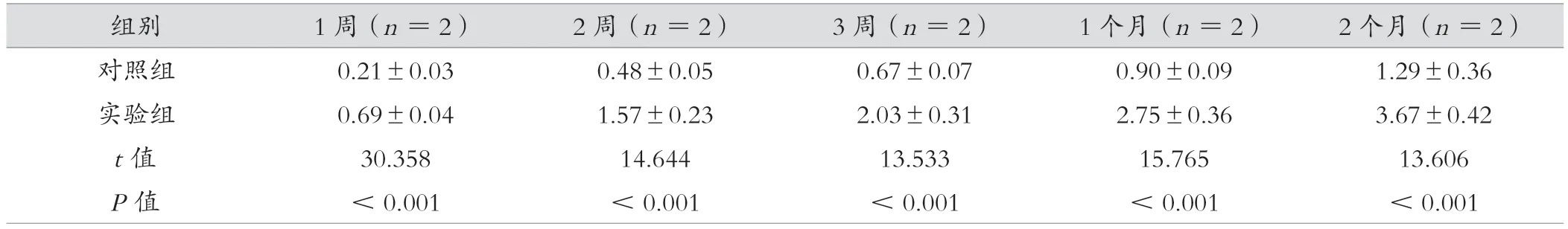
表3 实验组与对照组大鼠骨缺损修复组织学评分比较(分,)
3 讨论
本研究结果显示,对照组类骨样组织形成量较实验组同期标本明显较少,且骨量与成熟程度均明显低于实验组。HE 染色确认胫骨骨缺损区的骨痂来源于MSCs。成骨效应分析:在SD 大鼠的胫骨骨缺损区,植入MSCs 与BMG 的复合物,根据骨缺损区局部微环境的诱导因子对成骨进行调控,但成骨细胞的调控可受到局部血供的影响,使细胞的分化,骨缺损区具有良好的血供可分化为成骨细胞,血供不足可分化为软骨细胞[10]。本研究结果显示,MSCs 与BMG 复合组的骨缺损修复能力高于单纯BMG 组,且单纯BMG 组成骨能力较好。大鼠进行移植骨缺损后,未发现异型、炎性细胞,表明该方式不会造成瘤变、排斥反应,安全性较强。
而单纯BMG 具有具有一定成骨能力,分析原因在于:BMG 中含有较多BMPs,且未受到破坏,BMPs 为生长因子,具有较强的诱导活性,可诱导血管周围未分化的MSCs 成骨分化[11-12]。BMPs 可使MSCs 的碱性磷酸酶(alkaline phosphatase,ALP)活性增加,并增强间充质细胞活性,使细胞外基质钙盐沉着[13-15]。MSCs成骨细胞分化时,可抑制脂肪细胞的分化,使骨形成、再生速度加快[16-17]。
本研究发现,对照组大鼠在3 周、1 个月时在少量溶解吸收BMG 区域形成类骨样组织,但实验组大鼠在2 周后BMG 区域出现类骨样组织,该结果表明,实验组的成骨效果优于对照组。在2 个月时,对照组BMG部分出现骨组织形,但与实验组比较,具有较少骨量,且成熟度较晚,为早期骨组织的形成表现。原因可能为,BMPs 通过局部间充质细胞诱导成骨细胞分化,但成骨细胞的分化数量低于骨髓间充质干细胞(rat bone marrow mesenchymal stem cells,rMSCs),故导致对照组低于实验组同一时间成骨量,延长临床骨质生成时间。
本研究选用BMG 作为rMSCs 载体,原因为BMG 可运输机体内种子细胞,使其发生黏附且BMG 可促使毛细血管的生长,使载体基质溶入受体骨基质,BMG 可使受体细胞、种子细胞共同作用,形成骨痂,在临床研究中具有重要作用。
综上所述,大鼠BMG 吸附MSCs 修复骨缺损具有可行性及有效性。

