凉血散瘀汤结合常规西药治疗IgA肾病疗效及对患者血液流变学、炎性细胞因子水平的影响
向广生,唐晨思,路博宇,张孝利,张志强
(1.石家庄市中医院东院区肾病科,河北 石家庄 050000;2.华北医疗健康集团石家庄华药医院肾内科,河北 石家庄 050000;3.河北省赵县中医院内三科,河北 赵县 051530)
IgA肾病为慢性肾小球肾炎中常见病理类型,也是慢性肾功能衰竭发生的主要诱因之一,患者主要表现为肾小球系膜区出现大量IgA免疫复合物沉淀[1]。本病临床表现复杂多样,随病情进展可导致肾功能衰竭,严重威胁患者生命健康。近年随相关研究深入,部分学者指出,血液流变学异常将导致患者肾内微循环障碍,加重肾组织损伤[2];炎性细胞因子过表达引起的炎性浸润及组织损伤也是促使IgA肾病患者肾功能下降的内在机制[3]。IgA肾病的西药治疗常用免疫抑制剂、糖皮质激素及其他对症处理药物,虽可一定程度控制患者病情进展,但长期用药不良反应多,停药后患者易出现反跳效应,存在一定应用局限[4]。中医理论中IgA肾病可纳入“血尿”“尿血”“水肿”范畴,肾虚血瘀为此类患者常见证型,治疗需用益肾健脾、凉血散瘀之法[5-6]。此次为观察凉血散瘀汤联合常规西药治疗IgA肾病对患者血液流变学、炎性细胞因子、肾功能等多个方面的影响,收集我院96例患者开展如下分析。
1 资料与方法
1.1 一般资料 纳入2021年3月至2023年2月在我院就诊的IgA肾病患者96例,病例纳入标准:①符合《肾脏病学》[7]中IgA肾病相关诊断标准。②中医诊断符合《IgA肾病西医诊断和中医辨证分型的实践指南》[8]中相关诊断标准,辨证为肾虚血瘀证,主症:气短乏力、肢体麻木、心悸;次症:口渴、手足心热、神疲、自汗盗汗,舌暗紫、少苔偏干,脉涩。③知情,已签同意书。④近期未患感染性疾病。⑤既往无药物过敏史。排除标准:①治疗前60 d内曾使用免疫抑制剂/糖皮质激素。②合并心、肺等器质性病变。③继发性IgA肾病,如肝硬化、紫癜性肾炎。④认知功能障碍。计算机随机数字分为治疗组、对照组各48例,治疗组中男女之比为26∶22;慢性肾脏病分期:1期8例,2期27例,3期13例;年龄21~53岁,平均(34.05±4.12)岁;病程1~4年,平均(2.49±0.56)年。对照组中男女之比为27∶21;慢性肾脏病分期:1期7例,2期29例,3期12例;年龄21~54岁,平均(34.21±4.14)岁;病程1~4年,平均(2.51±0.58)年。治疗组年龄、慢性肾脏病分期等基线特征与对照组比较无统计学差异(P>0.05)。本次研究已通过我院伦理委员会批准(批号:202103-17)。
1.2 治疗方法 两组患者均控制饮食,严格限制盐、脂摄入,控制血糖并进行运动指导,监测患者24 h尿蛋白定量,若超过1 g/24 h则给予泼尼松(国药准字H52020290),1 mg/(kg·d),于清晨口服。
1.2.1 对照组:使用缬沙坦(国药准字H20030638),80 mg/(次·d),口服。
1.2.2 治疗组:在对照组西药治疗同时给予凉血散瘀汤,组方:紫荆皮、薏苡仁、白鲜皮各25 g,牡丹皮10 g,赤芍、生地黄、陈皮各12 g,车前子28 g,竹茹15 g,青蒿16 g,水煎煮,余200~300 ml药液,1剂/d,清晨及傍晚服用。两组均持续用药60 d。
1.3 观察指标
1.3.1 疗效评估:参考《中药新药临床研究指导原则》[9],观察患者治疗前后证候积分变化情况,主症气短乏力、肢体麻木、心悸;次症:口渴、手足心热、神疲、自汗盗汗,主症按无、轻、中、重对应积分0、2、4、6分,次症按无、轻、中、重对应积分0、1、2、3分,根据患者证候积分、体征、24尿蛋白定量完成疗效评级:显效:治疗后中医证候积分减少≥70%,24 h尿蛋白定量减少≥40%,患者临床症状及体征显著改善;有效:治疗后中医证候积分减少≥30%,24 h尿蛋白定量减少≥25%,临床症状及体征明显好转;无效:不符合有效、显效标准。总有效率=(显效+有效)例数/总例数×100%。
1.3.2 血液流变学、炎性细胞因子及肾功能指标:治疗前及治疗后抽取患者外周静脉血5 ml,其中2 ml进行血液流变学指标(全血高切、低切黏度)检测,仪器:HT-100B型血液流变仪(淄博恒拓分析仪器有限公司);3 ml全血标本离心处理(3500 r/min,10 min),使用5800型全生化分析系统及配套试剂盒测量患者血清MCP-1、IL-6及BUA、Scr水平。
1.3.3 不良反应:记录给药2个月期间患者神经系统症状(头晕、头痛等)、消化系统症状(恶心呕吐、便秘、食欲降低等)、四肢及躯干症状(四肢无力、皮疹等)等不良反应。
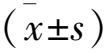
2 结 果
2.1 两组疗效比较 治疗组治疗总有效率高于对照组(P<0.05),见表1。

表1 两组疗效比较[例(%)]
2.2 两组治疗前后全血高切、低切黏度比较 高切、低切黏度治疗前组间对比,无统计学差异(P>0.05),治疗后均下降(P<0.05),且治疗组下降幅度大于对照组(P<0.05),见表2。

表2 两组治疗前后全血高切、低切黏度比较(mPa·s)
2.3 两组治疗前后血清炎性细胞因子水平比较 两组治疗前血清MCP-1、IL-6水平比较差异无统计学意义(P>0.05);治疗后均下降(P<0.05),且治疗组降幅更大(P<0.05),见表3。

表3 两组治疗前后血清MCP-1、IL-6水平比较(ng/L)
2.4 两组治疗前后肾功能指标比较 治疗组治疗前Scr、BUA水平与对照组比较,无统计学差异(P>0.05);治疗后Scr、BUA水平均下降(P<0.05),且治疗组下降幅度大于对照组(P<0.05),见表4。

表4 两组治疗前后Scr、BUA水平比较(μmol/L)
2.5 两组不良反应比较 治疗组神经系统症状、四肢及躯干症状等不良反应总发生率显著低于对照组(P<0.05),见表5。

表5 两组不良反应比较[例(%)]
3 讨 论
IgA肾病作为慢性肾小球肾炎的一种,患者根据其临床症状可纳入“尿血”“水肿”“肾风”等范畴[10-11]。黄文政教授指出,IgA肾病是因体虚、气虚,加上外邪侵袭,导致肺、脾、肾功能失常,继而水湿浊邪内壅,日久则形成湿热瘀血等标实,患者病机特点为本虚标实,虚实夹杂,由虚生瘀,瘀阻脉络之时血行不畅,血溢脉外最终形成血尿[12]。肾虚血瘀证为临床IgA肾病患者常见证型,患者肾、脾功能失调,精微下注,精气外泄受损,致使血脉运行不畅,久则成瘀,阻于脉络进一步损伤肾脉,最终致病[13-14]。针对肾虚血瘀证患者,治疗应以益脾健肾、凉血散瘀之法。
郑静等[15]利用凉血散瘀汤治疗IgA肾病患者,结果表明该方可延缓患者肾纤维化,改善患者肾功能,发挥显著疗效。方中青蒿凉血除蒸,生地黄补脾益气,两药合为君药;紫荆皮活血消肿,牡丹皮活血化瘀,陈皮理气健脾,白鲜皮清热解毒,竹茹清热除烦,五药合为臣药;赤芍清热凉血,薏苡仁利水渗湿、健脾止泻,车前子清热利尿,三药合为使药,诸药共济,可达健脾益肾、活血化瘀、凉血清热之效。现代药理学研究表明,生地黄中有效成分可诱导肾小球系膜细胞增殖,抑制细胞外基质增生,起到一定肾脏保护作用[16-17];青蒿中青蒿琥酯具有显著抗炎作用,可下调炎性细胞因子水平,减轻炎性浸润[18-19]。
血液流变学异常在IgA肾病发展过程中具有重要作用,血液黏度上升,引起肾脏微循环障碍,加重肾小球损伤[20-21]。此次分析治疗组治疗后全血高切黏度、全血低切黏度低于对照组,说明联合给药方案可显著改善患者血液流变学。分析认为,牡丹皮中丹皮酚可抑制脂质过氧化反应,降低血液黏度,有效改善患者血液流变学,从而联合给药时对患者血液流变学的改善效果更佳[22-23]。炎症反应可引起系膜细胞及系膜基质增生,加重肾小球损伤,而肾小球损伤促使趋化因子及炎性细胞因子释放,进一步加重肾组织损伤[24-25]。IL-6及MCP-1均为生物活性广泛的炎性细胞因子,其血内表达水平与患者炎症反应强度呈正相关。治疗后中西药联合治疗组血清MCP-1、IL-6水平低于对照组,说明凉血散瘀汤还可改善患者炎症反应,下调炎性细胞水平,减轻炎性浸润引起的损伤。笔者认为上述青蒿具有抗炎作用外,赤芍、陈皮等中药也具有一定抗炎效果,协同常规西药治疗可进一步下调患者炎性细胞因子水平。肾功能观察中,治疗组治疗后Scr、BUA水平低于对照组,证实联合给药方案可改善患者肾功能,与上述炎性因子、血液流变学观察结果相符。两组不良反应总发生率比较无统计学差异,表明凉血散瘀汤与常规西药联合应用不增加患者不良反应。
综上所述,凉血散瘀汤结合常规西药治疗IgA肾病患者疗效突出,可通过改善患者血液流变学、下调炎性细胞因子改善患者肾功能,且联合给药安全性与单纯西药治疗相似。

