MZF1 通过调控PLA2G6 参与肾透明细胞癌的进程
付玲,赵延君,刘蕾
1.佳木斯大学基础医学院,黑龙江佳木斯 154007;2.齐齐哈尔市第一医院南院肾内二科,黑龙江齐齐哈尔 161005
肾细胞癌是一种起源于肾小管上皮细胞的恶性肿瘤,占肾脏恶性肿瘤的近90%,占成人恶性肿瘤的3%[1]。肾透明细胞癌(kidney renal clear cell carcinoma, ccRCC)是肾细胞癌最典型的亚型,它通常没有症状,大约30%的患者被诊断为晚期[2]。因此,迫切需要全面了解KIRC 的分子机制,制订有效的早期诊断和治疗策略。
髓样锌指蛋白1(recombinant human myeloid zinc finger 1, MZF1)是锌指转录因子家族的成员,是锌指蛋白的一个亚家族[3]。MZF1 最早是从一个慢性骨髓性白血病患者的外周血中分离出来的,参与造血发育的转录调控[4]。之后它被证明可以调节影响分化、增殖和细胞程序性死亡的造血特异性基因的表达,并发现其异常表达会导致造血性癌症的发生[5]。在过去的研究中,MZF1 被证明与各种类型的实体癌发展有关,它能促进乳腺癌、肝癌、肺腺癌等各种癌细胞的生长、迁移和侵袭[6-9]。然而,MZF1在肾细胞癌中的临床意义尚不清楚。佳木斯大学基础医学院和齐齐哈尔市第一医院自2022年10月—2023年5月从癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库中下载KIRC 样本的临床特征和RNA-seq 表达数据,旨在确定MZF1 在KIRC 中的潜在临床意义,包括功能机制和靶向治疗的潜在基因。现报道如下。
1 对象与方法
1.1 数据采集
本研究从TCGA 数据库(https://portal.gdc. cancer.gov/)下载肾透明细胞癌样本的临床特征和RNA-seq 表达数据。
1.2 细胞培养
从美国典型培养物保藏中心(American Type Culture Collection, ATCC)购入人肾皮质近端肾小管上皮细胞(human kidney-2, HK-2)和KIRC 癌细胞系(OSRC-2 和786-O),将其放在含有10%胎牛血清,100 g/mL 青霉素和100 g/mL 链霉素的RPMI-1640 培养基中培养。
1.3 RNA 提取
使用TRIzol 来提取细胞系的总RNA,使用Moloney 白血病病毒逆转录酶试剂盒进行逆转录反应,以1 μg 的总RNA 为模板生成高质量的cDNA。使用Green Mix SYBR 对cDNA 样本进行qRT-PCR 扩增,并使用甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase, gAPDH)作为内部对照来规范其表达。2-△△CT 被用来计算相对表达的FC,每个样品被测试3 次。
1.4 Western blot
首先使用含有蛋白抑制剂的RIPA 缓冲液来裂解细胞系,然后用Pierce 蛋白质检测试剂盒测量蛋白质的浓度。在蛋白质通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE),转移到PVDF膜,并且纯化之后,使用一抗来识别蛋白质。使用化学发光法,按照制造商的说明测量蛋白质。用GAPDH 作为内部对照来规范其表达,每个样品被测试3 次。
1.5 细胞增殖试验
根据制造商的协议,用细胞计数试剂盒-8(CCK-8)测定细胞的活力。将适量的肿瘤细胞放在96 孔板中,然后将不同量的替莫唑胺(temozolomide, TMZ)或二甲亚砜对照物与细胞进行孵化。之后,将CCK-8 溶液补充到孔中。在微孔板读数器中以450 nm 的吸光度测定光密度(optical density,OD)。每个样品被测试3 次。
1.6 细胞转染
将细胞置于含10%小牛血清的细胞培养基(dulbecco's modified eagle medium, DMEM)完全培养液中,培养条件为37℃、5%CO2。当细胞生长到60%~70%融合时,参照脂质体 LipofectamineTM2000说明书,分别转染两种不同的小干扰素RNA,si#1和si#2 质粒,转染后1 d 更新培养基,转染后48 h 后检测细胞,以确保更好地从转染引起的压力中恢复。以正常未转染的细胞作为对照组(blank),以转染空质粒的细胞作为空载组(si-NC)。
1.7 统计方法
所有的数据计算和统计分析都使用R 编程。对于两组连续变量的比较,正态分布的计量资料以(±s)表示,用t检验,非正态分布变量之间的差异用Mann-Whitney U 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 MZF1 在KIRC 中高表达
KIRC 细胞系OSRC-2 中MZF1 的mRNA 水平为(0.99±0.06),786-O 中MZF1 的mRNA 水平为(0.95±0.05),肾脏细胞系HK-2 中MZF1 的mRNA水平为(0.24±0.05)。肾脏细胞系HK-2 中MZF1 的mRNA 水平明显低于OSRC-2、786-O 中mRNA 水平,差异有统计学意义(P<0.05)。KIRC 细胞系OSRC-2 中MZF1 的蛋白水平为(1.15±0.05),786-O中MZF1 的蛋白水平为(1.22±0.05),肾脏细胞系HK-2 中MZF1 的蛋白水平为(0.74±0.03)。肾脏细胞系HK-2 中MZF1 的蛋白水平明显低于OSRC-2、786-O 中蛋白水平,差异有统计学意义(P<0.05)。见图1。

图1 MZF1 在KIRC 中高表达
为了确定MZF1 对诊断KIRC 的敏感度和特异度,下载了TCGA-KIRC 的基因表达数据进行了ROC 曲线分析,AUC 值为0.767,敏感度为0.719,特异度为0.752,见图2。
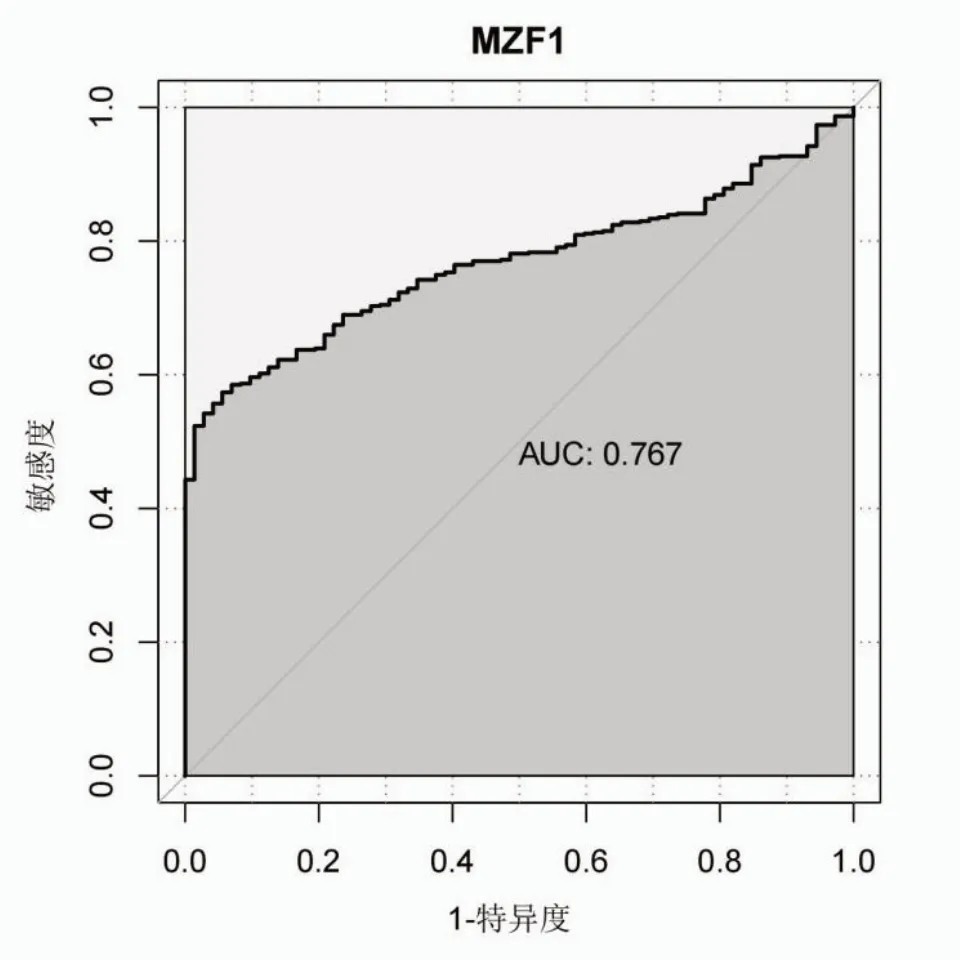
图2 MZF1 的ROC 曲线分析图
2.2 敲除MZF1 促进细胞铁死亡并抑制细胞体外增殖
OSRC-2 细胞中blank 组MZF1 的蛋白水平为(0.80±0.02),si-NC 组MZF1 的蛋白水平为(0.69±0.01),MZF1si 1 组的蛋白水平为(0.03±0.01),MZF1si 2 组的蛋白水平为(0.39±0.02)。si-NC 组与空载组MZF1 的蛋白水平比较,差异无统计学意义(P>0.05),MZF1si 1 组和MZF1si 2 组的MZF1 蛋白水平明显低于blank 组,差异有统计学意义(P<0.05)。786-O 细胞中blank 组MZF1 的蛋白水平为(1.16±0.02),si-NC 组MZF1 的蛋白水平为(1.06±0.02),MZF1si 1 组的蛋白水平为(0.25±0.01),MZF1si 2 组的蛋白水平为(0.72±0.02)。si-NC 组与空载组MZF1 的蛋白水平比较,差异无统计学意义(P>0.05),MZF1si 1 组和MZF1si 2 组的MZF1 蛋白水平明显低于blank 组,差异有统计学意义(P<0.05)。见图3A、图3B。

图3 敲除MZF1 促进细胞铁死亡并抑制细胞体外增殖
OSRC-2 细胞中blank 组MZF1 的mRNA 水平为(1.02±0.02),si-NC 组MZF1 的mRNA 水平为(0.97±0.01),MZF1si 1 组的mRNA 水平为(0.33±0.03),MZF1si 2 组的mRNA 水平为(0.60±0.03)。si-NC 组与空载组MZF1 的mRNA 水平比较,差异无统计学意义(P>0.05),MZF1si 1 组和MZF1si 2 组的MZF1mRNA 水平明显低于blank 组,差异有统计学意义(P<0.05)。786-O细胞中blank组MZF1的mRNA水平为(1.01±0.04),si-NC 组MZF1 的mRNA 水平为(0.99±0.02),MZF1si 1 组的mRNA 水平为(0.49±0.04),MZF1si 2 组的mRNA 水平为(0.22±0.04)。si-NC 组与空载组MZF1 的mRNA 水平比较,差异无统计学意义(P>0.05),MZF1si 1 组和MZF1si 2 组的MZF1mRNA 水平明显低于blank 组,差异有统计学意义(P<0.05)。见图3C。
OSRC-2 细胞中si-NC 组OD 值为(2.39±0.40),si-MZF1 组OD 值为(1.95±0.07);786-O 细胞中si-NC 组OD 值为(2.58±0.06),si-MZF1 组OD 值为(2.12±0.03)。OSRC-2 与786-O 细胞中si-MZF1 组OD 值均小于si-NC 组,差异有统计学意义(P<0.05)。见图3D。
2.3 钙非依赖性磷脂酶A2G6(calcium-independent phospholipase A2G6,PLA2G6)是MZF1 的靶基因
KIRC 细胞系OSRC-2 中PLA2G6 的mRNA 水平为(1.00±0.04),786-O 中MZF1 的mRNA 水平为(1.01±0.03),肾脏细胞系HK-2 中MZF1 的mRNA水平为(0.60±0.04)。肾脏细胞系HK-2 中PLA2G6的mRNA 水平明显低于OSRC-2、786-O 中mRNA水平,差异有统计学意义(P<0.05)。见图4A。

图4 PLA2G6 是MZF1 的靶基因
KIRC 细胞系OSRC-2 中PLA2G6 的蛋白水平为(1.15±0.05),786-O 中MZF1 的蛋白水平为(1.25±0.03),肾脏细胞系HK-2 中MZF1 的蛋白水平为(0.81±0.03)。肾脏细胞系HK-2 中PLA2G6 的蛋白水平明显低于OSRC-2、786-O 中蛋白水平,差异有统计学意义(P<0.05)。见图4B。
KIRC 细胞系ov-MZF1 OSRC-2 组PLA2G6 的mRNA 水平为(1.00±0.04),OSRC-2 组中PLA2G6的mRNA 水平为(0.75±0.03),si-MZF1 OSRC-2 组PLA2G6 的mRNA 水平为(0.43±0.03)。与OSRC-2组相比,ov-MZF1 OSRC-2 组PLA2G6 的mRNA 水平明显升高,si-MZF1 OSRC-2 组PLA2G6 的mRNA水平明显降低,差异有统计学意义(P<0.05)。见图4C。
KIRC 细胞系ov-MZF1 OSRC-2 组PLA2G6 的蛋白水平为(1.21±0.05),OSRC-2 组中PLA2G6 的蛋白水平为(0.64±0.02),si-MZF1 OSRC-2 组PLA2G6 的蛋白水平为(0.30±0.03)。与OSRC-2 组相比,ov-MZF1 OSRC-2 组PLA2G6 的蛋白水平明显升高,si-MZF1 OSRC-2 组PLA2G6 的蛋白水平明显降低,差异有统计学意义(P<0.05)。见图4D。
2.4 MZF1 通过PLA2G6 刺激KIRC 细胞增殖
OE-MZF1+sh-NC 组的OD 值为(2.78±0.04),Empty vector+sh-NC 组的OD 值为(2.41±0.03),OEMZF1+sh-PLA2G6 组的OD 值为(2.11±0.02)。与Empty vector+sh-NC 组相比,OE-MZF1+sh-NC 组的OD 值明显升高,OE-MZF1+sh-PLA2G6 组的OD 值明显降低,差异有统计学意义(P<0.05),这表明,MZF1 通过PLA2G6 刺激KIRC 细胞增殖,见图5。
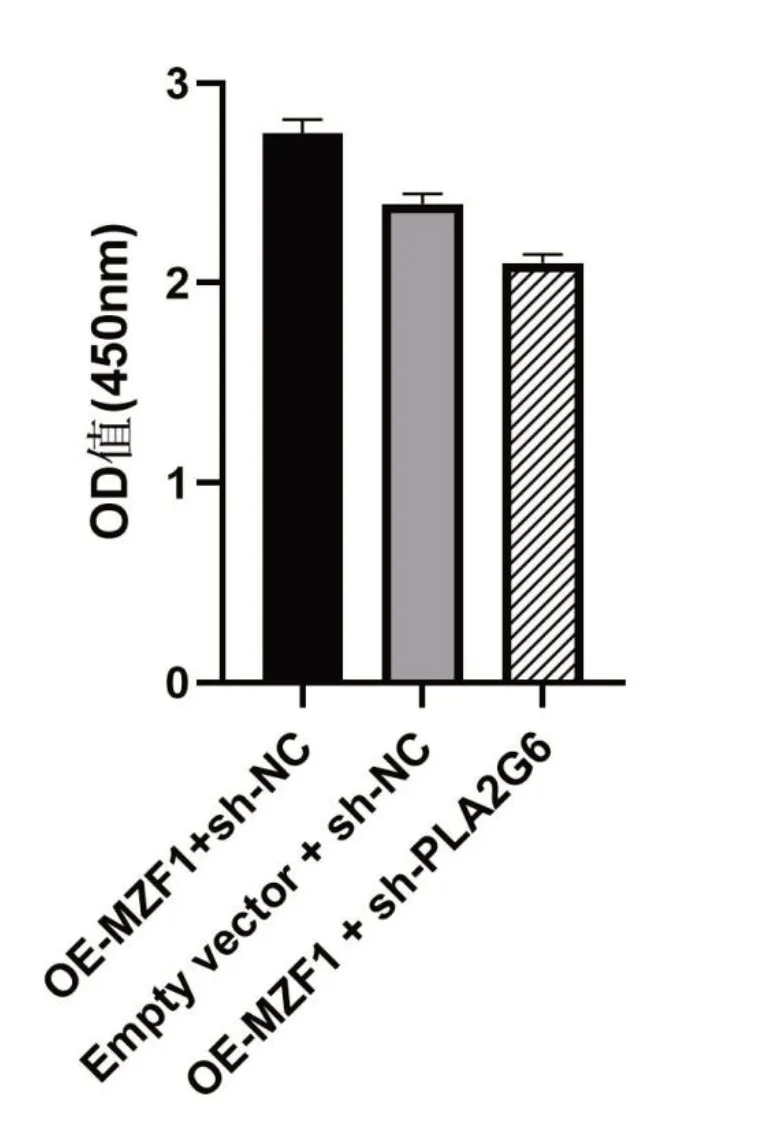
图5 CCK8 实验检测OSRC-2 细胞增殖率
3 讨论
如今,肾细胞癌占肾脏恶性肿瘤的90%,已经发展成为泌尿系统最常见的癌症。KIRC 是最常见的肾细胞癌之一,大多数KIRC 是无症状的,约30%的患者首次诊断时已经是晚期。手术切除是最基本和有效的治疗方法。然而,大约40%的患者在初次手术治疗后被诊断出有转移。更重要的是,临床研究发现,术后化疗和放疗对降低复发和转移率作用不大[10-11]。因此,现在迫切需要探索用于基因靶向治疗的基因标记,以提高化疗耐药性和术后复发率。
MZF1 是一种多功能蛋白,在不同类型的细胞中都至关重要。研究显示,MZF1 可以促进NIH3T3成纤维细胞的增殖,还能减少前列腺癌细胞的增殖[12]。在本研究中,MZF1 的蛋白质和mRNA 表达在KIRC 细胞系中的表达量高于正常细胞系(P<0.05)。并且ROC 曲线分析的结果显示MZF1 对KIRC 有很高的诊断意义。因此,推测MZF1 可能与KIRC 的进展相关。这一结果与Huang Z 等[13]在探究透明细胞肾细胞癌的免疫生物标志物研究中得到的结果相一致。他们将85 个免疫基因纳入多因素Cox 回归分析,最终发现PKHD1、IGF2BP3、RORA、FRK 和MZF1 5 个基因是独立的预后免疫基因,且MZF1 的高表达与KIRC 患者生存差相关。而本研究进一步对MZF1 调控KIRC 的具体机制进行了探究。本研究使用了两种不同的小干扰素RNA敲除OSRC-2 和786-O 细胞中的MZF1,在敲除MZF1 后发现癌细胞的增殖明显被抑制,这说明MZF1 与KIRC 的进展和KIRC 细胞的增殖密切相关。PLA2G6 是一种脂质修饰酶,可以水解膜磷脂的第二个碳链[13]。有研究报道,si-PLA2G6 能明显抑制黑色素瘤细胞的增殖和转移,并促进细胞凋亡[14]。本研究还发现PLA2G6 是MZF1 的靶基因,PLA2G6 在KIRC 细胞OSRC-2 和786-O 中的mRNA和蛋白水平高于正常细胞(P<0.05),这与Yang LH等[15]的研究结果相一致。Yang LH 等人的KIRC 免疫脱铁基因的综合分析研究中指出PLA2G6 在KIRC 中的mRNA 表达明显高于正常肾脏组织(P<0.05)。本研究通过荧光定量PCR 和Western blot 实验证实PLA2G6 在KIRC 细胞中的表达高于正常肾细胞(P<0.05)。在此,本研究假设PLA2G6 在KIRC的发展过程中充当了MZF1 的效应器。为证实这一观点,本研究创建MZF1 的不同异构体并转染到OSRC-2 细胞中,发现PLA2G6 的表达量与MZF1 的表达量成正比,证明MZF1 控制PLA2G6 的表达。此外,在MZF1 过量表达的OSRC-2 细胞中,敲低PLA2G6 会使得OSRC-2 细胞增值率降低(P<0.05),说明MZF1 通过PLA2G6 刺激KIRC 细胞增殖。
综上所述,通过对MZF1 的分子机制的深入了解,发现了MZF1及其靶基因PLA2G6在KIRC中的作用。这项调查是首次发现MZF1和PLA2G6之间的关系,还需要进一步的工作来充分了解其中的机制。

