黄精主要活性成分、功能及其作用机制研究进展
李彦力,苏艺,袁晚晴,杨淑婷,黄俊源,黎攀,杜冰
(华南农业大学食品学院,广东广州 510642)
黄精(Polygonatum)属百合科黄精属植物[1],已被2020 版《中国药典》收录。黄精中药材为百合科黄精属植物滇黄精(P.kingianumColl,et Hemsl.)、黄精(P.sibiricumRed)和多花黄精(P.cyrtonemaHua)的干燥根茎。黄精属植物起源于大概2 000 万年前横断山-喜马拉雅地区,随着青藏高原隆升、全球气候变冷和东亚冬季风的增强使得该属逐渐多样化[2]。我国黄精资源主要分布于东北、华东、西北、华北以及东南等地区海拔3 600 m 下的灌丛,林下或山坡阴处等地[3],主产自黑龙江、吉林、河北、内蒙古、陕西、河南、山东等省区,另外滇黄精和多花黄精则主要产自四川和云南。黄精具有补气养阴,健脾,益肾等功效,我国有2 000 多年的黄精药用历史,可治疗脾虚胃虚、口干乏力、精血不足、体疲乏力等多种症状。黄精是卫健委药食同源目录品种之一[4]。黄精生物活性与其活性物质含量、自身品种等有着密切联系。受气候、地理位置、光照、纬度和水质肥料等多种因素影响,使得同种内不同产地黄精的活性成分间存在较大差异。黄精富含多种营养物质,如维生素、氨基酸、矿物质、淀粉以及膳食纤维等[5]。黄精的碳水化合物的占比可达64.1%,膳食纤维可达9.5%。黄精富含多糖、多酚、凝集素、黄酮、生物碱和皂苷等活性成分[6]。研究证明,黄精的主要活性成分具有抗氧化、免疫、抗癌、抗炎、抗疲劳、降血糖等功能活性[7],使得黄精活性成分对心血管疾病、糖尿病、骨质疏松、部分癌症和痛风等都可起到一定的治疗效果[8]。目前,根据黄精功能活性物质具有的这些功能,已研发出多种以黄精为原料的药品、食品保健品和化妆品。本文主要从不同产地、不同种属的黄精活性成分、功能及主要机制进行归纳总结,可为黄精资源的研究与开发提供有效的借鉴。
1 黄精主要活性成分
1.1 黄精多糖
多糖是一种大分子聚合物,一般由10 个及以上的单糖脱水缩合组成[9]。多糖类化合物是黄精属植物的主要的活性成分,《中国药典》规定多糖为黄精的质量标志物。黄精多糖由半乳糖醛酸、阿拉伯糖、鼠李糖、葡萄糖、葡萄糖醛酸、甘露糖、半乳糖以及木糖组成[10]。不同种属、不同产地的黄精,其多糖含量、单糖种类都存在一定的差异。同一品种,不同产地之间极大地影响了黄精的多糖含量,马娟等[7]研究得出,产自黑龙江的黄精多糖含量要明显高于其他地区,高达0.03 mg/mL。六个不同产地的黄精多糖含量由高到低依次为:黑龙江>湖南>安徽>广西>云南>辽宁。不同种属之间的黄精多糖含量也存在差异,马永强等[11]研究得出,河南产黄精、陕西产黄精、云南产滇黄精、广西产滇黄精、黑龙江产多花黄精的多糖含量依次为17.48%、17.18%、16.28%、16.73%以及15.09%。其中,黑龙江产区产黄精的多糖含量最低,而河南产黄精多糖含量最高。
1.2 黄精皂苷
黄精皂苷是黄精发挥药效的主要成分之一,主要有甾体皂苷和三萜皂苷两类[12],包括79 种化合物[13]。马永强等[11]从黄精、滇黄精和多花黄精中分离得到呋喃甾烷型皂苷和螺旋甾烷型皂苷两大类共计67 种甾体皂苷类化合物。Hu 等[14]从黄精和滇黄精中共分离提纯得到12 种三萜皂苷类化合物。徐雨生等[15]研究发现安徽、云南以及广西等产地黄精的皂苷含量约为0.19%。这说明不同种属的黄精含有皂苷的化学结构有着一定差别,但不同产地黄精的皂苷类含量十分接近。
1.3 黄精黄酮
黄酮类是黄精属植物的一种重要的次生代谢产物,也是衡量各产地黄精质量的重要指标[16]。黄精属中的黄酮类化合物大多是由黄精根茎分离得到,其化学结构是由亚型母核结构和侧链基团组成黄精黄酮类化合物[17,18]。按照黄酮的亚型母核的结构上的差异对黄酮类化合物进行分类,可分为高异黄酮、异黄酮、黄酮、查耳酮以及二氢黄酮类。目前已从黄精属中6种植物中筛选出了11 类64 种黄酮类化合物[9]。Wang等[19]研究发现黄精、多花黄精和滇黄精的黄酮种类分别为5 种、13 种和11 种。张凯[9]研究发现,滇黄精、多花黄精和黄精的黄酮含量都较低,介于0.11%~0.14%之间,其中黄精的含量最高(0.14%),滇黄精的含量最低(0.11%)。黄金月等[16]测定了不同产地黄精的黄酮含量后发现,湖南产多花黄精,云南产滇黄精以及黑龙江产黄精的黄酮含量分别为1.35%、1.57%和1.91%,黑龙江产黄精的黄酮含量最高。
1.4 其他活性成分
科研人员在黄精属植物中发现了生物碱、木脂素[20]和凝集素等物质。黄精属植物体内生物碱的含量极低,仅在轮叶黄精、卷叶黄精以及短筒黄精中分离出了少量的生物碱。黄精种属中仅多花黄精中的凝集素的含量较高[21]。科研人员还从黄精属植物中分离出了右旋丁香脂素酚等木质素类物质,以及其它一些尚未开发的小分子物质。黄精主要活性成分见图1[9]。

图1 黄精主要活性成分及其类别Fig.1 Main active components of Polygonatum sibiricum and their categories

图2 黄精多糖降血糖机制Fig.2 The hypoglycemic mechanism of Polygonatum polysaccharide

图3 黄精多糖促进骨细胞分化Fig.3 Polygonatum polysaccharide promotes osteocyte differentiation
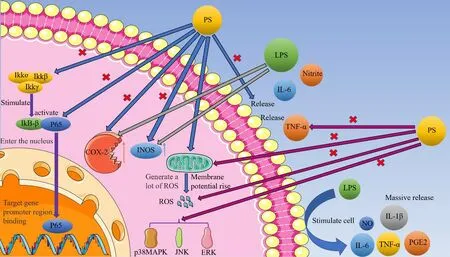
图4 黄精皂苷抗炎抗癌机制Fig.4 Anti inflammatory and anti-cancer mechanism of Polygonatum saponin

图5 黄精凝集素诱导细胞凋亡示意图Fig.5 Schematic diagram of apoptosis induced by Polygonatum agglutinin
2 黄精主要活性成分的功能
黄精富含多种活性成分,黄精主要活性成分有多糖、皂苷[22]以及黄酮[23]等物质。黄精活性物质的功能活性主要包括降血糖[24]、抗炎[25]、抗肿瘤[26]、抗抑郁[27],抗氧化[28]以及抗疲劳[29]等。黄精主要活性成分功能见表1。

表1 不同种类黄精主要活性成分及功能汇总表Table 1 Summary of main active ingredients and functions of different kinds of Polygonatum
2.1 黄精多糖
黄精多糖有抗氧化[28]、改善记忆力[30]、增强免疫力[26]、抗抑郁[27]、抑菌[31]、抗疲劳[32]以及降血糖[24]等诸多活性。实验证明,黄精多糖有着良好的抗氧化活性[28,33-35]。体外清除1,1-二苯基-2-三硝基苯肼(DPPH·)和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS+·)的实验结果表明,黄精多糖有作为天然抗氧化剂的潜力[35]。多糖具有抗肿瘤生物活性,多糖可通过加强免疫力达到延缓肿瘤发展的效果[26]。此外,小鼠动物实验证明,黄精多糖有着一定的免疫刺激活性,可促进细胞增殖、增强吞噬活性及促进TNF-α和IL-6 等细胞因子释放的效果[36,37]。多糖还可通过AMP依赖蛋白激酶AMPK(Adenosine 5‘-Monophosphate(AMP)-Activated Protein Kinase,AMPK)信号通路调节脂肪代谢并修复脂肪代谢异常[38]。
2.2 黄精皂苷
黄精皂苷有着丰富的生物活性。杜小琴等[29]通过小鼠负重游泳实验得出黄精皂苷有着一定的抗疲劳效果。李思媛等[39]得出黄精皂苷可缓解脂多糖诱导RAW264.7 的细胞炎症发挥抗炎作用。黄精皂苷可通过抑制α-淀粉酶以及葡萄糖基转移酶的活性达到降低血糖效果,黄精皂苷降血糖水平与阳性对照药物二甲双胍的降血糖效果相近,可发挥极强的降血糖作用[40]。Li 等[41]从滇黄精中分离出了四种皂苷化合物,这几种皂苷类化合物对艾滋病病毒都具有不同程度的抑制作用。除此之外,黄精皂苷还具有改善记忆力、抗菌、抗癌、改善血清脂质代谢和治疗慢性抑郁等生物活性[15,40,42-44]。
2.3 黄精黄酮
黄酮类化合物具有抑菌效果,对大肠杆菌、伤寒沙门氏菌、弗氏志贺氏菌和金黄色葡萄球菌等菌有着较好的抑菌作用[45,46]。黄精中分离出的两种高异黄酮类化合物可诱导B 淋巴细胞瘤-2(B-cell Lymphoma-2,Bcl-2)发生磷酸化反应并促进癌细胞凋亡,并且阻滞G2/M 的细胞周期,达到抗癌作用[47]。除此之外,黄精黄酮还具有抗氧化以及抗炎等生物活性[27]。
3 黄精主要活性成分作用机制
3.1 黄精多糖对糖尿病小鼠的降血糖作用及机制
黄精多糖(PolygonatumsibiricumPolysaccharide,PSP)是提取自黄精的一种天然活性物质[64]。PSP 有着良好的降血糖活性[7]。体内胰岛素含量过低会导致人体产生肝脏胰岛素抵抗、肝糖原合成降低,并诱发糖尿病[65-67]。胰岛素在维持体内血糖平衡过程中发挥着关键的作用,而PSP 可促进胰岛素在平衡血糖过程中的信号传导。
PSP 对胰岛素受体底物 1(Insulin Receptor Substrate 1,IRS1)的表达有着一定的促进作用。胰岛素与肝脏细胞表面胰岛素受体结合,会导致IRS1 蛋白发生磷酸化。磷酸化后的IRS1 通过P85 蛋白激活磷脂酰肌醇3-激酶(Phosphatidylinositol 3-Kinase,PI3K ),并促进磷脂酰肌醇-4,5-二磷酸(Phosphatidylinositol-4,5-Bisphosphate,PIP2)磷酸化为3-磷酸磷脂酰肌醇(Phosphatidylinositol 3-Phosphate,PIP3),达到强化信号传导的作用。
PSP 有着上调 3-磷酸肌醇依赖蛋白激酶-1(3-Phosphoinositide-Dependent Protein Kinase-1,PDK1)和蛋白激酶B(Protein Kinase B,Akt)表达的作用,Akt 可通过调节磷脂酰肌醇1,2,3,4,5,-五磷酸(Phosphatidylinositol 1,2,3,4,5,-Pentaphosphate,PIP5K)蛋白的信号传导控制葡萄糖进出速率[68]。PIP3可促使PDK1 和Akt 向细胞膜附近区域靠近。PSP 可促进葡萄糖转运蛋白 2(Recombinant Glucose Transporter 2,GLUT-2)的表达。活化后的Akt 可通过磷酸化糖原合成酶激酶3β(Glycogen Synthase Kinase 3β,GSK3β)进而激活糖原合酶(Glycogen Synthase,GSY),达到促进细胞糖原合成的作用[69]。活化后的Akt 还可使Akt 底物蛋白160(AS160)失活,使葡萄糖转运体(GLUT4-Veside)抵达细胞表面,促进葡萄糖进入细胞。
Akt/P12K 信号通路被认为是胰岛素发生调控作用的关键靶点[70]。干预P13K-Akt 信号通路可起到降血糖的作用[71]。黄精多糖能上调GSYmRNA、Akt、IRS1、GLUT2、PDK1、PIP5K 等蛋白的表达,这也证明了黄精多糖能激活IRS1-P13K-PDK1-Akt 信号通路[72,73]。黄精多糖可激活P13K-Akt-GSK-3β-GSY 和P13K-Akt-PIP5K-GLUT2 信号通路提高细胞附近环境葡萄糖的摄取和利用,达到调节血糖的目的。
3.2 黄精多糖促进成骨细胞分化功效机制
黄精多糖的另一类生物活性是促进骨细胞分化。Wnt/LRP5/β-catenin信号通路是典型的Wnt信号通路。低密度脂蛋白相关蛋白5(Low Density Lipoprotein Associated Protein,LRP5)作为Wnt 受体和β-连环蛋白(β-catenin)上游基因在骨代谢和成骨效应中起着关键作用[74,75]。PSP 可激活并促进β-catenin 进入细胞核,与淋巴细胞增强结合因子 1(Lymphoid-Enhancer-Binding Factor1,LEF1)/转录因子1(Transcription Factor-1,TCF-1)结合,调节Wnt 应答基因的转录。LRP5 可以作为一个共同受体,与卷曲的蛋白结合细胞外Wnt 蛋白,从而稳定细胞内β-catenin[76]。PSP 可以通过Runx2 激活TCF-1 基因亚区的调控位点,直接促进Runt 相关转录因子2(Runt-Family Transcription Factor 2,Runx2)基因表达,促进成骨。
GSK-3β对β-catenin 稳定性的控制是Wnt 信号传导的核心。GSK-3β可抑制多种信号传导途径,如AP-1、CREB 和TCF/LEF 等活性。PSP 可激活并促进细胞外调节蛋白激酶(Extracellular Regulated Protein Kinases,ERK)表达,使得GSK-3β的表达受到抑制,从而激活β-catenin,并促进骨髓基质细胞中核β-catenin 蛋白的积累。这提供了一种可能的机制,ERK可通过PSP 处理增强GSK3b/β-catenn 信号级联,促进骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSC)的成骨细胞分化。
3.3 黄精皂苷抗炎机制
黄精皂苷是一种具有良好抗炎活性的天然活性物质[39]。小鼠腹腔巨噬细胞RAW264.7 是小鼠免疫的主要成员[77]。脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性菌外膜的主要成分,常用于建立炎症模型[78]。经LPS 刺激,RAW264.7 细胞中的iNOS 蛋白过度表达,导致NO、PGE2、IL-6、IL-1β和TNF-α等炎症因子大量产生[79]。环氧化酶2(Cyclooxygenase-2,COX-2)是COX 同工酶中的一种,是介导炎症反应的关键酶[80]。
在这一过程中,黄精皂苷可抑制LPS 对诱导型一氧化氮合酶(Inducible Nitric Oxide Synthase,iNOS)和COX-2 表达,亚硝酸盐和IL-6 的产生。并且,在黄精皂苷浓度较高时对TNF-α的释放有抑制作用。LPS 作用巨噬细胞后,活性氧(Reactive Oxygen Specie,ROS)的数量显著增加,线粒体膜电位降低。黄精皂苷对ROS 的产生有一定抑制作用,可抑制线粒体膜电位(Mitochondrial Membrane Potential,MMP)的降低,因此黄精皂苷对线粒体本身也起到保护作用。
黄精皂苷对LPS 诱导的磷酸化Kappaα/β抑制因子激酶(Inhibitor of Kappaα/βKinase,IKKα/β)、核因子κB 抑制蛋白α(Inhibitor of NF-κBα,IκB)和P65蛋白的表达有抑制作用,这说明核因子κB(Nuclear Factor Kappa-B,NF-κB)可能是抗炎免疫作用机制之一。NF-κB 是转录家族的核转录因子,在细胞免疫以及细胞炎症等方面发挥重要作用[81,82]。IKK 刺激IκB激活NF-κB,活化后的P65 蛋白转移至细胞核中与靶基因启动子区域结合。这导致大量促炎性靶因子转录,包括 TNF-α和 IL-6 等。丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)通路调控从增殖分化到细胞凋亡的多种过程[83,84],这些途径主要有ERK、P38 蛋白和C-Jun 氨基末端激酶(C-Jun N-Terminal Kinase,JNK)[85]。而黄精皂苷对磷酸化的p38MAPK、JNK 和ERK 的表达也具有抑制作用,这表明他们也参与了黄精皂苷的抗炎作用。以上研究说明黄精皂苷在细胞抗炎过程中起到了干预,对LPS刺激巨噬细胞引起的炎症有一定的治疗效果。
3.4 黄精凝集素诱导细胞凋亡机制
黄精凝集素是提取自黄精的一种甘露糖/唾液酸结合凝集素,孙婷婷等[21]研究表明黄精凝集素Ⅱ(PolygonatumcyrtonemaHua.LectinⅡ,PCL-2)有着促进细胞凋亡的生物活性。人前列腺癌LNCap 细胞系应用于前列腺的发展转移和药物筛选研究[86]。诱导肿瘤细胞自我凋亡是评价抗癌药物效果的重要指标[87]。
在前列腺细胞凋亡过程中,PCL-2 作用细胞后可显著提升ROS 积累和聚集。ROS 聚集被认为是细胞凋亡级联反应过程中最早发生的事件之一[88,89]。Zhang等[48]研究发现,黄精凝集素通过含半胱氨酸的天冬氨酸蛋白水解酶(Cysteinyl Aspartate Specific Proteinase,Caspase)依赖性途径诱导小鼠纤维肉瘤L929 细胞凋亡。黄精凝集素PCL-2 可通过提升ROS 积累间接激活Caspase 家族的凋亡执行因子,Caspase-3 是凋亡执行因子,一旦被活化,代表着细胞进入不可逆凋亡阶段[90,91]。除此之外,ROS 还可下调Bcl-2 水平以及上调BCL2 相关的X 细胞凋亡调节因子(BCL2 Associated X Apoptosis Regulator,Bax)以及B 淋巴细胞瘤-2 基因相关启动子(B-Lymphocytoma-2 Gene Related Promoter,BAD)的水平从而诱导细胞发生凋亡[92]。
伴随着细胞内黄精凝集素PCL-2 的浓度升高,Bax 基因的mRNA 和蛋白表达水平被上调,Bcl-2 基因的mRNA 及蛋白表达水平下降,进而使Caspase-3和Caspase-9 的蛋白表达量增加。这说明LNCap 细胞中的ROS 累积将引起Bax 和Bcl-2 蛋白水平变化,启动Caspase 级联反应,活化Caspase-9 和Caspase-3,诱导细胞不可逆性凋亡。
3.5 其他活性成分主要功效机制
黄精的一些小分子提取物有治疗阿尔茨海默症的功能活性。Wang 等[93]鉴定了335 种黄精代谢物,有关键的7 种成分被进一步鉴定为黄精的关键活性成分。乙酰胆碱酯酶(Acetylcholinesterase,AchE)是生物神经传导中的关键酶[94]。抑制分解乙酰胆碱(Acetylcholine,Ach)的酶AchE 是治疗阿尔茨海默症患者的一种有希望的策略。Aβ在阿尔茨海默症的发病机制中起着关键作用[95]。实验结果表明,7 种关键成分种的咖啡醇、异鼠李素和芦丁通过减少Aβ-阳性点的数量和炎性细胞因子的水平、抑制AChE 活性和增加抗氧化剂水平。
黄精有调节骨质疏松的生物活性。Zhao 等[96]分离纯化共获得12 个化学活性成分、84 个药物靶蛋白和84 个与药物和骨质疏松相关的常见靶点。通过分析确定关键靶点,使得潜在核心药物成分通过干预细胞增殖、凋亡和雌激素反应调节等生物学过程,调节低氧诱导因子1(Hypoxia Inducible Factor-1,HIF-1)信号通路、PI3K-Akt 信号通路、雌激素信号通路等通路,有着抗骨质疏松药理作用。分子对接的结果表明,调控网络中的关键靶点与相关活性成分具有高结合活性。黄精提取物可通过调节核心靶基因和作用于多种关键通路(如HIF-1 信号通路、PI3K-Akt 信号通路和雌激素信号通路)调节骨质疏松。
4 结语与展望
黄精作为我国历史悠久的“药食同源”植物,具有免疫调节、抗疲劳、抗氧化、降血糖、抗炎等多种生物活性,使其在药品研发、化妆品和新资源食品研发等领域具有广阔的应用前景。现有研究对黄精多糖,皂苷以及黄酮类物质的研究较多,而对黄精凝集素,木质素以及一些生物小分子的研究较少。尽管黄精在多糖以及皂苷上的生物活性开发取得了不错的进展,但黄精多糖提取率低,黄精皂苷的毒理作用等问题仍有待进一步深入研究。此外,黄精多糖,皂苷以及凝集素等活性物质的作用机制是多靶点、多途径、多效应的。在现有研究中,大量文献报道了黄精的生物活性及其机制,但主要是围绕着多糖,皂苷以及黄酮这几类物质的活性机制研究。而对于黄精的其他活性成分的活性机制报道较为罕见,有待进一步的研究发现。为了更加有效的开发黄精活性成分,今后可在传统分离纯化技术的基础上创新、完善分析,提取出纯度更高,种类更多的黄精活性物质。明确黄精活性成分的作用机制,深入探究不同产地,种属黄精与生物活性和机制间的关系。为全面健康的开发黄精产业资源提供支撑和参考依据。

