阿仑膦酸钠在萤石和方解石浮选分离中的作用及机理
熊晶晶,焦芬,胡俊杰,潘祖超,姚冬冬
(中南大学资源加工与生物工程学院,长沙 湖南 410006)
氟是一种重要的非金属化学元素,在建筑材料、化工、航空、陶瓷等工业领域都有广泛的应用[1]。萤石(CaF2)是一种典型的含氟矿物,是提取制备氟元素和生产氟化氢和三氟化硼等氟化物的主要原料[2-3]。随着萤石资源的不断消耗,萤石矿的品位越来越低,对于低品位萤石矿的开发利用成为了目前急需解决的问题。方解石是低品位萤石矿的主要脉石矿物,其表面存在大量的Ca2+质点,物理化学性质与萤石相似,这使得萤石与方解石的浮选分离存在困难[4-5]。因此,选择一种高效的抑制剂是实现萤石与方解石分离的关键。
常用的方解石抑制剂主要有酸化水玻璃等无机抑制剂,具有抑制作用强、价格低的优点。然而,无机抑制剂的选择性较差,对萤石也会产生一定的抑制效果。例如,酸化水玻璃中发挥抑制作用主要是H2SiO3胶粒,当酸化水玻璃用量较大时,多余的H2SiO3胶粒也会阻碍捕收剂在萤石表面吸附,从而使得萤石与方解石分离困难[6-8]。与无机抑制剂相比,有机抑制剂具有原料来源广泛、稳定性好、用量低的优点,近年来已成为方解石抑制剂的重要研究方向。国内外研究者经过大量研究发现,一些带有羟基、羧基和磷酸根等官能团的有机物通过在方解石表面吸附使其表面亲水,从而产生抑制效果,而且这些有机抑制剂对萤石可浮性影响较小,有利于萤石与方解石的浮选分离[9-11]。其中,有机膦酸在萤石浮选中的应用已有不少研究,并取得了较好的浮选效果[12-13]。阿仑膦酸钠也是一种有机膦酸盐,其分子结构见图1。考虑到阿仑膦酸钠对钙的亲和度较高,可能会对萤石和方解石的分离产生一定的影响,且目前尚无关于阿仑膦酸钠在浮选中应用的研究。本文研究的目的是通过纯矿物浮选实验确定阿仑膦酸钠对萤石和方解石浮选分离的影响,并利用接触角的测试、Zeta 电位的测试、红外光谱分析(FTIR)和电感耦合等离子体发射光谱分析(ICP)等检测手段研究其作用机理。
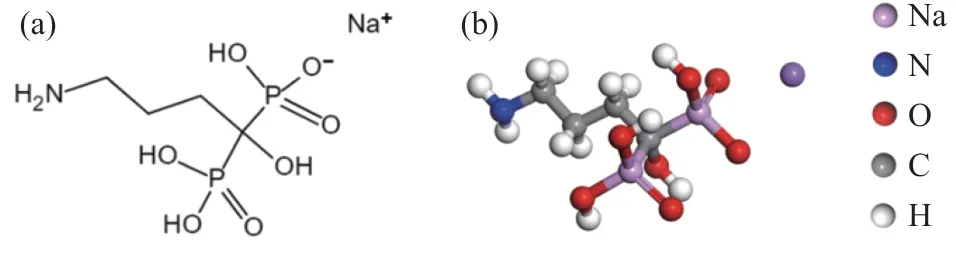
图1 阿仑膦酸钠的分子结构式(a)及其经密度泛函理论(DFT)计算后的优化构型(b)Fig.1 Molecular structure of alendronate sodium (a) and its optimized configuration after density functional theory (DFT)calculation (b)
1 实验样品和研究方法
1.1 实验样品和试剂
实验所用的萤石和方解石的纯矿物样品分别取自广西和湖南。将块矿用锤子砸碎后,手选出结晶较好的块矿,放入干净的陶瓷球磨罐进行细磨,并用标准筛将磨矿产品筛成三个粒级。+74 µm粒级返回球磨机再磨,-74+37 µm 粒级用于单矿物浮选实验,-37 µm 粒剂经玛瑙研磨至-2 µm 后,用于X 射线衍射分析(XRD)、Zeta 电位的测试、红外光谱分析(FTIR)和化学组成分析。图2 为萤石和方解石X 射线衍射分析结果。萤石与方解石的化学组成分析表明,两者的纯度分别为99.79%和99.85%,都达到了单矿物浮选的要求。
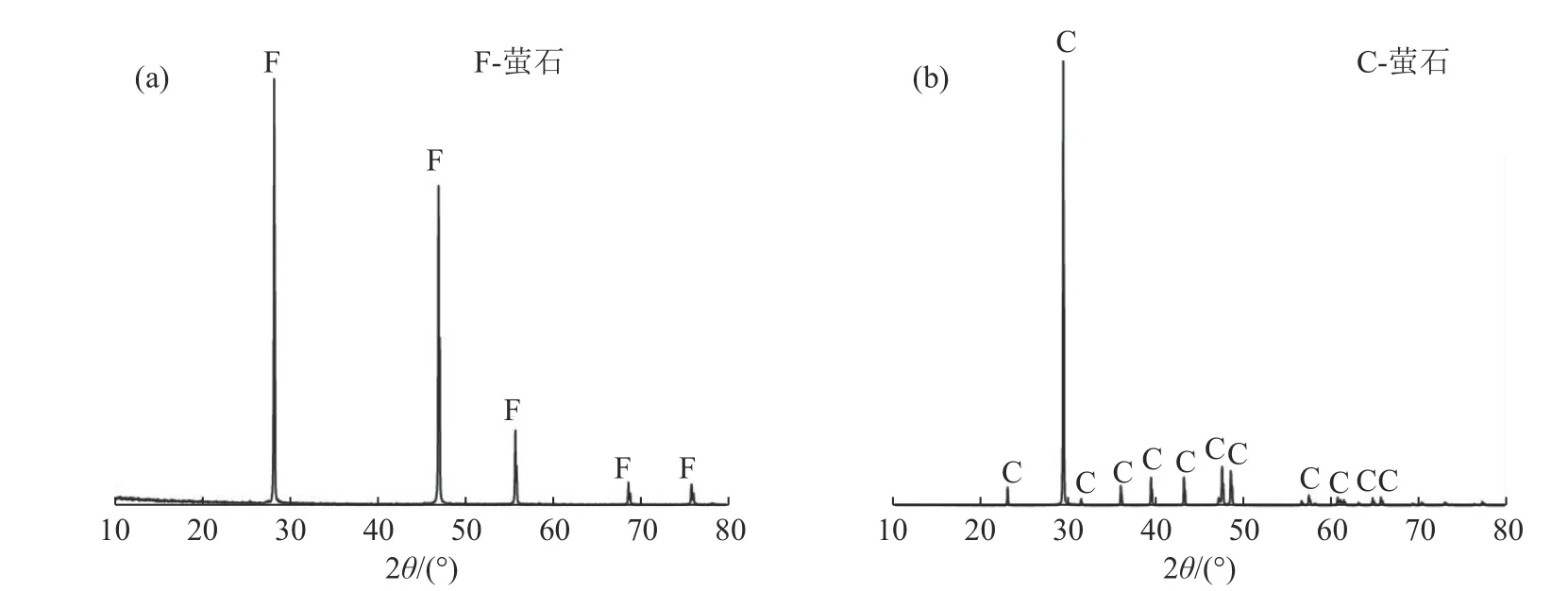
图2 萤石(a)和方解石(b)的XRDFig.2 XRD spectrums of the fluorite (a) and calcite (b) samples
本实验采用HCl 和NaOH 作为pH 值调整剂,油酸钠作为捕收剂。所有试剂均为分析纯,所有实验用水均为电阻率大于18.0 MΩ/cm 的去离子水。
1.2 单矿物浮选实验
选用XFG 型挂槽式浮选机进行浮选实验,并将其叶轮转速固定为1 992 r/min。每次实验,称取2 g 矿物样品加入到40 mL 浮选槽中,然后向浮选槽中加入35 mL 去离子水,搅拌均匀后测量矿浆pH 值,并用HCl 或NaOH 溶液将矿浆的pH 值调节到所需要的值后,依次加入抑制剂和捕收剂,等泡沫稳定后开始手动刮泡浮选。实验药剂的添加顺序和浮选时间见图3。
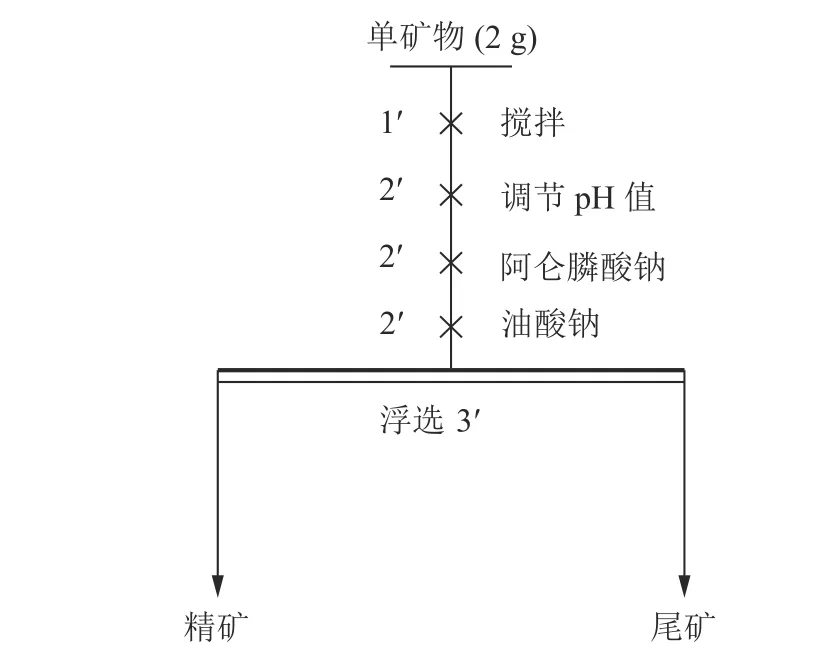
图3 单矿物浮选实验流程Fig.3 Flowsheet of micro-flotation experiment
浮选完成后,将得到的产品收集、过滤、烘干、称重。根据产品的干重计算浮选回收率。计算公式(1)如下:
式中ε代表浮选回收率;m1和m2分别为精矿和尾矿的干重(g)。为保证数据的准确性,每组单矿物浮选实验重复三次,并给出平均值和标准差。在人工混合矿浮选实验中,将萤石与方解石按重量比1∶1 混合作为原矿,并测定精矿和尾矿的CaF2含量,结合产率计算回收率。
1.3 吸附量测试
吸附量测试的样品制备过程如下:称取2 g 萤石或方解石放入100 mL 锥形瓶,加入40 mL 去离子水,按浮选实验顺序依次调节pH 值和加入一定量的阿仑膦酸钠,并将锥形瓶用保鲜膜密封后,置于恒温振荡箱(25 ℃)中振荡2 h,使药剂在矿物表面吸附。振荡完成后,取上清液离心10 min,用于吸附量测定。采用电感耦合等离子体发射光谱法(ICP)分析上清液中磷(P)的浓度。根据初始和最终P 浓度的差异,计算阿仑膦酸钠在矿物颗粒上的吸附量,公式(2)为:式中Γ 为阿仑膦酸钠在矿物表面的吸附量(mg/g);P0为药剂作用前上清液P浓度,P为药剂作用后上清液P浓度(mg/L);V为矿浆体积(L);m为矿物样品的重量(g);M0为阿仑膦酸钠分子中总磷原子的质量分数[14]。
1.4 接触角测试
首先,使用切割机将结晶较好的萤石和方解石单矿物晶体切割成尺寸为2.0 cm3×2.0 cm3×1.0 cm3的样品。然后用0.074、0.023、0.013、0.0065、0.0035 mm 砂纸按顺序依次对样品进行抛光,最终样品的表面粗糙度在0.05 µm 左右。每次实验前,用0.0035 mm 砂纸对萤石和方解石的样品进行再次打磨,再用配置好的浮选药剂溶液处理5 min,去离子水洗涤,真空干燥后进行接触角测量。用接触角测量仪,在单矿物晶体表面滴下一个直径约2 mm 的水滴,待稳定后用软件画出三相接触线,计算出接触角。每个样本重复测量三次,取三次测量结果的平均值。
1.5 Zeta 电位测试
每次实验,取-2 µm 纯矿物样品(40 mg)加入到35 mL 1×10-3mol/L KCl 电解质溶液中,按浮选实验顺序依次调节pH 值和添加浮选药剂,用磁力搅拌器搅拌均匀。搅拌结束后,自由沉降5 min,取上清液注入样品池,采用Zeta 电位分析仪测量矿物表面的Zeta 电位。每个样品的电位重复测量三次,计算平均值和标准差。
1.6 红外光谱测试
称取-2 µm 纯矿物样品(0.5 g),加入35 mL去离子水,按浮选实验顺序依次调节pH 值和添加浮选药剂,用磁力搅拌器搅拌30 min。搅拌后的矿浆经过滤后用相同pH 值的水清洗3 次,将滤饼放入真空烘箱中35 ℃烘干。采用红外分析仪对烘干后的样品进行分析,生成对应样品的红外光谱。FTIR 光谱扫描范围为4000~ 400 cm-1,测量分辨率为2 cm-1。
2 结果与讨论
2.1 阿仑膦酸钠对萤石与方解石浮选的影响
2.1.1 有无阿仑膦酸钠存在时矿浆pH 值对萤石和方解石浮选的影响
在油酸钠用量为30 mg/L,阿仑膦酸钠(如果有必要)用量为15 mg/L 的条件下,矿浆pH 值对萤石和方解石浮选回收率的影响见图4。由图4 可知,在只添加捕收剂的条件下,整个pH 值范围内,萤石和方解石的回收率均保持在80%以上。因此,如果不加抑制剂,很难通过浮选分离。添加阿仑膦酸钠后,方解石在pH 值 7.0~ 12.0 时被抑制,回收率低于20%。然而阿仑膦酸钠的加入对萤石的可浮性几乎没有影响,在较低的pH 值(7.0~9.5)下,萤石的浮选回收率仍保持在80%左右。在阿仑膦酸钠存在的条件下,pH 值为9.0 时萤石和方解石的可浮性差异较大,这为萤石和方解石的分离提供了可能。
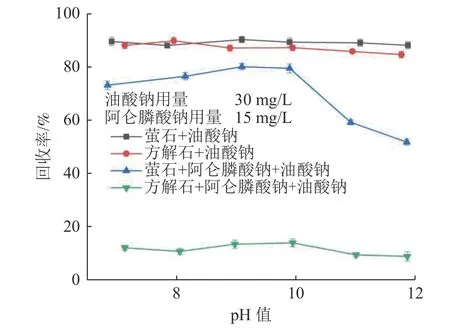
图4 有无阿仑膦酸钠存在时矿浆pH 值对萤石和方解石回收率的影响Fig.4 Effect of pH value on the recovery of fluorite and calcite with and without alendronate sodium
2.1.2 阿仑膦酸钠用量对萤石和方解石浮选的影响
在pH 值为9.0,油酸钠用量为30 mg/L 的条件下,阿仑膦酸钠用量对萤石和方解石浮选回收率的影响见图5。由图5 可知,随着阿仑膦酸钠用量的增加,方解石浮选回收率急剧降低,当阿仑膦酸钠浓度为30 mg/L 时,方解石的回收率降至13.5%。当阿仑膦酸钠用量较低时,对萤石的抑制作用较弱;当阿仑膦酸钠浓度超过15 mg/L,对萤石的抑制效果明显增强。综合考虑,在阿仑膦酸钠浓度为15 mg/L 左右可实现萤石和方解石的浮选分离。
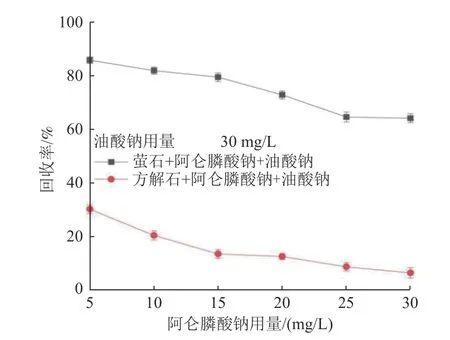
图5 阿仑膦酸钠用量对萤石和方解石浮选回收率的影响Fig.5 Effect of alendronate sodium concentration on the recovery of fluorite and calcite
2.1.3 阿仑膦酸钠对萤石-方解石人工混合矿浮选分离的影响
为了验证阿仑膦酸钠对萤石及方解石的分离效果,在单矿物浮选较优条件下,进行了人工混合矿浮选实验。原矿萤石品位为49.63%,在阿仑膦酸钠用量为15 mg/L 时(pH 值=9),获得精矿产率为46.90%,其中萤石品位可达75.5%,回收率达71.35%,表明阿仑膦酸钠对方解石产生了选择性抑制作用,浮选分离效果较好。
2.2 吸附量测试结果
阿仑膦酸钠在萤石和方解石表面的吸附对其发挥抑制作用非常重要,阿仑膦酸钠在萤石和方解石表面的吸附行为见图6。由图6 可知,阿仑膦酸钠在萤石和方解石表面均有吸附,且阿仑膦酸钠在萤石和方解石表面的吸附量随其初始浓度的增加而增加。但阿仑膦酸钠在方解石表面的吸附量明显高于萤石表面。说明阿仑膦酸钠对方解石的抑制作用强于萤石,这与单矿物浮选实验的结果基本一致。
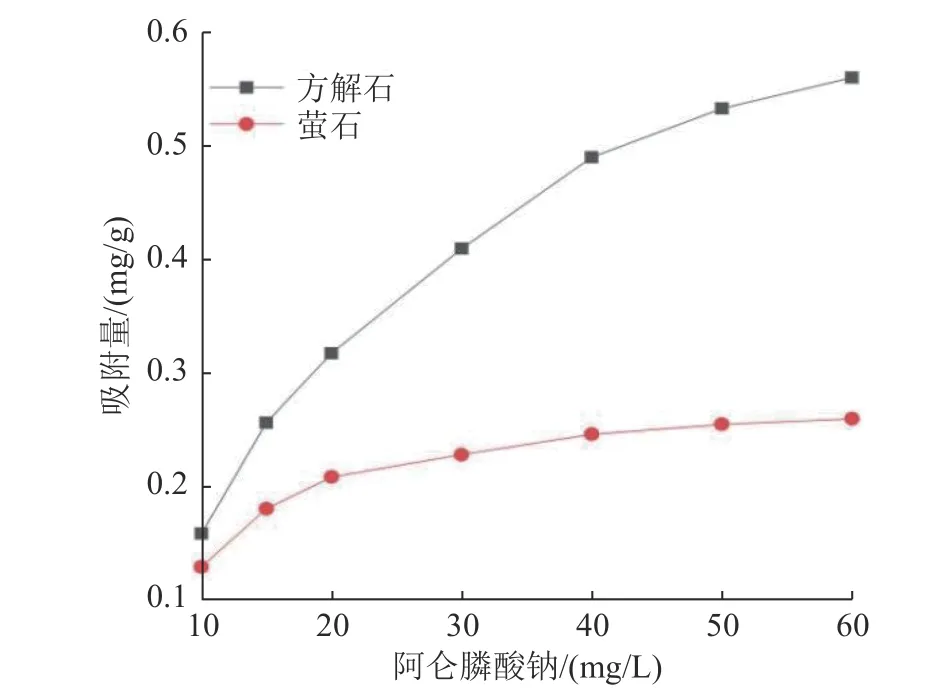
图6 阿仑膦酸钠在萤石和方解石表面的吸附行为Fig.6 Adsorption behavior of alendronate sodium on fluorite and calcite
2.3 接触角测试结果
接触角是测量液体在矿物表面润湿性的一个重要参数。接触角越小,矿物表面越亲水,越容易被液体润湿。相反,接触角越大,矿物表面越疏水,矿物一般具有良好的可浮性[15]。在pH 值为9.0 的条件下,对药剂处理前后的萤石和方解石表面接触角进行测量。由测量结果可知,在药剂处理前,萤石的接触角为48.1°,表明其具有一定的亲水性。仅使用油酸钠处理后,接触角显著增加至97.01°,表明油酸钠在萤石表面的吸附增强了萤石的疏水性。在依次用阿仑膦酸钠和油酸钠处理后,萤石表面接触角基本保持不变(从97.01°到91.38°),说明阿仑膦酸钠对萤石表面润湿性影响不大。
在药剂处理前,方解石的接触角为37.46°,表明其疏水性较差。单独使用油酸钠处理时,方解石表面的接触角上升到84.92°,这是由于油酸钠在方解石表面吸附导致疏水性增强造成的。在依次用阿仑膦酸钠和油酸钠处理后,方解石表面接触角降低至54.02°,说明阿仑膦酸钠处理增强了方解石的亲水性。阿仑膦酸钠存在时萤石和方解石的表面润湿性存在明显差异,进一步证明阿仑膦酸钠对方解石的选择性抑制作用。
2.4 Zeta 电位测试结果
在油酸钠和阿仑膦酸钠(如果有必要)用量分别为30 mg/L 和15 mg/L 条件下,萤石和方解石表面Zeta 电位随pH 值的变化见图7。
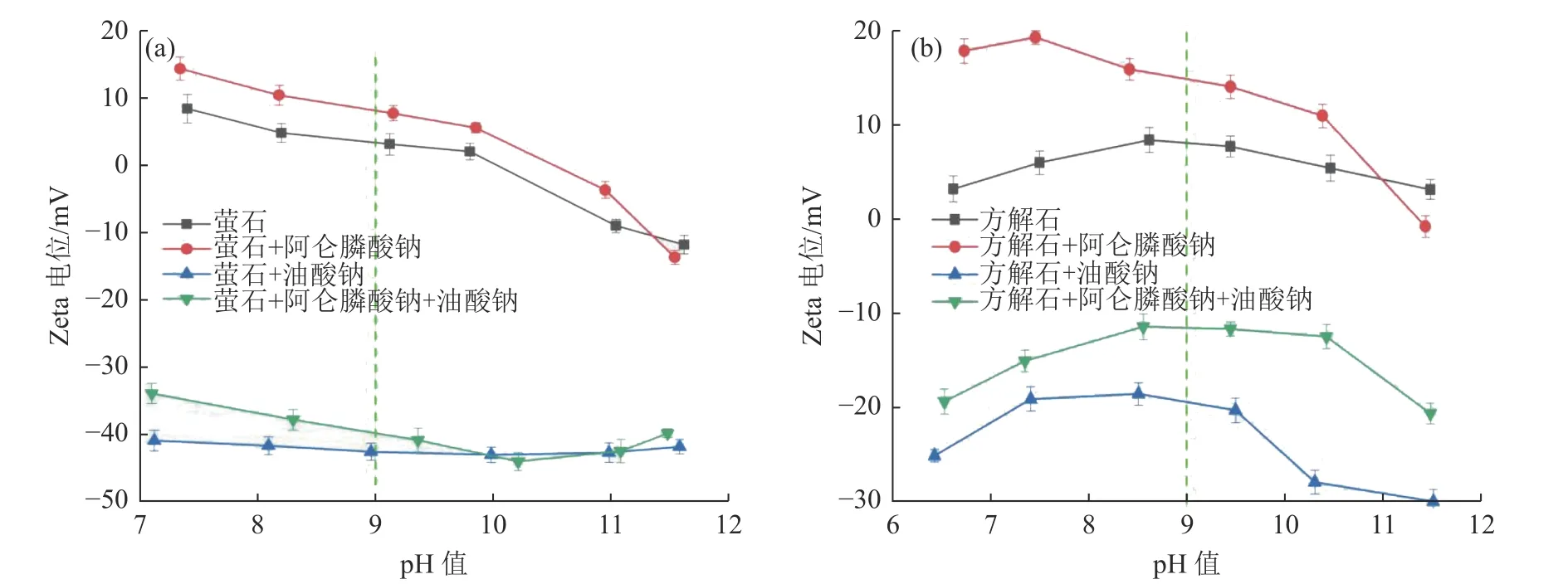
图7 不同药剂制度下pH 值对萤石(a)和方解石(b)表面Zeta 电位的影响Fig.7 Effect of pH value on Zeta potential on fluorite (a) and calcite (b) surface in different reagent regimes
由图7(a)可知,在不添加药剂的条件下,在pH 值为10.0 左右出现萤石的零电点,且随着pH 值的增加,萤石表面的Zeta 电位逐渐降低,这与前人的研究一致[16-17]。由于阿仑膦酸钠的分子式中有一个氨基(-NH2),它会与水中H+结合并带正电。在单独添加阿仑膦酸钠后,萤石表面的Zeta 电位曲线整体正向迁移。pH 值为9.0 时,萤石表面的Zeta 电位由3.30 提高到8.09,提高了5.79 mV,表明萤石表面吸附了一定量的阿仑膦酸钠分子。在单独添加油酸钠后,萤石表面的Zeta电位曲线整体负向迁移。通过对油酸钠溶液的浮选溶液化学分析可知,在中性或碱性条件下,带负电荷的ROO-和(ROO-)22-是溶液中的主要组分[18]。因此,添加油酸钠后萤石表面与带负电荷的ROO-和(ROO-)22-之间存在强烈的静电吸附作用。在按顺序添加阿仑膦酸钠和油酸钠后,萤石表面的Zeta 电位较单独添加油酸钠时略有变化。结果表明,阿仑膦酸钠的加入对油酸钠在萤石表面的吸附影响较小。
由图7(b)可知,在所研究的pH 值范围内,方解石的零电点不存在,方解石表面的Zeta 电位随pH 值的增大先增大后减小,这与之前的研究一致。因为在弱碱性环境中,局域Ca2+的浓度大于CO32-,所以方解石的Zeta 电位为正[19]。在单独添加阿仑膦酸钠后,方解石表面的Zeta 电位曲线整体正向迁移,这与萤石的结果一致。而在pH 值为9.0 时,方解石的Zeta 电位升高了6.87 mV 大于同等条件萤石升高的幅度,表明阿仑膦酸钠在方解石表面的吸附强度大于萤石。在按顺序添加阿仑膦酸钠和油酸钠后,在pH 值为9.0 时,方解石的Zeta 电位比单独添加油酸钠提高了7.94 mV。表明阿仑膦酸钠在方解石表面的预吸附阻碍了捕收剂油酸钠的进一步吸附。
2.5 红外光谱分析结果
油酸钠和阿仑膦酸钠的红外光谱见图8。由图8 可知,油酸钠在2 921.46 cm-1和2 852.53 cm-1处产生的吸收峰分别是油酸分子中-CH2-和-CH3的伸缩振动峰,在1 557.85 cm-1和1 442.61 cm-1处的吸收峰是由于-COO-对称伸缩振动引起的[20]。在阿仑膦酸钠的红外光谱中,在1 126.88 cm-1、1 063.4 cm-1和867.78 cm-1处产生的吸收峰分别是P=O、P -O 和P -O -P 的特征峰,3477.1 cm-1处的吸收峰则是-OH 的伸缩振动峰[21]。
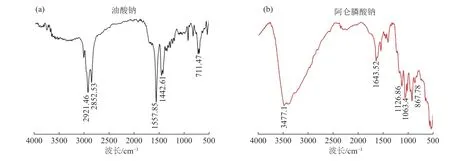
图8 油酸钠和阿仑膦酸钠的红外光谱Fig.8 FTIR spectra of NaOL and alendronate sodium
在pH 值为9.0 条件下,萤石和不同药剂作用前后的红外光谱见图9(a)。由图9(a)可知,在经过油酸钠单独处理后,在2 927.15 cm-1和2 860.46 cm-1处出现了从2 921.46 cm-1和2 852.53 cm-1处平移过来的-CH2-和-CH3的特征峰,表明油酸钠在萤石表面产生了吸附。在经过阿仑膦酸钠单独处理后,未观察到新的吸收峰,说明阿仑膦酸钠难以吸附在萤石表面。在依次用阿仑膦酸钠和油酸钠处理后,-CH2-和-CH3平移至2932.28 cm-1和2861.38 cm-1处,这些结果进一步说明阿仑膦酸钠既不能大量吸附在萤石表面,也不能阻碍油酸钠在萤石表面的化学吸附。因此,在油酸钠前添加阿仑膦酸钠对萤石的可浮性影响不大。
在pH 值为9.0 条件下,方解石和不同药剂作用前后的红外光谱见图9(b)。由图9(b)可知,在经过油酸钠单独处理后,方解石红外光谱曲线上出现了-CH2-和-CH3的特征峰,表明油酸钠能够吸附在方解石表面。在经过阿仑膦酸钠单独处理后,在1 086.32 cm-1和963.29 cm-1处出现了从1 063.4 cm-1和867.78 cm-1处平移过来的P=O 和P -O 的特征峰,表明阿仑膦酸钠上的P=O 和P -O 在与方解石作用后发生了化学变化,其在方解石表面的吸附以化学吸附为主。在依次用阿仑膦酸钠和油酸钠处理后,与单独用油酸钠处理相比,-CH2-和-CH3的特征峰减弱,表明阿仑膦酸钠的预处理会干扰油酸钠在方解石表面的吸附。因此,证明了阿仑膦酸钠对方解石的选择性抑制作用。
2.6 阿仑膦酸钠的抑制机理及吸附模型
与现有抑制剂相比,阿仑膦酸钠具有用量小、无污染和选择性高的优点,在萤石和方解石的分离浮选中具有广阔的工业应用前景。根据浮选实验和机理研究的结果,给出了阿仑膦酸钠在萤石和方解石表面的吸附模型,见图10。
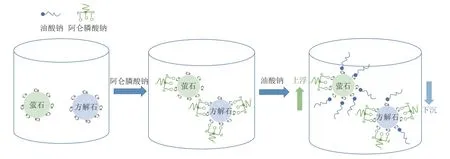
图10 阿仑膦酸钠在萤石和方解石表面的吸附模型Fig.10 Schematic of adsorption model of alendronate sodium on fluorite and calcite
由机理研究可知阿仑膦酸钠抑制机理主要包括以下两点:
(1)从阿仑膦酸钠结构式分析,其结构式中存在亲水的极性基(-OH)。在阿仑膦酸钠中所含的P=O 和P -O 与方解石表面的Ca2+质点结合后,阿仑膦酸钠分子以化学吸附的形式吸附于方解石表面,而未与方解石作用的-OH 将使得矿物表面呈现亲水性。从图6、7 可以看出,阿仑膦酸钠在萤石表面的吸附较少,所以萤石表面的润湿性几乎不受阿仑膦酸钠的影响。
(2)阿仑膦酸钠在方解石表面吸附后使得方解石表面的Ca2+减少,从而阻碍油酸钠在方解石表面的吸附。因此,在方解石表面油酸钠吸附量减少,方解石颗粒下沉到浮选槽底部。而萤石表面仅有少量阿仑膦酸钠吸附,对油酸钠的进一步吸附影响较小,萤石颗粒上浮。最终实现了萤石与方解石的浮选分离。
3 结论
(1)在实验研究的pH 值范围内,萤石和方解石的可浮性相近,不添加抑制剂两者的分离难以实现。在添加阿仑膦酸钠后,相同条件下萤石和方解石的可浮性出现差异,这使得萤石与方解石的分离成为可能。
(2)吸附量和接触角实验结果表明,阿仑膦酸钠在方解石表面的吸附量大于在萤石表面的吸附量。阿仑膦酸钠在方解石表面的吸附增强了方解石的亲水性,加大了萤石和方解石可浮性的差距。
(3)阿仑膦酸钠以化学吸附的形式吸附于方解石表面,且阻碍了油酸钠在方解石表面的吸附,使得方解石可浮性变差。

