借助特殊点,巧解酸碱中和滴定图像问题
王建兵
(甘肃省天水市甘谷县第二中学)
在解答酸碱中和滴定问题时,学生要具有较强的计算能力,还要充分理解整个反应过程,思考每个阶段的反应方程式.为帮助学生快速掌握酸碱中和滴定图像问题,本文将以特殊点为核心,探究其解题规律.
1 酸碱中和滴定图像中的特殊点
酸碱中和滴定图像题意在考查学生的读图、析图和知识的迁移应用能力.弄清楚酸碱中和滴定图像中的特殊点,是学生准确解答此类试题的关键.下面以NaOH 溶液滴定一元酸HA 溶液的滴定曲线为例,介绍酸碱中和滴定图像中的特殊点及相应的知识.
室温时用 0.100 mol•L-1NaOH 溶液滴定20mL 0.100 mol•L-1HA 溶液,滴定曲线如图1所示.
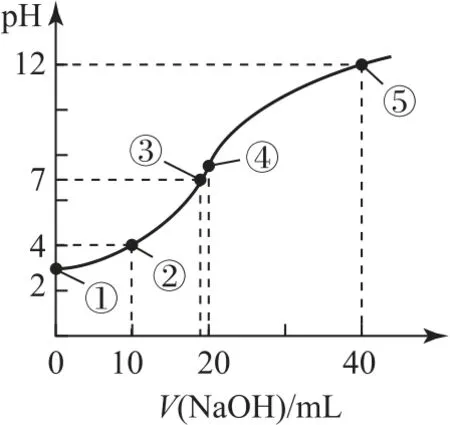
图1
①为反应起点,此时溶质为HA,各微粒浓度之间的关系为
电荷守恒:
②为半反应点,此时的溶质为HA 与NaA,且二者的物质的量相等,各微粒浓度之间的关系为
电荷守恒:
物料守恒:
质子守恒:
③为中性点,此时的溶质为HA 与NaA,但NaA的含量较高,各微粒浓度之间的关系为
电荷守恒:
④为完全反应点,此时溶质为NaA 溶液,各微粒浓度之间的关系为
电荷守恒:
物料守恒:
质子守恒:
⑤为过量一倍点,此时溶质为等物质的量的NaOH 和NaA 溶液,各微粒浓度之间的关系为
电荷守恒:
物料守恒:
质子守恒:
2 题型解读
2.1 强酸与强碱或弱碱的滴定
强酸与强碱的滴定比较基础,在近年高考中出现频率较低,但掌握此知识有利于理解其他滴定反应.对于强酸与弱碱的滴定,正确分析弱碱在溶液中的电离是关键,明确所给图像中各点溶液中溶质的成分及性质是核心,熟练运用电离平衡常数进行计算是保障.
例1常温下,用0.2 mol•L-1盐酸滴定25.00 mL0.2mol•L-1NH3•H2O 溶液,所得溶液的pH、和NH3•H2O 的物质的量分数与滴加盐酸体积的关系如图2所示.下列说法不正确的是( ).
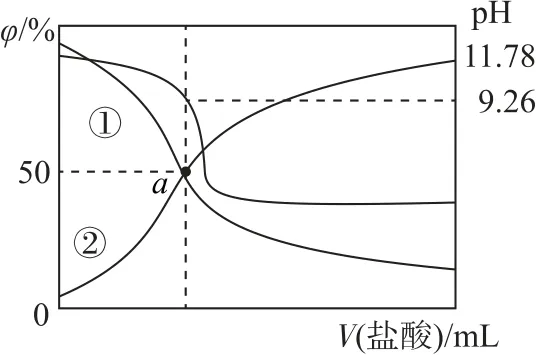
图2
A.曲线①代表φ(NH3•H2O)
B.当溶液显中性时,滴入盐酸的体积小于25mL
C.NH3•H2O 的电离常数的数量级为10-4
D.a点溶液中存在
随着V(HCl)的增大,溶液中c(NH3•H2O)减小、增大,则溶液中增大、φ(NH3•H2O)减小,故曲线①代表φ(NH3•H2O),选项A 说法正确.氯化铵溶液呈酸性,要使混合溶液呈中性,氨水应稍过量.酸碱浓度相等且都是一元的,要使氨水过量,盐酸体积应小于25mL,选项B说法正确.当时,,溶液的pH=9.26,故
NH3•H2O 的电离常数
故电离常数的数量级为10-5,选项C 说法错误.由图可知,a点,溶液的pH>7,则c(OH-)>c(H+),溶液中存在电荷守恒:
选项D 说法正确.答案为C.
2.2 强碱与强酸或弱酸的滴定
在新高考背景下,高考化学试题主要考查学生的创新能力和深度思维能力,对于具体的电离过程不会深入考查,但会联系生产生活实际或科技前沿,考查学生应用电离平衡、物料守恒、元素守恒等化学理论解决实际问题的能力.
例2已知pKa=-lgKa,25 ℃时,H2R 的pKa1=1.85,pKa2=7.22.用0.1000mol•L-1NaOH溶液滴定20.00 mL H2R 溶液,溶液中H2R、HR-、R2-的分布分数δ随pH 变化曲线及滴定曲线如图3所示(忽略滴定过程中温度的变化).下列说法中错误的是( )[如 R2-分布分数:δ(R2-)=.

图3
A.两次突变,应选用不同的指示剂
B.pH=8时:c(Na+)>c(R2-)>c(HR-)
C.b点溶液的pH 约为4.54
D.c2(HR-)<c(R2-)•c(H2R)
根据图像可知,第一次滴定突变时溶液呈酸性,所以可以选择甲基橙作指示剂,第二次滴定突变时溶液呈碱性,所以可以选择酚酞作指示剂,选项A 说法正确.根据图像可知,pH=8时,溶液中含有Na2R 和NaHR,此时δ(R2-)>δ(HR-),则
选项B说法正确.b点时,加入20 mL0.1000 mol•L-1NaOH 溶液,此时溶液为NaHR 溶液,浓度为=0.05 mol•L-1,H2R 的pKa1=1.85,pKa2=7.22,则
选项C说法正确.
则c2(HR-)>c(R2-)•c(H2R),选项D 说法错误.答案为D.
综上所述,解答酸碱中和滴定图像问题时,一定要抓住图像中存在的关键点,判断出该点的溶质、存在的离子及含量、相关的守恒式等,以此为出发点,再去验证各个选项,解题就会变得容易.
(完)

