例析高考中的分布分数
施晓雅
(安徽省郎溪中学)
在分析化学中,酸碱以各种形式存在的平衡浓度与其分析浓度的比值,即各种酸碱组分在总浓度中所占分数称为分布分数,又称分布系数,用符号δ表示.分布分数能定量、动态、直观地表明溶液中各种组分随外界条件变化的分布情况,在近年的高考及模拟考试中分布分数出现的频率很高,是备受青睐的考点.
1 基本模型建构
1.1 一元弱酸的分布分数
以一元弱酸醋酸(HAc)为例:HAc⇌H++Ac-,电离平衡常数为
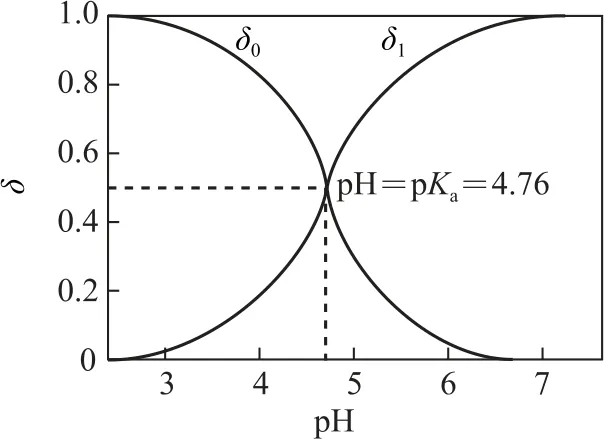
图1
根据图像可得,在某温度下Ka一定时,δ(HAc)、δ(Ac-)与pH 有关,pH 增大时,δ(Ac-)增大,δ(HAc)减 小.当pH=4.76,δ(HAc)=δ(Ac-)=0.5 时,c(HAc)=c(Ac-),根据Ka=可得,Ka=c(H+),故pH=pKa=4.76,pH<pKa时,c(HAc)>c(Ac-),pH>pKa时,c(HAc)<c(Ac-).
1.2 多元弱酸的分布分数
以二元弱酸草酸(H2C2O4)为例:H2C2O4⇌,电离平衡常数为
草酸的分布分数与pH 关系如图2所示.
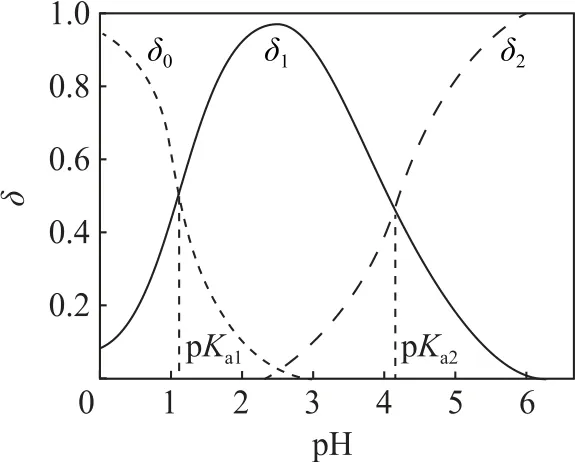
图2
δ0=δ(H2C2O4),δ1=δ(),δ2=δ(),pH=pKa1时,c(H2C2O4)=c(),pH=pKa2时,c()=c()(推导过程同1.1),δ0+δ1+δ2=1.
总结提升1)酸碱组分的分布分数δ取决于Ka、Kb、c(H+),而与其总浓度无关;2)分布分数图中曲线相交点(仅限2种组分)δ相等,2种组分浓度相等,Ka=c(H+),pH=pKa;3)任何酸碱组分的δ0+δ1+δ2+…=1;4)可以根据δ求出某组分平衡时的浓度.
2 分布分数在高考试题中的考查
2.1 根据分布分数变化图书写主要的反应
例1氯化铜溶液中含铜物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图3所示.
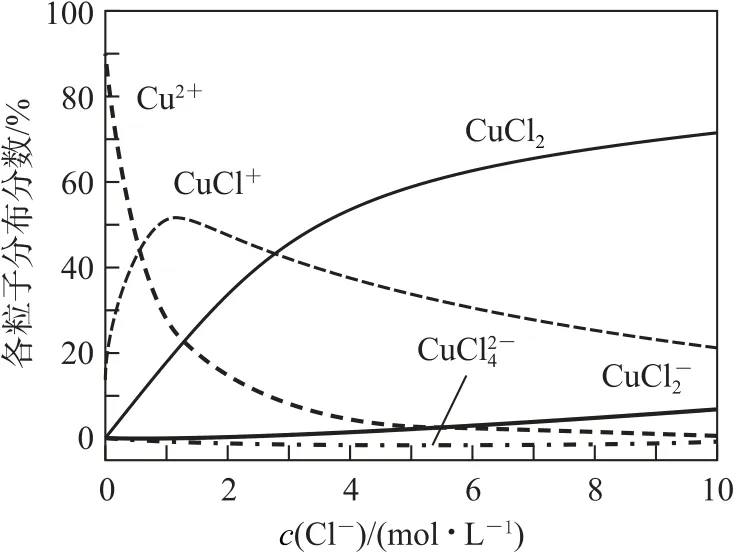
图3
(1)当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为_________.
(2)在c(Cl-)=1 mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为________(任写一个).
分析(1)由图可知,当c(Cl-)=9mol•L-1时,溶液中主要的3 种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c().(2)由图可知,在c(Cl-)=1mol•L-1的氯化铜溶液中,主要方程式为Cu2++Cl-CuCl+;CuCl++Ag+=AgCl↓+Cu2+(或CuCl2+Ag+=CuCl++AgCl↓;CuCl2+2Ag+=Cu2++2AgCl↓).
总结提升分布分数与pH 的关系图与其他图像题一样都遵循如下解题策略:要读懂图像、图表信息.一看面,分清横、纵坐标所认识的物理量;二看线,通过曲线的斜率准确认识变化的趋势,结合规律,能解释曲线变化背后的原因;三看点,把握起点、终点及交叉点所对应的数值.然后根据分布分数变化图书写主要的反应:根据题干给定的条件及分布分数曲线的走向,判断微粒的变化及在该条件下微粒的主要存在形式,分析微粒转化的原因及所发生的反应,正确书写反应方程式.
2.2 根据分布分数变化图判断粒子组成及浓度关系
例2有机二元弱碱(RN2H4)在水中的电离原理类似于氨.常温下,向0.1 mol•L-1R(NH2)2溶液中滴加0.1mol•L-1稀盐酸,溶液中含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH 的变化曲线如图4所示.下列叙述正确的是( ).
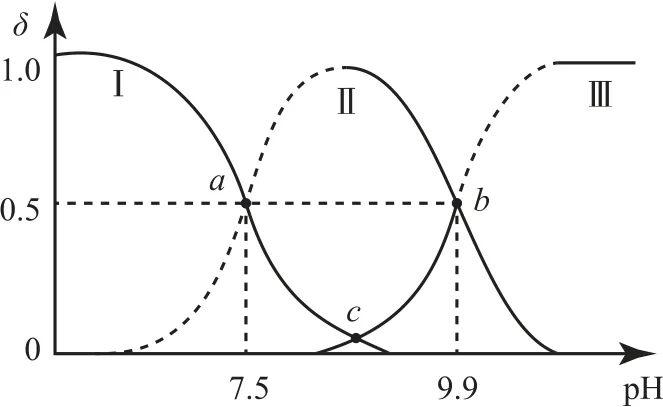
图4
A.图中交点a对应溶液中c(RN2H+5)=0.05 mol•L-1
B.RN2H4的第一步电离常数Kb1的数量级为10-8
C.RN2H5Cl溶液显酸性
D.图中交点c对应溶液的pH=8.7
分析溶液碱性越强,溶液中RN2H4浓度越大,随着盐酸的加入先转化为,后转化为,所以曲线Ⅰ表示,曲线Ⅱ表示,曲线Ⅲ表示RN2H4.a点表示加入盐酸后溶液中的,但由于加入盐酸导致溶液体积发生变化,所以<0.05 mol•L-1,选项A 错误.b点对应的溶液中c(RN2H4)=,pH=9.9,c(OH-)=10-4.1mol•L-1,故
数量级为10-5,选项B 错误.同理可计算RN2H4的第二步电离常数Kb2=10-6.5,RN2H+5的水解常数为,小于其电离常数,所以RN2H5Cl溶液显碱性,选项C错误.结合电离常数的表达式得
交点c对应溶液中c(RN2H4)=,所以c点对应溶液中Kb1×Kb2=c2(OH-)=10-10.6,所以c(OH-)=10-5.3mol•L-1,pH=8.7,选项D 正确.答案为D.
总结提升这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度.解题的关键是运用物料守恒、电荷守恒和质子守恒原理计算相关离子浓度大小.
综上所述,涉及分布分数该类题综合性强,难度较大,在备考时抓住分布分数图像的特点,把握命题角度,掌握解题方法,灵活运用所学知识将会提高该类试题的答题准确率.
(完)

