考试新视角
——速率常数
李丹丹
(安徽省临泉第一中学)
速率常数(k)是大学化学中的一个概念,近几年成为化学考试一个重要知识点.速率常数是指在给定温度下,反应物浓度皆为1mol•L-1时的反应速率.速率常数与浓度无关,受温度、催化剂、固体表面性质等因素的影响,但温度对化学反应速率的影响是显著的,速率常数是温度的函数,在相同的浓度条件下,可用速率常数大小来比较化学反应速率的快慢.
1 速率常数的计算
对于反应aA(g)+bB(g)⇌cC(g)+dD(g),v=k•ca(A)•cb(B)(k为速率常数).试题中通常给出几组反应物的浓度与反应速率数据,要求计算该反应的速率常数,这时就要根据速率常数的定义进行计算.
例1丙酮的碘代反应:CH3COCH3+I2→CH3COCH2I+HI,速率方程为
其中v为反应速率,k为速率常数,c(X)为反应物X的浓度,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.7/k.改变反应物浓度时,反应的瞬时速率如表1所示.

表1
(1)该反应的速率常数k的数值为_________.
(2)在过量的I2存在时,反应掉87.5% 的CH3COCH3所需的时间是_________min.
分析(1)由实验1得1.4=k•0.25m•0.05n,由实验2得2.8=k•0.5m•0.05n,可知m=1;由实验4得2.8=k•0.5m•0.1n,可知n=0.将m=1、n=0代入实验3,可得k=5.6×10-3min-1.
(2)经历一个半衰期所需时间为
反应掉87.5%的CH3COCH3,相当于该反应经历了3个半衰期,所需的时间是125min×3=375min.
由化学反应速率及反应物的浓度计算速率常数一般是利用表中给出的数据列方程组进行计算.
2 由速率常数图像计算反应的活化能
一般情况下速率常数与反应的温度有关,但活化能是影响化学反应速率的一个因素,因此速率常数也与活化能有一定的联系.化学试题中通过速率常数图像可以计算反应的活化能,比较反应的快慢.
例2反应的lgk与的关系如图1所示.该反应机理如下:
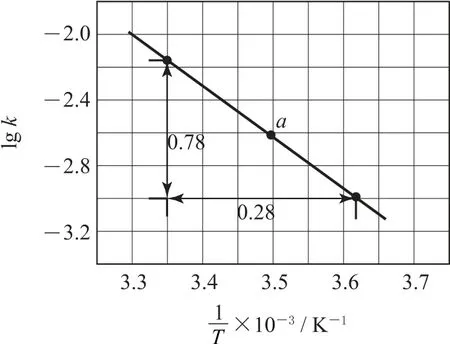
图1
②________(快);
A.Ea≈53.2kJ•mol-1
B.当使用催化剂时,同温下a点上移
C.反应②为S2O8I3-+I-→+I2
分析由题中给出的图示信息可知,直线a的斜率为,解得Ea≈53.2kJ•mol-1,选项A 说法正确.当使用催化剂时,同温下反应的活化能Ea减小,则图中直线的斜率增大,故a点上移,选项B 说法正确.根据题干总反应,再结合反应①和③可知,反应②为,选项C 说法正确.由题干可知,反应①为慢反应,反应②③均为快反应,故反应①为决速步,但k仅仅是温度的函数,故增大,k不变,v加快,选项D 说法错误.答案为D.
从速率常数与温度、活化能的表达式可以看出:1)温度越高,速率常数越大.2)相同温度下活化能越大,速率常数越小.3)速率常数是的函数,由直线的斜率可以计算活化能.4)使用催化剂可以降低反应的活化能,速率常数增大.5)物质的浓度与速率常数无关.6)化学反应机理分多步进行,总反应是该多步反应的总化学方程式.
3 由速率常数进行化学平衡的计算
速率常数表示在一定温度下反应物浓度与速率的关系,而化学平衡常数是表明化学反应限度的一个特征值,速率常数与化学平衡常数都与物质的浓度有关,因此可以借助一定条件下速率常数不变进行化学反应速率的计算.
例3用CO2制备甲醇可实现碳循环.已知反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)的v正=k正•p(CO2)•p3(H2),v逆=k逆•p(CH3OH)•p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=总压×物质的量分数).在540K下,按初始投料比n(CO2)∶n(H2)=3∶1、n(CO2)∶n(H2)=1∶1,得到不同压强条件下H2的平衡转化率关系图(如图2).
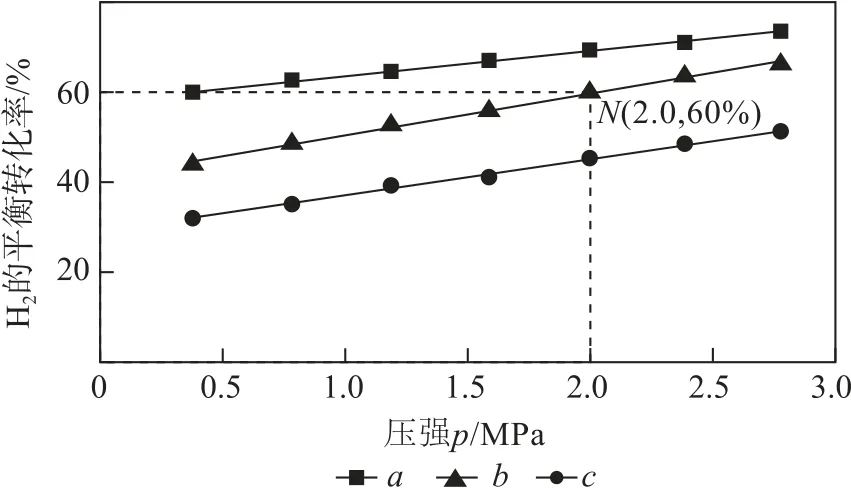
图2
(1)a、b、c各曲线所表示的投料比由大到小的顺序为________(用字母表示).
(2)N点在b曲线上,540K 时的压强平衡常数Kp=____(MPa)-2(用平衡分压代替平衡浓度计算).
(3)540K 条件下,某容器测得某时刻p(CO2)=0.2 MPa,p(H2)=0.4 MPa,p(CH3OH)=p(H2O)=0.1Mpa,此时=____(保留两位小数).
分析(1)相同温度、相同压强下,CO2与H2的物质的量比越小,H2转化率越小,a、b、c各曲线所表示的投料比由大到小的顺序为a>b>c.
(2)N点在b曲线上,CO2与H2的物质的量比为1∶1,故
540K 时的压强平衡常数为
1)压力常数用反应混合物中各物质的分压代入平衡常数表达式中计算,物质的分压=物质的量分数×总压.2)计算反应中,要先通过平衡时各物质的量浓度计算.
总之,速率常数的考查是考试的新方向,要了解速率常数只与温度有关,与物质的浓度无关,计算速率常数往往给出一组数据列方程计算;由速率常数计算反应的活化能则要依据题中给出的公式和图像进行计算;由速率常数计算正、逆反应速率之比,则要根据平衡时速率常数的比值进行计算.
(完)

