不同抗菌药物对幽门螺杆菌感染合并消化性溃疡的治疗效果及对微生物菌群的影响
陈 超
消化性溃疡是一种常见的消化系统疾病,是指在各种致病因子的相互作用下,黏膜出现的炎症反应与脱落、坏死形成的溃疡[1-2]。大多数消化性溃疡是由于胃肠道黏膜被胃蛋白酶或胃酸自身消化而引起的。该病可出现在胃、食管、十二指肠等位置,其中胃溃疡与十二指肠溃疡最为常见。据不完全统计,全球5%~10%人群终生患消化性溃疡[3]。该病发病率高、病程长,易反复发作,可对患者生命质量造成严重影响。有研究显示,消化性溃疡的发生与幽门螺杆菌(Hp)的感染密切相关,目前临床对于该疾病的治疗多采用质子泵抑制剂联合抗菌药物,临床效果显著[4-6]。该疗法对胃酸分泌有较好抑制作用,但会影响Hp根除率,不利于溃疡愈合。同时患者对于抗菌药物出现的不良反应,也会影响治疗依从性,所以,合理选用抗菌药物成为Hp感染合并消化性溃疡治疗的热点研究内容[7]。因此,为提升消化性溃疡的临床治疗效果,本研究就不同抗菌药物对Hp感染合并消化性溃疡的治疗效果及对微生物菌群的影响进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2021年1月至2022年10月葫芦岛市中心医院收治的400例Hp感染合并消化性溃疡患者作为研究对象,按随机数字表法将其分为A、B、C、D 4组,每组100例。4组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。
表1 4组患者一般资料比较
1.2 纳入与排除标准
纳入标准:1)经胃镜检查确诊为消化性溃疡,且Hp呈阳性[8];2)意识清晰、有沟通能力;3)近两周内未服用过抗菌药物及复方谷氨酰胺颗粒;4)自愿参与本研究并签署了知情同意书。
排除标准:1)精神疾病;2)病历资料不全;3)沟通障碍;4)有胃肠道手术史;5)对本研究所用药物过敏;6)严重肝、肾功能不全;7)恶性肿瘤。
1.3 治疗方法
所有患者均采用抗菌药物+艾司奥美拉唑+枸橼酸铋钾治疗,艾司奥美拉唑(阿斯利康制药有限公司,国药准字H20046379)口服,20 mg/次,2次/d;枸橼酸铋钾(丽珠集团丽珠制药厂,国药准字H10920098)口服,0.6 g/次,2次/d。
A组患者应用抗菌药物为左氧氟沙星(广东东阳光药业有限公司,国药准字H20020056)口服,0.1 g/次,2次/d;呋喃唑酮(天津力生制药股份有限公司,国药准字H12020160)口服,0.1 g/次,2次/d。B组患者抗菌药物采用甲硝唑(山西津华晖星制药有限公司,国药准字H14021736)口服,0.2 g/次,3次/d;阿莫西林(珠海联邦制药股份有限公司中山分公司,国药准字H2000326)口服,1 g/次,2次/d。C组患者予以阿莫西林口服,1 g/次,2次/d;呋喃唑酮口服,0.1 g/次,2次/d。D组患者应用克拉霉素片(浙江京新药业股份有限公司,国药准字H20065652)口服,0.25 g/次,2次/d;阿莫西林口服,1 g/次,2次/d。4组患者均治疗2个月。
1.4 观察指标
1)炎症因子:抽取患者治疗前后的空腹肘静脉血,以3 000 r/min的速度进行离心处理,取上层清液,应用酶联免疫吸附试验法检测C反应蛋白(C-reactive protein,CRP)、白细胞介素-2(interleukin-2,IL-2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。2)肠道菌群:在治疗前后分别检测患者肠道菌群情况。具体方法为:①在无菌状态下进行采样,取患者10 g新鲜粪便置入厌氧罐内部并送检;②目的菌群与培养基:大肠杆菌、粪肠球菌、乳酸杆菌、双歧杆菌以及粪杆菌的培养基分别为伊红美蓝琼脂培养基(EMB)、Pfizer肠球菌选择性琼脂(PSE)、乳酸杆菌选择性琼脂(LBS)、亚硫酸铋琼脂培养基(BS)、拟杆菌胆汁七叶苷琼脂基础(BBE);③采用光冈检测法进行检测,根据细菌三级鉴定所属水平,将获取的菌落数据采用l g(CFU/g)表示。3)Hp根除标准:进行14C尿素呼气试验,若结果为阴性则患者Hp根除。4)记录两组患者用药过程中肾功能轻度异常、呕吐、腹泻、皮疹等不良反应发生情况。
1.5 疗效判定标准
显效:治疗后胃镜检查显示胃黏膜溃疡基本消失,且炎症反应明显改善;有效:治疗后胃镜检查显示胃黏膜溃疡面积缩小30%以上,且炎症反应有所缓解;无效:治疗后胃镜检查显示胃黏膜溃疡面积无变化或缩小低于30%,且炎症反应无变化,甚至加重[9]。治疗有效率(%)=(显效例数+有效例数)/总例数×100%。
1.6 统计学分析
采用SPSS 23.0统计软件进行数据分析,计数资料以百分率表示,组间比较采用χ2检验,计量资料以±s表示,组间比较采用F检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
D组治疗有效率明显高于A、B、C组(P<0.05),但A、B、C组治疗有效率比较差异无统计学意义(P>0.05)。见表2。

表2 4组患者临床疗效比较
2.2 炎症因子水平变化情况
治疗前4组CRP、IL-2、TNF-α水平比较差异无统计学意义(P>0.05);治疗后4组IL-2水平升高,D组高于A、B、C组,C组高于A、B组,CRP、TNF-α水平降低,D组低于A、B、C组,C组低于A、B组,差异有统计学意义(P<0.05),但A、B组比较差异无统计学意义(P>0.05)。见表3。
表3 4组患者炎症因子水平变化情况比较(±s)
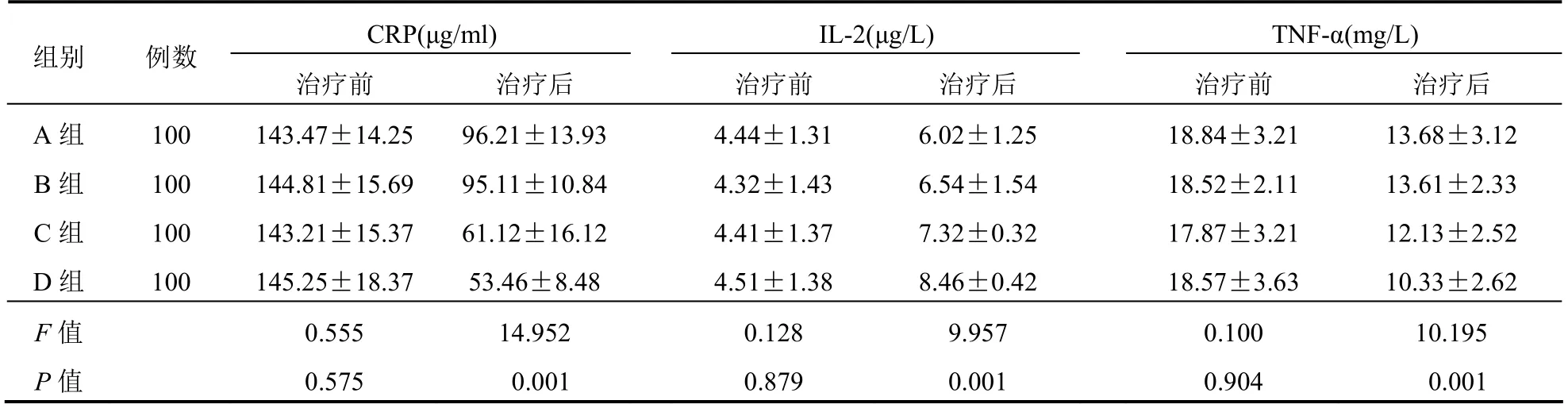
表3 4组患者炎症因子水平变化情况比较(±s)
组别 例数CRP(μg/ml) IL-2(μg/L) TNF-α(mg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A组 100 143.47±14.25 96.21±13.934.44±1.31 6.02±1.25 18.84±3.21 13.68±3.12 B组 100 144.81±15.69 95.11±10.844.32±1.43 6.54±1.54 18.52±2.11 13.61±2.33 C组 100 143.21±15.37 61.12±16.124.41±1.37 7.32±0.32 17.87±3.21 12.13±2.52 D组 100 145.25±18.37 53.46±8.48 4.51±1.38 8.46±0.42 18.57±3.63 10.33±2.62 F值 0.555 14.952 0.128 9.957 0.100 10.195 P值 0.575 0.001 0.879 0.001 0.904 0.001
2.3 肠道微生物菌群
治疗前4组肠道菌群情况比较差异无统计学意义(P>0.05);治疗后4组患者乳酸杆菌、双歧杆菌以及类杆菌水平升高,D组高于A、B、C组,C组高于A、B组,大肠杆菌及粪肠球菌水平降低,D组低于A、B、C组,C组低于A、B组,差异有统计学意义(P<0.05),但A、B组比较差异无统计学意义(P>0.05)。见表4。
表4 4组患者肠道菌群情况比较(CFU/g,±s)
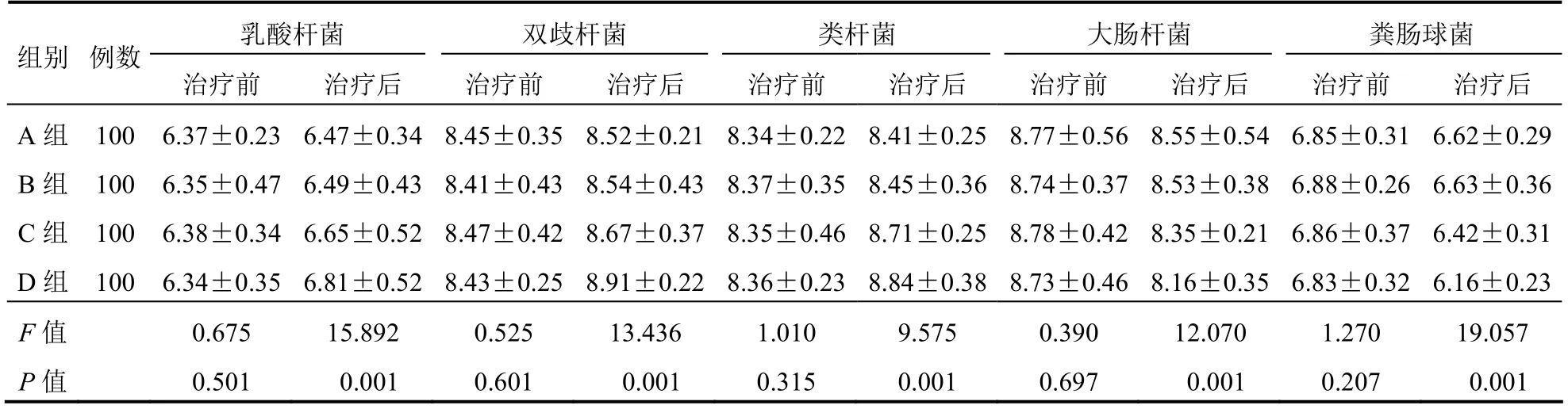
表4 4组患者肠道菌群情况比较(CFU/g,±s)
组别 例数乳酸杆菌 双歧杆菌 类杆菌 大肠杆菌 粪肠球菌治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A组 100 6.37±0.23 6.47±0.34 8.45±0.35 8.52±0.218.34±0.228.41±0.258.77±0.568.55±0.54 6.85±0.316.62±0.29 B组 100 6.35±0.47 6.49±0.43 8.41±0.43 8.54±0.438.37±0.358.45±0.368.74±0.378.53±0.38 6.88±0.266.63±0.36 C组 100 6.38±0.34 6.65±0.52 8.47±0.42 8.67±0.378.35±0.468.71±0.258.78±0.428.35±0.21 6.86±0.376.42±0.31 D组 100 6.34±0.35 6.81±0.52 8.43±0.25 8.91±0.228.36±0.238.84±0.388.73±0.468.16±0.35 6.83±0.326.16±0.23 F值 0.675 15.892 0.525 13.436 1.010 9.575 0.390 12.070 1.270 19.057 P值 0.501 0.001 0.601 0.001 0.315 0.001 0.697 0.001 0.207 0.001
2.4 不良反应与Hp清除率
4组均无严重不良反应发生,A、C、D组不良反应发生率比较差异无统计学意义(P>0.05),但B组不良反应发生率高于A、C、D组(P<0.05);D组Hp清除率高于A、B、C组(P<0.05),但A、B、C组比较差异无统计学意义(P>0.05)。见表5。
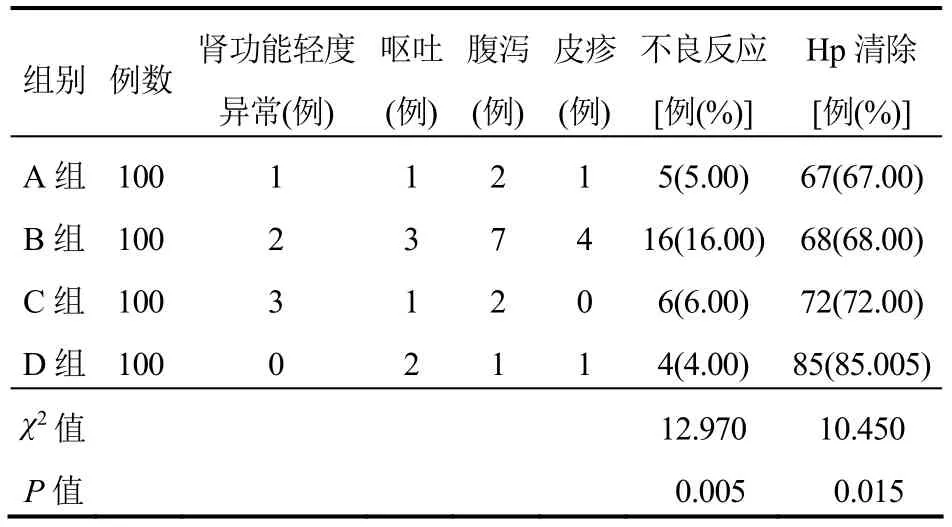
表5 4组患者不良反应与Hp清除率比较
3 讨论
目前,临床上认为消化性溃疡主要是因黏膜侵袭因素所致,其中Hp感染导致的消化性溃疡约占整体病例的60%以上[10]。临床研究发现,Hp合并慢性消化性溃疡久治不愈患者胃癌发病率显著高于普通人群[11]。所以如何清除Hp,根治消化性溃疡成为临床研究的热点内容。以往临床发现,单纯采用抑制胃酸分泌药物治疗消化性溃疡,复发率高达50%~70%,因此越来越多学者推荐,通过联合使用抗菌药物和抑制胃酸分泌药物,以清除Hp来彻底治愈疾病[12]。左氧氟沙星、呋喃唑酮、甲硝唑、克拉霉素、阿莫西林为治疗Hp感染合并消化性溃疡的常用抗菌药物。临床上常采用两种抗菌药物联合对其进行治疗,可进一步提升Hp的清除效果,但何种抗菌药物联合治疗的效果更好尚无确切定论。
本研究结果显示,D组治疗有效率明显高于A、B、C组,但A、B、C组治疗有效率比较差异无统计学意义。左氧氟沙星属于广谱抗菌药物,主要是通过抑制细菌DNA旋转酶活性,阻滞细菌DNA合成与复制,进而产生灭菌效果。呋喃唑酮属于硝基呋喃类抗菌药物,可用于治疗细菌和原虫引起的痢疾、肠炎、胃溃疡等胃肠道疾病,对常见的革兰阴性菌和阳性菌均有抑制作用,抑制细菌氧化还原酶,进而影响细菌正常代谢[13]。甲硝唑主要是抗滴虫及阿米巴原虫的药物,有抗厌氧菌作用,其会通过被动扩散进入血液,在厌氧菌或厌氧原虫细胞或体内的无氧环境中,其的硝基被还原成氨基,并发挥抗厌氧菌的作用,杀灭细菌[14]。克拉霉素与细菌核糖体50S亚基可逆性结合,抑制病菌核糖核酸水平,从而阻断细菌新生多肽链的延长,抑制细菌蛋白质合成,属于一种见效较快的广谱抑菌剂[14]。阿莫西林口服后药物分子中的内酰胺基立即水解生成肽键,迅速和菌体内的转肽酶结合使之失活,切断菌体依靠转肽酶合成糖肽用来建造细胞壁的唯一途径,使细菌细胞迅速成为球形体而破裂溶解,菌体最终因细胞壁损伤,水分不断渗透而胀裂死亡[15]。本研究结果提示克拉霉素+阿莫西林治疗Hp感染合并消化性溃疡的疗效更好。克拉霉素对革兰阳性菌如链球菌属、肺炎球菌、葡萄球菌的抗菌作用略优,且对诱导产生的耐红霉素菌株亦具有一定抗菌活性。克拉霉素及其在体内的代谢产物对Hp的抗菌作用显著。而阿莫西林对大多数致病的G+菌和G-菌(包括球菌和杆菌)均有强大的抑菌和杀菌作用,其中对肺炎链球菌、溶血性链球菌等链球菌属、不产青霉素酶葡萄球菌、粪肠球菌等需氧革兰阳性球菌,大肠埃希菌、奇异变形菌、沙门菌属、流感嗜血杆菌、淋病奈瑟菌等需氧革兰阴性菌的不产β-内酰胺酶菌株及Hp具有良好的抗菌活性[16]。克拉霉素+阿莫西林联合后,两者分别从不同原理来灭杀细菌,起到相互促进作用,能够进一步提升Hp感染合并消化性溃疡的治疗效果。
本研究结果显示,治疗后4组IL-2水平升高,D组高于A、B、C组,C组高于A、B组,CRP、TNF-α水平降低,D组低于A、B、C组,C组低于A、B组,差异有统计学意义,但A、B组比较差异无统计学意义。TNF-α、CRP是临床上常见的促炎因子,能够促使炎症因子释放,还可使外周和中枢神经敏感化。IL-2是抗炎因子的一种,其水平越高,代表机体炎症反应越轻。提示克拉霉素+阿莫西林治疗能够更好地降低机体炎症反应水平[17]。治疗后4组患者乳酸杆菌、双歧杆菌以及类杆菌水平升高,D组高于A、B、C组,C组高于A、B组,大肠杆菌及粪肠球菌水平降低,D组低于A、B、C组,C组低于A、B组,差异有统计学意义,但A、B组比较差异无统计学意义。肠道菌群平衡可稳定肠道微生态系统,加速人体对矿物质的吸收,一旦失衡就会导致有益菌发生变化,过度激活免疫系统,造成肠道功能紊乱[18]。正常人体内含有的肠道菌主要包括乳杆菌、肠球菌、肠杆菌以及双歧杆菌,而当肠道功能紊乱时患者体内对于人体有益的双歧杆菌和乳酸杆菌会随之减少,造成肠道菌群失调,出现腹泻、腹痛等症状。D组肠道微生物菌群优于其他3组,也证明了克拉霉素+阿莫西林对消化性溃疡疗效显著,能够进一步改善患者肠道菌群水平。A、C、D组不良反应发生率比较差异无统计学意义,但B组不良反应发生率高于A、C、D组;D组Hp清除率高于A、B、C组,但A、B、C组比较差异无统计学意义。Hp对于阿莫西林的耐药性较低,因此消化性溃疡患者在抑制胃酸分泌药物基础上联合阿莫西林进行治疗,能够提升Hp清除率,且安全性较高[19]。另外克拉霉素代替甲硝唑能够进一步提升治疗效果的同时,提高Hp清除率,这主要是因为克拉霉素在消化道的酸性环境中稳定性较高,在体外也存在较强的抗Hp作用,能够通过抑制细胞核蛋白50S亚基结合,对细菌蛋白合成产生抑制作用,从而提升Hp清除率。有研究显示,甲硝唑长期口服易发生不良反应,而且出现Hp耐药菌株的概率较高[20],与本研究结果相符。
综上所述,Hp感染合并消化性溃疡采用两种抗生素+艾司奥美拉唑+枸橼酸铋钾治疗均有一定临床疗效,但应用克拉霉素+阿莫西林作为抗菌药物进行治疗疗效更显著,能够有效降低患者炎症因子水平,改善肠道菌群结构,提升Hp清除率,且安全性较高。

