含溴结构域蛋白4加重高糖诱导的内皮细胞损伤机制探讨
孙云龙,王喜甲,孟哲,高路
(郑州大学第一附属医院 心血管内科,河南 郑州 450052)
糖尿病相关的血管并发症是目前糖尿病治疗的主要临床问题[1]。糖尿病患者的冠状动脉疾病发病率相比于正常人群增加2~4 倍,外周血管疾病的发病率增加10倍[2]。内皮细胞功能障碍是糖尿病患者发生心血管疾病的始动机制。内皮功能受损源于活性氧(reactive oxygen species,ROS)产生增加而导致一氧化氮 (nitric oxide,NO) 被大量清除,是血管疾病状态的标志[3]。内皮功能障碍可引起内皮细胞的炎症反应增强、血小板和凝血因子活化增强导致促凝状态,最终导致血管生长和内皮重塑缺陷,最终引起心肌缺血,出现急性心肌梗死[1]。高达75%的糖尿病患者死于血管疾病和内皮功能障碍[4]。内皮功能障碍贯穿于糖尿病疾病的整个周期,尽管部分患者血糖控制良好,但是高血糖损伤后血管功能障碍仍会进展[5],因此深入了解高血糖引起内皮功能障碍的机制,对治疗糖尿病的血管并发症有重要意义。
含溴结构域蛋白4(Bromodomain 4,BRD4)是溴结构域和末端外结构域家族成员,可作为组蛋白乙酰化赖氨酸基团的调节剂并调节表观遗传学[6]。目前已证实BRD4与多种癌症有关,如胶质母细胞瘤、神经母细胞瘤、肺癌[7-8]。BRD4也与心血管疾病密切相关[9]。研究发现,心脏BRD4敲除小鼠表现出进行性心功能不全和心室扩张[9-10]。Sanders等[11]发现BRD4可以抑制与年龄相关的肺纤维化。BRD4促进肺癌的转移和增殖,通过调节核因子E2相关因子2(nuclear factor-E2-related factor 2,NRF2)介导的氧化还原代谢来调控小细胞肺癌的发生发展[12-13]。本研究旨在探讨BRD4对高糖诱导的血管内皮细胞损伤的作用及机制。
1 材料与方法
1.1 材料
以下试剂购买于碧云天公司(上海):ROS试剂盒、超氧化物歧化酶2(superoxide dismutase,SOD2)检试剂盒、CCK-8试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase, Gpx)、丙二醛(malonic dialdehyde,MDA)检测试剂盒。以下试剂购买于Gibco公司(美国):胰蛋白酶、DMEM培养基、血清。TUNEL染色试剂盒来自于美国Millipore公司。山羊抗兔IRdye@488 CW IgG购自美国LI-COR公司。ELISA试剂盒来自于BioLegend公司(美国)。NRF2抗体购自Cell Signaling Technology公司。反转录试剂盒来自于美国罗氏公司。
1.2 细胞分组和处理
人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)购买于上海中科院细胞典藏中心,HUVEC采用含有10 g·L-1的胎牛血清的DMEM培养基培养,采用胰蛋白酶消化细胞用于传代,将细胞随机分为4组。(1)对照组:细胞在正常葡萄糖(5.5 mmol·L-1)条件下培养,转染空载体ScRNA同时给予27.5 mmol·L-1的甘露醇处理48 h。(2)高糖组(HG组):细胞转染空载体ScRNA12 h,同时给予高糖(33.5 mmol·L-1)刺激48 h。(3)BRD4 siRNA组:细胞转染BRD4 siRNA 12 h,给予27.5 mmol·L-1的甘露醇处理48 h。(4)BRD4 siRNA+HG组:细胞转染BRD4 siRNA,孵育12 h,同时给予高糖(33.5 mmol·L-1)刺激48 h 。
1.3 HUVEC中促炎因子水平检测
采用ELISA法检测细胞中的炎症因子水平,细胞分组处理后采用PBS清洗3次,每孔加入50 μL蛋白裂解液,在冰上孵育15 min,采用细胞刮刀收集裂解的细胞液,采用1 200 r·min-1离心30 min,采用相应试剂盒检测白细胞介素-1(interleukin-1,IL-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-1,IL-6)的水平。
1.4 HUVEC中氧化应激因子水平检测
ROS检侧采用荧光探针DCFH-DA法。将分组处理后的细胞采用DMEM清洗3次后每孔加入1 μL DCFH-DA荧光探针,孵育20 min,采用酶标仪检测每孔的荧光强度。分组处理的细胞每孔加入50 μL蛋白裂解液,在冰上孵育15 min,采用细胞刮刀收集裂解的细胞液,分别采用试剂盒在酶标仪下检测检测MDA、SOD2和GPx的活性。细胞实验重复3次。
1.5 HUVEC活性检测
采用CCK-8检测细胞活性。将分组处理的细胞用PBS清洗3次,每孔加入10 μL CCK-8溶液,室温孵育30 min,采用酶标仪检测每组细胞在450 nm处的光密度值。
1.6 HUVEC凋亡检测
采用Tunel染色检测细胞凋亡。分组处理的细胞采用40 g·L-1的多聚甲醛固定后采用Triton-X-100通透打孔,细胞加入TdT酶工作液孵育1 h,采用Anti-Digoxigenin 荧光工作液孵育30 min后采用DAPI进行细胞和染色和封片,采用荧光显微镜拍照。
1.7 NRF2免疫荧光染色
分组处理的细胞采用甲醛固定后采用Triton-X-100通透打孔,采用8 g·L-1的羊血清进行封闭1 h,采用抗NRF2一抗(1∶100稀释)孵育过夜,使用Alexa-488标记的山羊抗兔二抗孵育1 h,采用DAPI染色细胞核后封片,采用荧光显微镜拍照。
1.8 统计学处理
2 结果
2.1 BRD4沉默对高糖刺激下HUVEC炎症因子水平的影响
对照组和BRD4 siRNA组细胞促炎症因子TNF-α、IL-1、IL-6水平差异无统计学意义(P>0.05),HG组及BRD4 siRNA+HG组细胞促炎症因子水平高于对照组(P<0.05),且BRD4 siRNA+HG组细胞促炎症因子水平低于HG组(P<0.05)。见表1。
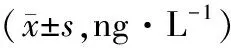
表1 4组细胞中炎症因子水平的比较
2.2 BRD4沉默对高糖刺激下HUVEC氧化应激的影响
对照组和BRD4 siRNA组ROS和MDA水平、抗氧化酶SOD2和Gpx活性差异无统计学意义(P>0.05),HG组及BRD4 siRNA+HG组细胞ROS和MDA水平高于对照组,抗氧化酶SOD2和Gpx水平低于对照组(P<0.05);且BRD4 siRNA+HG组细胞ROS和MDA水平低于HG组(P<0.05),SOD2和Gpx水平高于HG组(P<0.05)。见表2。

表2 BRD4沉默减轻HG诱导的氧化应激反应
2.3 BRD4沉默对高糖刺激下细胞活性及凋亡的影响
对照组和BRD4 siRNA组细胞活性差异无统计学意义(P>0.05),HG组及BRD4 siRNA+HG组细胞活性低于对照组(P<0.05);与HG组相比,BRD4 siRNA+HG组细胞活性升高(P<0.05)。见表3。Tunel染色结果显示:对照组和BRD4 siRNA组细胞凋亡数量差异无统计学意义(P>0.05),HG组及BRD4 siRNA+HG组细胞凋亡数量多于对照组(P<0.05);与HG组相比,BRD4 siRNA+HG组细胞凋亡数量减少(P<0.05)。见图1和表3。
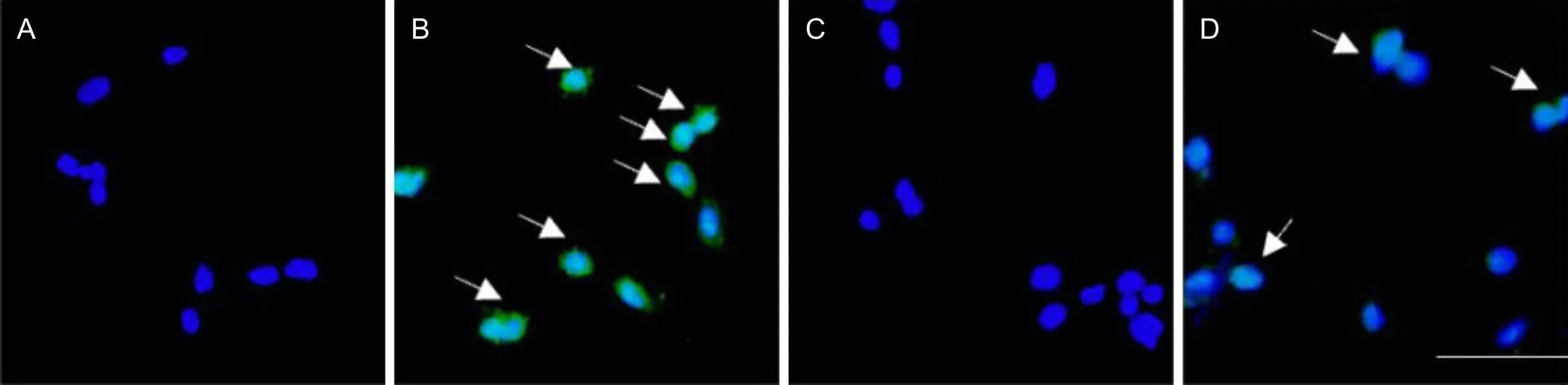
A图为对照组;B图为HG组;C图为BRD4 siRNA组;D图为BRD4 siRNA+HG组;绿色为Tunel阳性;蓝色为细胞核;箭头所指为凋亡阳性细胞。

表3 细胞增殖、凋亡及NRF2核转位水平比较
2.4 BRD4沉默对高糖刺激下细胞NO水平的影响
对照组和BRD4 siRNA组NO水平差异无统计学意义(P>0.05),HG组及BRD4 siRNA+HG组细胞NO水平低于对照组(P<0.05);与HG组相比,BRD4 siRNA+HG组细胞NO水平升高(P<0.05)。见表3。
2.5 BRD4沉默对内皮细胞NRF2表达以及核转位的影响
对照组和BRD4 siRNA组NRF2表达以及核转位水平差异无统计学意义(P>0.05),HG组及BRD4 siRNA+HG组NRF2表达以及核转位水平低于对照组(P<0.05);与HG组相比,BRD4 siRNA+HG组细胞NRF2表达以及核转位水平升高。见图2和表3。
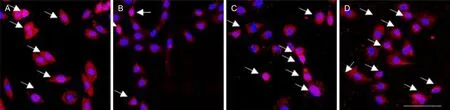
A图为对照组;B图为HG组;C图为BRD4 siRNA组;D图为BRD4 siRNA+HG组;绿色为NRF2阳性;蓝色为细胞核;箭头所指为NRF2核转位阳性细胞。
3 讨论
氧化应激为ROS的增加和/或抗氧化防御机制的减少,导致细胞损伤,在心血管疾病的发病机制中起重要作用,如动脉粥样硬化、高血压以及与糖尿病相关的大血管和微血管疾病。1型和2型糖尿病中ROS来源包括葡萄糖的自动氧化、通过多元醇途径增加底物通量和降低NADPH水平、晚期糖基化终产物的形成以及与细胞靶标的相互作用,这可能导致氧化应激[14]。BRD4可调节巨噬细胞的炎症反应,抑制BRD4可以促进老年小鼠肺纤维化的消退[11]。本研究发现在内皮细胞中沉默BRD4可以减少高糖刺激诱导的氧化应激水平,降低ROS和脂代谢中间产物MDA的水平,增加抗氧化酶SOD2和Gpx的活性,从而减少内皮细胞的氧化应激损伤,减轻内皮细胞的炎症反应。
NO是内皮细胞释放的因子,可舒张内皮细胞,减轻内皮细胞损伤。内皮细胞功能障碍时,生成的NO减少,导致内皮细胞损伤,形成恶性循环。NO在控制血管稳态中起核心作用[15],不仅调节血管舒缩张力,还可抑制单核细胞趋化肽-1的表达,降低血管细胞黏附分子-1的表达,阻止脂质氧化的传播,抑制血管平滑肌增殖,降低血小板聚集。在糖尿病中,胰岛素抵抗、高血糖均导致内皮细胞NO产生减少[16]。超氧化物还可以与NO结合形成过氧亚硝酸根阴离子,加重内皮细胞的损害[16]。本研究发现BRD4沉默可以升高内皮细胞中NO水平,降低ROS的水平,从而减少内皮氧化损伤,发挥NO对内皮的保护作用。
NRF2是一种转录因子,可协调大量细胞保护基因的基础激活和应激诱导的激活[17]。NRF2调节谷胱甘肽GSH和硫氧还蛋白抗氧化系统成分的转录,以及参与Ⅰ期和Ⅱ期外源性和内源性产物解毒、NADPH再生和血红素代谢的酶[17],调控氧化应激的细胞防御机制关键酶的转录。NRF2还参与细胞其他过程,如自噬、中间代谢、干细胞静止和未折叠蛋白反应[18]。以往研究发现BRD4在心脏中调控线粒体相关蛋白[9]。本研究发现BRD4可以抑制NRF2的表达和核转位,BRD4沉默能使高糖刺激下的NRF2核转位细胞占比增加,在内皮细胞中可能通过对NRF2的抑制作用发挥促进氧化应激损伤作用。
4 结论
在高糖诱导的内皮损伤中,BRD4促进内皮细胞炎症和氧化应激,加重内皮细胞的损伤。内皮细胞中沉默BRD4可以保护内皮细胞在高糖刺激下的损伤。因此,针对BRD4的小干扰RNA可能成为治疗糖尿病血管并发症的手段。

