剪切波弹性成像参数对乳腺肿块的鉴别价值及与临床病理学特征的相关性分析
李 艳,栾宇婷,常静瑄,张翠明,杨小欢
山西医科大学第二医院超声科,山西 太原 030001
乳腺癌已经成为全球发病率最高的癌症[1],乳腺癌的不同分型、不同分期临床治疗方法及预后均不同,因此,早期诊断对于乳腺癌患者的有效治疗极为重要。实时剪切波弹性成像(shear wave elastography,SWE)通过剪切波在组织内传播,计 算出杨氏模量值,在二维声像图基础上叠加实时弹性图,剪切波传播速度越快,杨氏模量值越大,图像越红,表明组织越硬。有研究[2]表示,肿瘤细胞的增殖与侵袭可引起组织硬度的增加,故理论上SWE可用于区分良恶性肿块,但其诊断效能及肿块硬度与临床病理学参数间的关系尚不明确。
因此,本研究试探讨SWE参数对乳腺良恶性肿块的鉴别诊断价值,并进一步分析其与乳腺癌临床病理学参数间的关系。
1 资料和方法
1.1 一般资料
选取2019年9月—2022年9月就诊于山西医科大学第二医院超声科的乳腺肿块女性患者92例(共112个肿块)。肿块最大径0.7~5.0 cm,所有肿块均经术后病理学检查确诊,良性肿瘤62个,恶性肿瘤50个。纳入标准:① 均进行手术治疗;② 超声图像清晰完整;③ 患者临床病理学资料齐全;④ 超声检查前未进行相关治疗。
1.2 方法
1.2.1 SWE检查
采用美国GE公司的Logiq E9型彩色多普勒超声诊断仪,9L线阵探头频率为5~9 MHz。患者取仰卧位,充分暴露乳房,涂抹耦合剂,探头与皮肤完全接触,确定肿块位置,使肿块图像清晰且位于屏幕中央,选取SWE模式,默认量程0~300 kPa,不额外施加压力,固定探头,调节取样框大小,尽可能覆盖肿块及周边为佳,嘱患者屏气,保持图像清晰稳定,存图。于肿块内部或周边最硬处绘制感兴趣区(region of interest,ROI),ROI直径固定为2 mm[3-4],获取最常使用的SWE参数值:杨氏模量最大值(Emax)、杨氏模量平均值(Emean),以上数据均测3次取其均值。
1.2.2 临床病理资料收集
临床病理学资料包括:免疫组织化学信息[孕激素受体(progesterone receptor,ER)、雌激素受体(estrogen receptor,ER)、人表皮生长因子受体2(human epidermal growth factor 2,HER2)的表达情况]、肿块分子分型、肿块分化程度、肿块直径、淋巴结状态、临床TNM分期、脉管癌栓及神经侵犯情况。
1.3 判断标准
SWE定量及定性参数:定量参数,Emax、Emean;定性参数,SWE图像分型标准[5](Ⅰ型,肿块为均匀的深蓝色;Ⅱ型,肿块内部及周围出现淡蓝色;Ⅲ型,肿块内部为蓝色,但周边出现橙色或红色;Ⅳ型,肿块内部存在分布不均匀的红色;Ⅴ型,肿块内部色彩缺失或周边出现“硬环征”)。
免疫组织化学表达及分子分型定义:ER、PR阳性为核内染色细胞数≥1%[6]。HER2阳性为免疫组织化学表达“3+”或“2+”同时荧光原位杂交检测为阳性[7]。不满足阳性条件者为阴性;Ki-67增殖指数≥14%为高表达。
乳腺癌分型如下[6]。Luminal A型:ER、PR阳性且PR高表达,HER2阴性,Ki-67增殖指数低;Luminal B型:除外Luminal A型的Luminal样肿瘤,依据HER2蛋白表达情况,可分为Luminal B(HER2阴性)型和Luminal B(HER2阳性)型;HER2过表达型:ER、PR阴性,HER2过表达;三阴性:ER、PR、HER2均为阴性。
1.4 统计学处理
采用SPSS 26.0及GraphPad Prism 9对所得数据进行分析研究及绘图。
2 结 果
2.1 病理学检查结果
本研究包括92例女性乳腺肿块患者,共112个肿块。所有肿块均经病理学检查确认,良性肿块62个,其中纤维腺瘤38个,腺病伴纤维腺瘤12个,腺病8个,炎性肿块2个,导管内乳头状瘤2个;恶性肿块50个,其中浸润性导管癌42个,浸润性小叶癌3个,导管原位癌5个。
2.2 乳腺良恶性肿块间SWE参数比较
同乳腺良性肿块相比,恶性肿块的Emax、Emean值均较高,差异有统计学意义(P=0.000,表1,图1)。SWE图像分型良恶性相比,良性肿块多为Ⅰ、Ⅱ、Ⅲ型,恶性肿块多为Ⅳ、Ⅴ型,差异有统计学意义(P=0.000,表2,图2)。
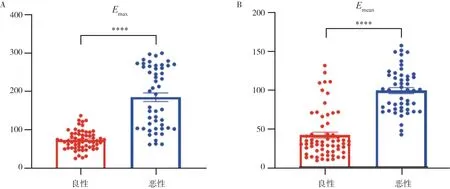
图1 乳腺良恶性肿块间SWE定量参数的差异
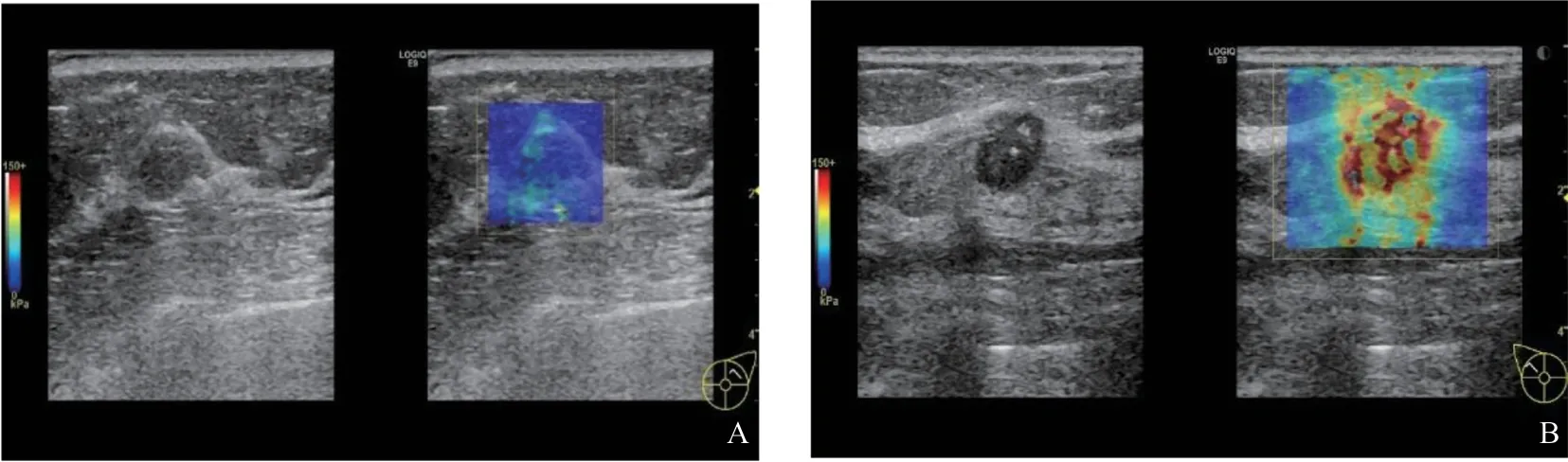
图2 乳腺肿块SWE的表现图
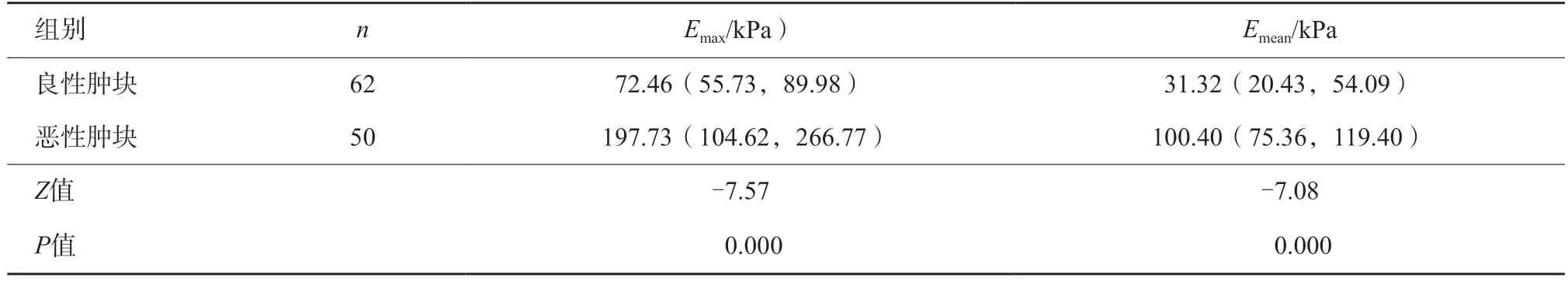
表1 乳腺良恶性肿块间SWE定量参数的比较M(P25,P75)

表2 乳腺良恶性肿块SWE图像分型比较n(%)
2.3 SWE参数的诊断效能
以肿块病理学检查结果作为金标准,对Emax、Emean、SWE分型及三者联合的诊断效能进行分析。结果发现Emax、Emean、SWE分型三者的诊断效能差异无统计学意义(P分别为0.248、0.676、0.656),三者的联合诊断效能优于单独诊断,差异有统计学意义(P分别为0.001、0.015、0.016,表3,图3)。

图3 Emax、Emean、SWE分型及三者联合ROC曲线
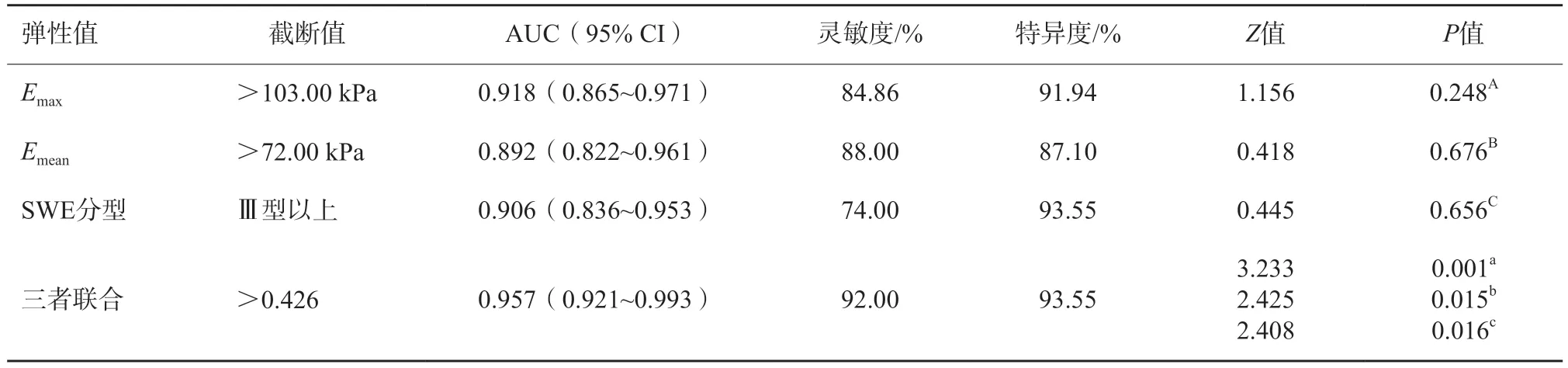
表3 SWE参数对乳腺良恶性肿块的诊断效能比较
2.4 SWE参数与乳腺癌患者临床病理资料间的关系
肿块越大、TNM分期越高、淋巴结有转移者,Emax、Emean越大,SWE图像分型越高(P<0.05);HER2阳性及组织学分级较高的肿块Emax、Emean值高于HER2阴性、组织学分级较低的肿块,且不同分子分型间的Emax及Emean值也存在差异(P<0.01);肿块的ER、PR表达情况,有无脉管癌栓及神经浸润与SWE各参数无明显相关性(P>0.05)。
2.5 SWE参数与临床病理学资料的相关性分析
选取上述差异有统计学意义的临床病理学参数同SWE参数进行相关性分析,结果显示SWE参数与乳腺癌肿块大小、淋巴结状态、TNM分期均呈正相关;Emax及Emean同HER2表达及组织学分级呈正相关(P<0.05,表4)。其中,Emax值同肿块TNM分期相关性较大,Emean值同肿块HER2表达相关性较大,SWE分型与肿块TNM分期相关性较大。

表4 SWE参数与病理参数相关性分析
3 讨 论
乳腺癌发病率逐年上升,严重威胁中国女性健康。不断增殖的乳腺癌细胞、新生丰富的毛细血管、微环境中较多排列紊乱的胶原纤维[8],均使得乳腺癌的组织硬度增加;SWE通过对组织进行定量及定性分析,可用于判断组织软硬程度[9]。研究[10]表明,乳腺恶性肿块较良性肿块弹性模量参数值增加,但目前界值尚未统一[11]。本研究显示,恶性肿块的SWE参数均大于良性肿块,这与吕景等[12]的研究结果一致,但其研究所得临界值低于本研究,分析原因可能是所选用的超声诊断仪不同导致默认量程存在一定差异及选取患者的病情进展时期所占比例不同。同时,本研究还发现定量参数与定性参数联合应用对区分良恶性肿块有较高的诊断效能。
肿瘤不同的分子生物学基础决定了不同的生物性状,进而产生不同的影像学征象[13-14],且不同生物学基础对乳腺癌患者治疗方案的选择有着极大的影响[15]。这为超声特征与肿瘤的临床病理学特征间的相关性提供了依据。本研究通过分析乳腺癌SWE参数与乳腺癌临床病理学资料,得出以下结论:① SWE参数均与肿块大小、临床分期及淋巴结转移呈正相关。Evans等[16]的研究指出,肿瘤的大小与其硬度有关,与本研究结果一致。考虑原因可能与随着肿瘤体积增加,更多血管形成及纤维组织增生有关,另有研究[17]发现,当乳腺癌存在淋巴结转移时,其肿块的硬度有所增加,这与本研究结论一致。② 低分化程度及HER2阳性肿块具有较高的Emax及Emean值,且乳腺癌弹性参数值由高到低分子分型为HER2过表达型、Luminal B型、三阴性乳腺癌、Luminal A型。当组织分化程度较低时,癌细胞增殖快,相互拥挤,使组织结构更加致密,因此肿块病理分化程度越低,硬度越大[18]。Evans等[19]的研究表明,乳腺恶性肿块的弹性参数值对病理学程度有较大的预测能力,对患者术前治疗方式的选择有一定的参考价值。而HER2的高表达能促进肿块内部新生血管及淋巴管的形成[20-21],促进细胞增殖及侵袭能力,使得肿块硬度增加[22-23],这些研究均支持本研究中HER2阳性肿块及HER2过表达型SWE定量参数值较高的结论。本研究显示,SWE定量参数与ER及PR的表达无明显相关性,Luminal A型乳腺癌的SWE定量参数值较低可能与HER2蛋白表达阴性有关;Luminal B型乳腺癌的定量参数值较高可能与部分Luminal B型肿块中HER2蛋白阳性表达有关,三阴性乳腺癌恶性程度大且发展快,临床发现时多为晚期,肿块内部经常发生液化坏死。Ganau等[24]指出,肿瘤的硬度与肿瘤坏死之间存在负相关,故三阴性乳腺癌肿块SWE定量参数值较低,这与贾美红等[25]的研究结果相一致;但近年来,对于不同分子亚型的乳腺癌的硬度差异的研究结果并不一致,如Ganau等[24]指出乳腺癌不同分型间Emax差异无统计学意义,故对此仍需进一步研究。
综上所述,SWE对乳腺肿块良恶性的鉴别诊断具有一定价值。且定量及定性参数的联合使用具有较高的诊断效能。同时SWE参数与乳腺癌患者的部分临床病理参数具有一定相关性。可通过分析SWE参数对乳腺癌的恶性程度进行预估,进而对乳腺癌的诊疗提供更多前期影像学依据。

