利妥昔单抗联合化疗治疗儿童成熟B细胞淋巴瘤的有效性和安全性的Meta分析*
张明乐,刁玉巧,朱秀丽,郑 钰,陈 健,江 莲,陈 彦,戴若恒,闫祎炜
河北医科大学第四医院儿科,河北石家庄 050000
淋巴瘤是一种多发于儿童淋巴造血系统的恶性肿瘤,是儿童第三常见的恶性肿瘤,其发病率仅次于白血病和中枢神经系统肿瘤[1]。根据肿瘤细胞克隆性增生的方式和病理形态的不同,淋巴瘤分为霍奇金淋巴瘤(HL)及非霍奇金淋巴瘤(NHL),在儿童淋巴瘤中HL约占20%,NHL约占80%[2]。儿童NHL往往多中心起源、远距离播散及淋巴结外浸润,呈现高度侵袭性,确诊时多为进展期(St.Jude Ⅲ、Ⅳ期)[3-4],在病理类型构成上儿童NHL与成人多有不同[5],儿童NHL常见类型为伯基特淋巴瘤(50%~60%)、大B细胞淋巴瘤(10%~15%)、淋巴母细胞淋巴瘤(20%~25%)和间变大细胞淋巴瘤(10%~12%),其他类型占比不到5%。
利妥昔单抗是一种人鼠嵌合型抗CD20单克隆抗体,可与B细胞特异性抗原CD20结合,通过补体依赖及抗体依赖反应,对肿瘤细胞增长发挥抑制功能,促进细胞凋零及死亡,1997 年经美国食品药品监督管理局(FDA)批准后上市。研究表明利妥昔单抗明显改善了成人B细胞淋巴瘤的生存率[6-7],进而成为成人B细胞淋巴瘤的一线治疗药物,于2017年在我国被纳入医保药品目录。
儿童和成人成熟 B 细胞NHL的亚型在分子异常方面存在差异,导致预后和对治疗的敏感性可能有差异,儿童 B 细胞NHL单纯化疗的结局优于成人,因此在儿童中联合使用利妥昔单抗的获益须与不良反应进行权衡[6]。ZHEN等[8]研究表明利妥昔单抗联合化疗能改善成熟B细胞淋巴瘤患儿的预后,建议复发难治病例治疗中加入利妥昔单抗。研究显示对危险度为R4的患者使用1~2次利妥昔单抗联合化疗的结果与单纯化疗的结果相比,差异无统计学意义(P>0.05),并认为利妥昔单抗的使用次数不应大于8次[8]。目前尚无研究明确利妥昔单抗的最佳使用次数。关于利妥昔单抗在儿童成熟 B 细胞NHL中的疗效和安全性数据有限。本研究通过Meta分析评估利妥昔单抗联合化疗治疗儿童成熟B细胞淋巴瘤的有效性和安全性,旨在为临床上治疗儿童成熟B细胞淋巴瘤时更加合理地应用利妥昔单抗提供理论依据。
1 资料与方法
1.1检索策略 计算机检索PubMed、Embase、Cochrane Library、中国知网、万方等数据库。中文检索词及检索策略:(“利妥昔单抗”或“美罗华”或“CD20单克隆抗体”和“成熟B细胞淋巴瘤”或“淋巴癌”)和(“儿童”或“小儿”或“未成年”)。英文检索词及检索策略:(“rituximab”OR“monoclonalanti-CD20 antibody”OR“Mabthera”)AND(“child”OR“Children”)AND(“lymphoma”OR”Germinoblastoma”OR“Reticulolymphosarcoma”)。检索时限为建立数据库至2022年7月。语言限制为英文和中文。PROSPERO网站注册号:CRD42022362700。
1.2文献纳入与排除标准
1.2.1纳入标准 (1)研究对象:国内外公开发表的新诊断的儿童成熟B细胞淋巴瘤患者,已明确诊断,并依据St.Jude分期对研究对象进行了分期。(2)文献中提供了较为完整的原始生存数据可供定量计算,包括生存率风险比(HR)或生存曲线等。(3)均为公开且可获得全文的文献。(4)文献类型:随机对照试验或队列研究。(5)干预措施:利妥昔单抗联合化疗组采用利妥昔单抗联合化疗的治疗方案,单纯化疗组采用单纯化疗的治疗方案。(6)文章语言为中文或英语。
1.2.2排除标准 (1)重复发表文献。(2)综述、病例个案临床报道、文献评论等。(3)文献数据不完整或没有充足的临床数据。
1.3文献筛选及资料提取 由2名研究者审阅所有搜索获得的文献摘要及全文,结合纳入及排除标准进行筛选,排除不符合条件的文献。对于存在争议的文献,如果有不同的判断,则请第3位研究者加入,一起讨论,并交叉核对已提取的数据资料,再决定是否纳入该研究。在文献选择过程中,首先通过Endnote软件剔除重复文献,之后阅读目标文献的标题和摘要,如果符合纳入标准,研究者将进一步阅读全文,确定是否纳入。
提取内容包括:(1)纳入研究的基本信息(如作者、发表年份等)。(2)纳入研究的干预措施(如治疗方案)。(3)纳入研究的偏倚风险评价要素。(4)结局指标,从原文中获取原始数据,包括3 年无事件生存率(EFS)、不良反应发生率,若原文只提供 Kaplan-Meier 生存曲线而无原始数据,则通过 Engauge Digitizer version 提取HR数据。
1.4文献质量评价 由2名研究者独立评价纳入的文献。对于随机对照试验,采用Cochrane手册中文献偏倚评估的方法,包括随机系列的产生、分配隐藏、对研究者与参与者施盲、结局评估中的盲法评价、数据的完整性、发表偏倚和其他偏倚来源共7项,对文献进行偏倚风险的评估,若满足每一个条目则评估为低风险(Low Risk),若不满足则评估为高风险(High Risk),若文献中的信息未对相应条目做出明确判断,则该文献判断为不清楚(Unclear)。对于非随机对照试验,采用非随机研究方法学指数(MINORS)评估纳入研究的质量,得分≥13分被认为是高质量。每个标准被评价为“是”“否”或“不清楚”,“是”“不清楚”或“否”的得分分别为2、1或0分,总分13~16分为高质量、0~12分为低质量。该量表根据偏倚(条目C至H)、变异(条目A和B)和报告质量(条目D和H)对文献进行评估,以确定各种偏倚和变异的原因。文献质量评价由2名研究人员独立完成,如果有分歧,则增加第3名研究人员来讨论和解决问题。纳入的研究质量高,可用于系统分析。
1.5统计学处理 采用STATA11.0软件进行统计分析,3年EFS的效应量采用HR及其95%CI表示,安全性不良反应的效应量采用比值比(OR)及其95%CI进行分析,以P<0.05为差异有统计学意义。用Q检验和I2检验评价纳入文献的异质性。根据异质性检验的结果,选择与之相对应的统计效应模型。如果P>0.1或I2<50%表明各研究具有同质性,则采用固定效应模型进行分析。如果P≤0.1或I2≥50%表明各研究之间存在异质性,则采用随机效应模型进行分析。若异质性有统计学意义,则选择可能的相关因素进行亚组分析。此外,研究将采用Metaninf 模型进行敏感性分析,通过逐个剔除文献的敏感性分析来寻找异质性的来源。采用漏斗图直观定性判断 Meta 分析是否存在发表偏倚,设定P<0.05为存在发表偏倚。若纳入文献存在发表偏倚,则漏斗图不对称,不对称越明显,发表偏倚程度越大;若漏斗图对称,表示不存在发表偏倚。
2 结 果
2.1文献检索结果 根据检索策略,初步检索到621篇文献。删除重复文章后共541篇,根据纳入及排除标准,阅读标题、摘要和全文后,排除了与本研究主题无关、仅含摘要、会议摘要、重复发表和病例报告等共计21篇文章。 排除分组不同及所需数据不完整文章后,本研究共纳入9篇文献[9-17],包括1项随机对照试验、1项前瞻性队列研究和7项回顾性队列研究。利用Cochrane偏倚风险工具对1项随机对照试验进行质量评估,为高质量研究;利用MINORS项目来评价8项队列研究,得分均≥13分,为高质量研究。见表1。纳入的研究均为高质量研究,可用于系统分析。

表1 纳入研究的基本信息
本研究纳入的9篇文献中,中文文献5篇、英文文献4篇,共908例儿童成熟B细胞淋巴瘤患者,涵盖中国、欧洲、北美等,样本量均>10个病例数,分为利妥昔单抗联合化疗组和单独化疗组。纳入研究基本信息见表1。
2.2Meta分析结果
2.2.13年EFS 共8篇文献[9-16]提供了3年EFS,各研究间异质性差异无统计学意义(I2=0%),则采用固定效应模型。利妥昔单抗联合化疗组的3年EFS明显高于单纯化疗组,差异有统计学意义(HR=0.37,95%CI:0.24~0.58,P<0.05)。见图1。
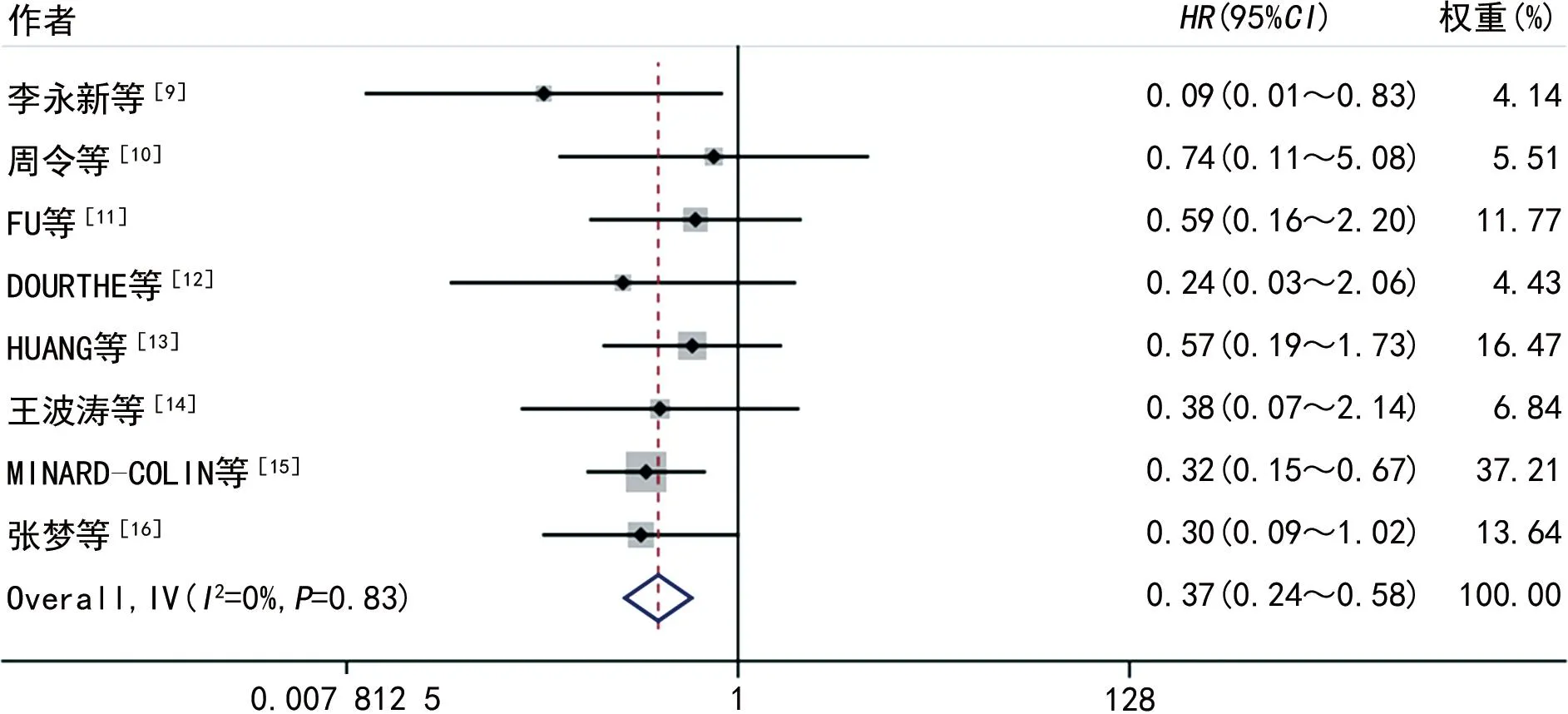
图1 两组3年EFS比较的森林图
2.2.2亚组分析 共7篇文献[9-15]提供了利妥昔单抗的使用次数,根据利妥昔单抗的使用次数进行了亚组分析,分为4次和≥6次,分析利妥昔单抗不同使用次数对3年EFS的影响。结果显示:利妥昔单抗使用≥6次时利妥昔单抗联合化疗组3年EFS高于单纯化疗组,差异有统计学意义(HR=0.32,95%CI:0.17~0.57,P<0.05);利妥昔单抗使用4次时利妥昔单抗联合化疗组3年EFS与单纯化疗组相比,差异无统计学意义(HR=0.41,95%CI:0.17~1.01,P>0.05)。见图2。
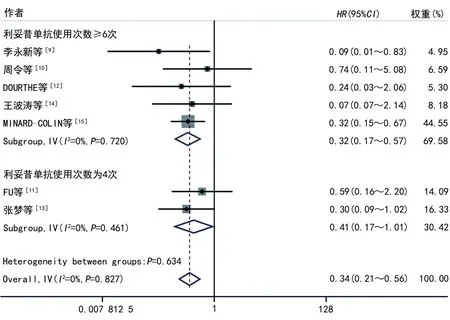
图2 3年EFS的亚组分析
2.2.3安全性分析结果 共3篇文献[11,15,17]提供了≥4级不良反应的发生率,采用OR进行分析,OR>1表示不良事件发生率较高,P<0.05为差异有统计学意义。其中有2项[11,15]研究评估了利妥昔单抗联合化疗组和单纯化疗组≥4级不良反应发生情况,结果显示两组间差异无统计学意义(OR=1.24,95%CI:0.80~1.94,P>0.05)。另外共2项[15,17]研究提供了≥3级中性粒细胞减少和≥3级感染的不良反应,结果显示:两组间≥3级中性粒细胞减少发生率比较,差异无统计学意义(OR=1.34,95%CI:0.62~2.91,P>0.05);两组间≥3级感染发生率比较,差异有统计学意义(OR=1.82,95%CI:1.23~2.71,P<0.05)。
2.3敏感性分析 敏感性分析结果显示,剔除任何一项研究均未对合并结果造成明显影响,表明本次Meta分析结果是稳定、可靠的。
2.4发表偏倚 采用漏斗图评估本研究的发表偏倚,设定P<0.05为存在发表偏倚。本研究漏斗图对称,表明不存在发表偏倚。
3 讨 论
近年来随着化疗方案的规范和医疗、社会环境的改善,儿童NHL治愈率取得了极大的提高,但是对于Ⅲ、Ⅳ期及复发难治的患儿,生存率仍有待提高。
淋巴细胞表面抗原CD20是成熟B细胞NHL的免疫治疗靶点。目前利妥昔单抗应用于儿童成熟B细胞淋巴瘤治疗的临床研究不多,且晚于成人[18-19]。发达国家首先将其应用于复发难治病例的研究,作为一线治疗药物的应用经验较为有限[20-23]。近年来国内外研究表明利妥昔单抗联合化疗能改善儿童B 细胞NHL的生存率[10,15]。亦有研究表明利妥昔单抗与不良反应增加和相关死亡有关[7]。因此利妥昔单抗联合化疗治疗儿童成熟B细胞淋巴瘤的有效性和安全性有待研究。
本研究采用 Meta 分析评价利妥昔单抗联合化疗治疗儿童成熟B细胞淋巴瘤的疗效及安全性,包括中文文献5篇、英文文献4篇,结果显示利妥昔单抗的加入改善了治疗效果,进一步对利妥昔单抗使用次数进行亚组分析,结果显示利妥昔单抗使用次数≥6次时利妥昔单抗联合化疗组3年EFS高于单纯化疗组,差异有统计学意义(HR=0.32,95%CI:0.17~0.57,P<0.05)。ZHEN等[8]研究表明治疗危险分级为R4期伯基特淋巴瘤时建议使用≥4次利妥昔单抗,但由于样本量小,无法进一步比较不同次数的效果。本研究结果表明利妥昔单抗使用次数≥6次时有优势。安全性方面,本研究结果显示利妥昔单抗联合化疗组的≥3级感染发生率和单纯化疗相比,差异有统计学意义(P<0.05)。这与SRINIVASAN等[7]研究一致,接受利妥昔单抗治疗的伯基特淋巴瘤患儿发热、肺炎不良反应增加,提出应用利妥昔单抗前应仔细考虑宿主因素、合理的支持治疗水平等安全性数据。本研究结果还显示利妥昔单抗联合化疗组≥4级不良反应发生率与单纯化疗组相比,差异无统计学意义(P>0.05)。因此在后续研究中需扩大样本量进一步研究。
综上所述,本研究结果显示利妥昔单抗联合化疗治疗儿童成熟B细胞淋巴瘤有益,可提高其生存率,患者分期为St.Jude Ⅲ、Ⅳ期时利妥昔单抗使用次数≥6次有优势,总体上不良反应发生率较低。本研究存在的局限性:(1)有些文献并未纳入,如某些缺少关键数据的文献、临床试验尚在进行的文献等。(2)除EFS外的生存数据(如总缓解率、总生存期)也是评价药物有效性的重要指标。(3)入选文献中患儿 St.Jude分期主要为Ⅲ、Ⅳ期,缺乏利妥昔单抗应用于早期成熟B细胞淋巴瘤患儿的临床数据。(4)使用利妥昔单抗的最佳次数和利妥昔单抗的使用对于早期患儿是否获益,由于本研究样本量较小,还需要更多临床随机对照试验数据来证实。

