三七总皂苷对碘酸钠所致视网膜损伤的保护作用及机制研究
蔡曾晓瑞 胡相卡 桂留铭 齐沐爽 代春美


摘要:目的 探討三七总皂苷(PNS)对碘酸钠所致视网膜损伤的保护作用及作用机制。方法 75只C57BL/6雄性小鼠,分为正常组、模型组和PNS低(50 mg·kg-1)、中(100 mg·kg-1)、高剂量(200 mg·kg-1)组,每组15只。PNS治疗组小鼠按相应的剂量预保护7 d后,模型组和PNS治疗组小鼠以25 mg·kg-1剂量尾静脉注射碘酸钠溶液,建立小鼠视网膜损伤模型。PNS治疗组继续灌胃给药28 d。采用眼底照相及OCT检测小鼠视网膜损伤情况;FFA法观察视网膜血管渗漏情况;HE染色观察小鼠视网膜组织形态变化;试剂盒检测血清中抗氧化指标水平,ELISA法检测小鼠血清中炎性细胞因子的表达水平;Western blot法检测各组小鼠视网膜组织细胞核内Nrf2、核内NF-κB p65、HO-1与NQO1蛋白的表达情况。结果 与正常组比较,模型组小鼠视网膜出现大量的黄白色类似玻璃膜疣状沉积,视网膜相对厚度下降(P<0.01),视网膜血管出现大面积的渗漏;血清中SOD活力与GSH含量下降(P<0.01),MDA、IL-6、TNF-α与IL-1β含量上升(P<0.01)。与模型组相比,PNS治疗组小鼠视网膜黄白色类似玻璃膜疣状沉积减少,视网膜相对厚度增加(P<0.05)、血管渗漏面积减少;血清中SOD活力与GSH含量上升(P<0.01),MDA、IL-6、TNF-α与IL-1β的含量下降(P<0.05);视网膜组织细胞核内Nrf2、HO-1和NQO1的蛋白表达上升(P<0.05),核内NF-κB p65的蛋白表达减少(P<0.05)。结论 PNS可通过抗氧化应激与抗炎作用减弱碘酸钠诱导的视网膜损伤,其机制可能与PNS激活Nrf2/HO-1信号通路有关。
关键词:三七总皂苷;视网膜损伤;核因子NF-E2相关因子;血红素氧合酶1;醌氧化还原酶1
中图分类号:R285.5中图分类号文献标志码:A文献标识码
Study on protective effect and mechanism of panax notoginseng saponins on retina injury induced by sodium iodate
CAI Zengxiaorui,HU Xiangka,GUI Liuming,QI Mushuang,DAI Chunmei*
(Jinzhou Medical University, Jinzhou,Liaoning 121000, China)
Abstract: Objective To explore the protective effect and mechanism of panax notoginseng saponins (PNS) on retinal injury caused by sodium iodate. Methods 75 C57BL/6 male mice were divided into normal group, model group, and PNS low (50 mg·kg-1), middle (100 mg·kg-1), High-dose (200 mg·kg-1) groups, 15 mice per group. After 7 days of pre-protection of the mice in the PNS groups according to the corresponding dose, the mice in the model group and the PNS treatment groups were injected with sodium iodate solution 25 mg·kg-1 through the tail vein to establish a mice model of retinal injury. The PNS treatment groups continued to intragastric administration for 28 days after modeling. Fundus photography and OCT were used to detect the retinal damage of mice; FFA was used to observe the leakage of retinal vascular; HE staining was used to observe the pathological changes of mice retinal; kits were used to detect the level of antioxidant index in serum of mice, ELISA were used to detect the serum level of inflammatory factors; Western blot was used to detect the expression of Nrf2 (nucleus), NF-κB p65 (nucleus), HO-1, NQO1 proteins of retinal tissues. Results Compared with the control group, a large number of yellow white drusen-like deposits appeared in the retina, the thickness of the retina was decreased (P<0.01), and extensive leakage of retinal blood vessels, the activity of SOD and the content of GSH were decreased in the serum (P<0.01), and the content of MDA, IL-6, TNF-α and IL-1β were increased in the model group (P<0.01). The yellow white drusen-like deposits in the retina of the administration groups were decreased, the thickness of the retina increased (P<0.05), and the blood vessel leakage was reduced; the SOD activity and the content of GSH in the serum increased (P<0.01), and the content of MDA, IL-6, TNF-α and IL-1β decreased (P<0.05); the protein expression of Nrf2 in the nucleus and HO-1 and NQO1 in the retinal tissue were increased (P<0.05), and the protein expression of NF-κB p65 in the nucleus was decreased (P<0.05). Conclusion PNS could attenuate sodium iodate-induced retinal damage through anti-oxidative stress and anti-inflammatory effects. The mechanism might be related to the activation of Nrf2/HO-1 signaling pathway by PNS.
Key words: panax notoginseng saponins;retinal damage;nuclear factor erythroid 2-related factor 2;heme oxygenase 1;quinoneoxido-reductase-1
年龄相关性黄斑变性(age-related macular degeneration, AMD)是导致老年人视力下降和致盲的主要原因[1-2],包括湿性和干性两种类型。湿性AMD的治疗目前主要使用靶向血管内皮生长因子受体的药物[3];干性AMD早期发病机制与氧化应激和炎症引起的视网膜色素上皮(retinal pigment epithelium, RPE)细胞生理功能受损有关,病理表现主要为布鲁赫氏膜和RPE细胞之间有玻璃膜疣沉积,光感受器细胞及RPE细胞地图样萎缩[4]。干性AMD的早期可使用抗氧化剂营养补充剂进行干预,如PreserVision AREDS 2(叶黄素10mg:玉米黄质2mg:维生素E 400IU:维生素C 500mg:锌80mg:铜2mg),在某些干性AMD患者中,可降低AMD进展的风险,但疗效欠佳[5-6],对于干性AMD临床上目前并无明确的治疗方法[7-8]。碘酸钠作为一种强氧化毒性剂,会使机体ROS增多,可特异性损伤RPE细胞,继而引起感光细胞损伤,这种病理变化与人干性AMD相似,以碘酸钠诱导的干性AMD小鼠模型已较为经典[9-10]。三七总皂苷(panax notoginseng saponins, PNS)是从传统中药三七中提取的主要有效成分,其药理作用包括抗炎、抗氧化和清除自由基等[11],PNS通过其抗氧化功能对高糖诱导的视网膜毛细血管内皮细胞的损伤产生保护作用[12]。PNS还可通过抑制视网膜的氧化应激与炎症反应,对光损伤小鼠的光感受器细胞发挥保护作用[13]。PNS中主要成分人参皂苷Rb1与人参皂苷Rd在人视网膜色素上皮细胞中抑制脂多糖诱导的促炎基因表达[14]。目前,PNS对碘酸钠诱导的小鼠视网膜损伤是否具有保护作用尚未见报道。本文将探讨PNS对碘酸钠诱导的小鼠视网膜损伤是否具有保护作用及可能的作用机制,为治疗干性AMD提供一定的参考。
1 材料与方法
1.1 实验动物
75只SPF级C57BL/6雄性小鼠,体重20~22 g,购自辽宁长生生物科技有限公司,许可证号:SCXK(辽)(2019-0003)。实验动物的喂养及实验相关操作于锦州医科大学心脑血管重点实验室内进行,已经取得锦州医科大学动物伦理委员会的批准(IACUC-2019038),实验期间小鼠自由摄食饮水。
1.2 主要试剂与仪器
三七总皂苷,纯度:≥98%,批号:GR-19070601,购自上海广锐生物科技有限公司;荧光素钠,货号:F809553;碘酸钠,纯度:99%,货号:S817792,购自上海麦克林生化科技有限公司;戊巴比妥钠,货号:P3761,购于美国Sigma公司。Nrf2抗体(货号:12721S)、HO-1抗体(货号:43966S)购于美国Cell Signaling Technology生物公司;NQO1抗体(货号:DF6437)购于Affinity Biosciences公司;NF-κB p65(货号:A2547)、β-actin抗体(货号:AC026)、辣根过氧化物酶(HRP)标记山羊抗兔IgG抗体(二抗)(货号:AS014)均购于ABclonal Technology公司;LaminB抗體(货号:WL01775)购于沈阳万类生物公司。Mouse TNF-α ELISA KIT(货号:YX-201407M)、Mouse IL-6 ELISA KIT(货号:YX-091206M),Mouse IL-1β ELISA KIT(货号:YX-091203M)购于美国R&D公司;SOD试剂盒(货号:A001-3),GSH试剂盒(A006-2-1),MDA试剂盒(货号:A003-1)购于南京建成生物工程研究所有限公司。小动物眼底成像系统(美国Phoenix);光学相干断层扫描仪和血管造影仪(加拿大Optoprobe公司);光学显微镜(德国Leica);Multiskan Mk3型酶标仪(上海赛默飞世尔仪器有限公司产品);蛋白电泳与转膜系统(美国Bio-Rad公司)。
1.3 方法
1.3.1 实验动物分组及给药
75只小鼠适应性喂养一周后,按体重随机分为正常组、模型组、PNS低(50 mg·kg-1)、中(100 mg·kg-1)、高剂量组(200 mg·kg-1)[15],每组15只。PNS溶于0.5%羧甲基纤维素钠溶液中,分别按上述剂量灌胃给药预保护7 d,正常组与模型组小鼠灌胃等体积0.5%羧甲基纤维素钠溶液。除正常组外,其余各组小鼠一次性鼠尾静脉注射1%碘酸钠溶液25 mg·kg-1[16-17](碘酸钠溶解于生理盐水中,终浓度为1%),建立小鼠视网膜损伤模型;正常组注射等量的生理盐水。继续灌胃给药28 d,各组小鼠给药体积均为10 mL·kg-1。
1.3.2 眼底照相及光学相干断层扫描(optical coherence tomography, OCT)
给药结束后,以戊巴比妥钠将小鼠麻醉后,使用复方托吡卡胺滴眼液散瞳,涂一层眼用凝胶于角膜。使用Retina Imaging System进行眼底照相,调整OCT镜头与参数进行观察并拍照,利用Image J软件分析视网膜相对厚度。
1.3.3 眼底荧光素钠血管造影(fluorescein fundus angiography, FFA)
给药结束后,将小鼠麻醉、散瞳,涂一层眼用凝胶于角膜,立即腹腔注射荧光素钠(6mg·kg-1)溶液进行视网膜血管造影,然后采用Retina Imaging System检测。
1.3.4 样本的收集
实验结束后,摘除小鼠左眼球取血,3000 r·min-1离心20min,分离血清,置于-80℃保存;左侧眼球取出后用生理盐水清洗眼球表面残留血液,固定于改良的FFA固定液(冰醋酸∶甲醛∶生理盐水∶75%乙醇=1∶2∶7∶10)[18]。将小鼠右侧眼球取出,用生理盐水清洗干净,剥离视网膜,冻存于-80℃,备用。
1.3.5 苏木精-伊红(hematoxylin eosin, HE)染色
小鼠左侧眼球于改良的FFA固定液中固定24h,用石蜡包埋,以视神经与角膜中心为轴向切片,厚度为5 μm,进行常规HE染色,使用光学显微镜观察视网膜结构。
1.3.6 小鼠血清中SOD、GSH、MDA含量检测
取出冻存于-80 ℃冰箱中的血清,按照南京建成生物工程研究所有限公司说明书要求分别进行测定。
1.3.7 小鼠血清中TNF-α、IL-6、IL-1β含量测定
取出冻存于-80 ℃冰箱中的血清,采用ELISA法分别对TNF-α、IL-6、IL-1β的含量进行检测。
1.3.8 Western blot检测小鼠视网膜组织蛋白表达
按照BCA蛋白定量法测定视网膜组织中的蛋白含量并绘制标准曲线。每组取40 μg蛋白样品进行SDS-PAGE电泳,转膜封闭后分别加入相应的一抗孵育过夜,洗膜后加入二抗,通过化学发光试剂盒进行显影成像。用Image J软件计算目的条带的相对蛋白表达量。
1.4 统计学分析
用SPSS 26.0软件进行数据处理,数据结果以均数±标准差(±S)表示,多组间比较采用单因方差分析,方差齐则采用LSD法检验,方差不齐则采用Games-Howell法检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 PNS对小鼠眼底的影响
与正常组相比,模型组小鼠眼底损伤严重,出现大量黄白色类似玻璃膜疣物质;经PNS治疗后各组小鼠眼底损伤减轻,黄白色类似玻璃膜疣物质有不同程度的减少,高剂量组减少最明显,结果见图1。
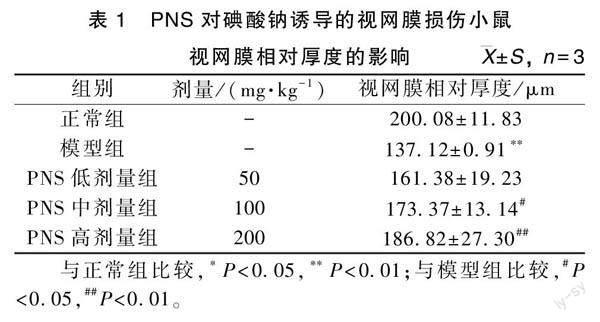
2.2 PNS对小鼠视网膜厚度的影响
正常组的视网膜各层结构排列整齐,密度均匀;与正常组相比,模型组小鼠视网膜结构排列紊乱,RPE层出现高反射点,光感受器层与外核层受损,视网膜相对厚度减小(P<0.01)。
与模型组比较,中和高剂量治疗组小鼠视网膜RPE层结构排列紊乱程度均有不同程度的减轻,RPE层高反射点减少,光感受器层与外核层受损程度减轻,且视网膜相对厚度增加(P<0.05,P<0.01),结果见表1和图2。
2.3 PNS对小鼠眼底血管完整性的影响
正常组小鼠视网膜中血管充盈明显,可清晰的看到各级血管分布情况;与正常组相比,模型组小鼠视网膜中次级血管分布不明显,视网膜血管出现大面积渗漏;与模型组比较,经PNS治疗后,各组小鼠视网膜血管渗漏面积减少,高剂量组减少最明显,结果见图3。
2.4 PNS对小鼠视网膜组织形态学的影响
正常组小鼠视网膜各层细胞排列整齐且密度均匀,结构完整;与正常组相比,模型组小鼠视网膜光感受器细胞层和RPE层的结构被破坏,并可见大量的棕褐色玻璃膜疣沉积;与模型组相比,经PNS治疗后各组小鼠视网膜光感受器细胞层和RPE层的结构损伤好转,棕褐色玻璃膜疣数量减少,高剂量组减少最为明显,结果見图4。
2.5 PNS对小鼠血清中SOD、GSH、MDA水平的影响
与正常组相比,模型组小鼠血清中SOD活力、GSH含量下降,MDA含量上升(P<0.01);与模型组 相比,PNS低、中和高剂量治疗组小鼠血清中SOD活力上升(P<0.01),PNS中、高剂量治疗组小鼠血清中GSH含量上升,MDA含量下降(P<0.05,P<0.01),结果见表2。
2.6 PNS对小鼠血清中IL-6、IL-1β、TNF-α含量的影响
与正常组相比,模型组小鼠血清中IL-6、TNF-α与IL-1β含量升高(P<0.05,P<0.01);与模型组相比,PNS低、中与高剂量治疗组小鼠血清中TNF-α、IL-6含量降低(P<0.05,P<0.01),PNS高剂量治疗组IL-1β含量降低(P<0.05),结果见表3。
2.7 PNS对小鼠视网膜中Nrf2、HO-1、NQO1、NF-κB p65蛋白表达的影响
与正常组相比,模型组小鼠视网膜中细胞核内Nrf2,HO-1、NQO1表达升高但无统计学意义,细胞核内NF-κB p65蛋白表达升高(P<0.05);与模型组相比,PNS中、高剂量治疗组小鼠视网膜中细胞核内Nrf2,HO-1蛋白表达升高(P<0.05,P<0.01),核内NF-κB p65表达减少(P<0.05,P<0.01);PNS低、中和高剂量治疗组小鼠视网膜中NQO1蛋白表达升高(P<0.05,P<0.01),结果见图5和表4。
3 讨论
AMD是一种病因不明的多因素诱发的眼底疾病,干性AMD发病机制与氧化应激、慢性炎症等因素密切相关[19-20]。视网膜作为人体中耗氧量较多的组织之一。长期及持续的光线照射,丰富的多不饱和脂肪酸以及大量的光敏剂均增加了视网膜组织中ROS的生成,当ROS产生的增多并且超过机体的抗氧化应激能力时,会引起细胞蛋白质、脂质和DNA被修饰并进一步造成损伤[21]。长期的氧化应激状态会使RPE细胞受损,RPE细胞的功能障碍,会进一步引起AMD的慢性炎症过程,玻璃膜疣作为早期AMD病变的主要特点,是局部炎性反应的表现[22],因此目前,降低机体氧化应激状态和抑制炎症反应,是防治干性AMD的重要措施。
本次实验通过小鼠尾静脉注射碘酸钠诱导小鼠视网膜损伤,模拟干性AMD病理变化。通过观察视网膜层次结构、测量视网膜相对厚度、比较玻璃膜疣沉积的数量,进一步探讨PNS在体内对干性AMD的治疗是否有效。本研究发现给予碘酸钠处理后,小鼠视网膜RPE层和光感受器层、外核层都出现了不同程度的损伤,出现大量玻璃膜疣沉积,说明小鼠视网膜氧化损伤模型制备成功。在给予PNS治疗后,RPE层结构排列紊乱程度减轻、高反射点减少,光感受器层与外核层紊乱程度降低,并抑制视网膜相对厚度变薄,保护了视网膜血管的完整性,减少了玻璃膜疣的数量。提示PNS可减轻由碘酸钠诱导的小鼠视网膜损伤。
SOD是机体中重要的抗氧化酶,可清除氧自由基;GSH作为机体中重要的还原剂,其含量的多少也是评价机体抗氧化应激能力的重要指标之一。MDA作为一种脂质过氧化反应产物,是自由基损害的标志[23-24],可间接反映机体受氧化应激损害的程度。HO-1是血红素降解的限速酶,通过上调 HO-1,可改善氧化应激引起的损伤[25];NQO1作为一种黄素酶,可改善由代谢引起的氧化应激损伤,维持细胞内物质处于氧化还原平衡状态[26]。Nrf2信号通路是机体内重要的内源性抗氧化应激信号通路。当细胞处于氧化应激状态时,在细胞质中,Nrf2与它的抑制蛋白果蝇肌动蛋白结合蛋白Kelch解偶联、并转位入核激活靶基因转录进而调节下游多种保护性蛋白如SOD、GSH、HO-1与NQO1等基因的轉录,清除过多的ROS,提高机体对氧化应激的抵抗能力[27-28]。NF-κB是经典的炎症信号分子,作为重要的核转录因子,介导一些炎症因子的转录,参与调节炎症反应、细胞凋亡等多种病理生理过程[29]。本研究中与对照组相比,模型组小鼠血清中SOD活力、GSH含量下降,MDA含量上升,说明模型组小鼠抗氧化应激能力不足;Nrf2/HO-1通路相关蛋白的表达升高,说明在碘酸钠作用下,视网膜对氧化应激作出了适应性反应。经PNS治疗后,小鼠血清中SOD活力上升,GSH含量增加,MDA含量下降,Nrf2/HO-1通路相关蛋白Nrf2、HO-1、NQO1蛋白表达升高,说明PNS可提高机体抗氧化应激的能力,其可能是通过增加Nrf2/HO-1通路相关蛋白Nrf2的核内的表达量,刺激下游抗氧化蛋白 HO-1、NQO1蛋白表达,提高抗氧化酶SOD活力、GSH含量,降低MDA含量,从而发挥抗氧化应激的作用。同时在碘酸钠作用下,模型组小鼠视网膜组织细胞核中NF-κB信号通路中的关键蛋白NF-κB p65的表达上调,其下游炎症因子IL-6、IL-1β、TNF-α的释放增加。经PNS干预后视网膜组织细胞核中NF-κB p65蛋白的表达下降,由NF-κB调控释放的炎症因子IL-6、IL-1β与TNF-α的表达水平下降,表明PNS具有抗炎作用。综上所述,本研究发现PNS对碘酸钠诱导的小鼠视网膜损伤有改善作用,同时明确了PNS对Nrf2/HO-1信号通路具有调控作用。
参考文献(References)
[1]THOMAS C J,MIRZA R G,GILL M K.Age-related macular degeneration[J].Medical Clinics of North America,2021,105(3):473-491.
[2]DENG Y H,QIAO L F,DU M Y,et al.Age-related macular degeneration:epidemiology,genetics,pathophysiology,diagnosis,and targeted therapy[J].Genes Dis,2021,9(1):62-79.
[3]GERDING H.Long-term results of intravitreal Anti-VEGF injections in Wet AMD:a meta-analysis[J].Klin Monbl Augenheilkd,2016,233(4):471-474.
[4]VANLOOKEREN C M,LECOUTER J,YASPAN B L,et al.Mechanisms of age-related macular degeneration and therapeutic opportunities[J].J Pathol,2014,232(2):151-164.
[5]Age-Related Eye Disease Study 2 Research Group.Lutein+zeaxanthin and omega-3 fatty acids for age-related macular degeneration:the Age-Related Eye Disease Study 2 (AREDS2) randomized clinical trial[J].JAMA,2013,309(19):2005-2015.
[6]Age Related Eye Disease Study Research Group.A randomized,placebo-controlled,clinical trial of high-dose supplementation with vitamins C and E,beta carotene,and zinc for age-related macular degeneration and vision loss:AREDS Report No.8[J].Arch Ophthalmol,2001,119(10):1417-1436.
[7]FERNANDES A R,ZIELIN'SKA A,SANCHEZ-LOPEZ E,et al.Exudative versus nonexudative age-related macular degeneration:physiopathology and treatment options[J].Int J Mol Sci,2022,23(5):2592.
[8]STAHL A.The diagnosis and treatment of age-related macular degeneration[J].Dtsch Arztebl Int,2020,117(29-30):513-520.
[9]刘杨.BMSCs在AMD动物模型中的应用及机制探讨[D].吉林:吉林大学,2019.
[10]WANG J,IACOVELLI J,SPENCER C,et al.Direct effect of sodium iodate on neurosensory retina[J].Invest Ophthalmol Vis Sci,2014,55(3):1941-1953.
[11]梁晓莲,刘纤纤,李文莉,等.三七总皂苷药理作用及临床应用研究进展[J].湖北农业科学,2021,60(6):15-19.
LIANG X L,LIU X X,LI W L,et al.Research progress in pharmacological effects and clinical applications of Panaxnotoginseng saponins[J].Hubei Agricultural Sciences,2021,60(6):15-19.
[12]FAN Y,QIAO Y,HUANG J M,et al.Protective effects of panax notoginseng saponins against high glucose-induced oxidative injury in rat retinal capillary endothelial cells[J].Evid Based Complement Alternat Med,2016,2016:5326382.
[13]金茹娜,郭红,徐静,等.三七总皂苷对新生血管性视网膜病变的干预效应及机制研究[J].世界科学技术-中医药现代化,2021,23(1):108-116.
JIN R N,GUO H,XU J,et al.Intervention effect and mechanism of panax notoginseng saponins on neovascular retinopathy[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2021,23(1):108-116.
[14]BIAN M J,DU X Y,WANG P W,et al.Combination of ginsenoside Rb1 and Rd protects the retina against bright light-induced degeneration[J].Sci Rep,2017,7(1):6015.
[15]董蘇敏,胡相卡,赵苗鑫,等.三七总皂苷对糖尿病肾病小鼠的肾保护作用机制研究[J].中国临床药理学杂志,2021,37(17):2303-2307.
DONG S M,HU X K,ZHAO M X,et al.Protective effect and mechanism of panax notoginseng saponins on kidney injury in diabetic mice[J].The Chinese Journal of Clinical Pharmacology,2021,37(17):2303-2307.
[16]牛占宇,李建德,石永鹏,等.尾静脉注射碘酸钠对小鼠视网膜形态结构变化的影响[J].眼科新进展,2021,41(1):18-22.
NIU Z Y,LI J D,SHI Y P,et al.Effect of sodium iodate on morphological and structural changes of retina in mice[J].Recent Advances in Ophthalmology,2021,41(1):18-22.
[17]AUNG K H,LIU H,KE Z,et al.Glabridin attenuates the retinal degeneration induced by sodium iodate in vitro and in vivo[J].Front Pharmacol,2020,11:566699.
[18]罗灿峤,梁英杰,吴惠群,等.小鼠眼球标本固定液及制片方法的改进[J].中国组织化学与细胞化学杂志,2007(1):124-125.
LUO C Q,LIANG Y J,WU H Q,et al.Improvement of fixative solution and preparation method of mouse eyeball specimen[J].Chinese Journal of Histochemistry and Cytochemistry,2007(1):124-125.
[19]张敬法,张宇萌,孙晓东.干性年龄相关性黄斑变性发病机制及治疗[J].眼科新进展,2022,42(3):169-178.
ZHANG J F,ZHANG Y M,SUN X D.Pathogenesis and treatment of dry age-related macular degeneration[J].Recent Advances in Ophthalmology,2022,42(3):169-178.
[20]LIU R T,WANG A,TO E,et al.Vinpocetine inhibits amyloid-beta induced activation of NF-κB,NLRP3 inflammasome and cytokine production in retinal pigment epithelial cells[J].Exp Eye Res,2014,127:49-58.
[21]KAARNIRANTA K,PAWLOWSKA E,SZCZEPANSKA J,et al.Role of mitochondrial DNA damage in ROS-mediated pathogenesis of age-related macular degeneration (AMD)[J].Int J Mol Sci,2019,20(10):2374.
[22]KAUPPINEN A,PATERNO J J,BLASIAK J,et al.Inflammation and its role in age-related macular degeneration[J].Cell Mol Life Sci,2016,73(9):1765-1786.
[23]PIAO C S,GAO S,LEE G H,et al.Sulforaphane protects ischemic injury of hearts through antioxidant pathway and mitochondrial K(ATP) channels[J].Pharmacol Res,2010,61(4):342-348.
[24]张成国,孙国祥,杨晓,等.谷胱甘肽抑制氧化应激反应进展[J].科技创新与应用,2021,11:50-55.
ZHANG C G,SUN G X,YANG X,et al.Progress in glutathione inhibiting oxidative stress response[J].Technology Innovation and Application,2021(11):50-55.
[25]蒋丽,芮燕君,戴佳琪,等.丹参酮IIA对过氧化氢诱导的人晶状体上皮细胞凋亡和氧化应激的影响[J].眼科新进展,2021,41(9):838-842.
JIANG L,RUI Y J,DAI J Q,et al.Influence of tanshinone ⅡA on H2O2-induced apoptosis and oxidative stress in human lens epithelial cells via activating the Nrf2/HO-1 pathway[J].Recent Advances in Ophthalmology,2021,41(9):838-842.
[26]景亮,祁永章.紅景天苷对糖尿病足溃疡大鼠Nrf2/Keap1信号通路及伤口愈合的影响[J].中国比较医学杂志,2021,31(8):48-54.
JING L,QI Y Z.Effects of salidroside on the Nrf2/Keap1 signaling pathway and wound healing in rats with diabetic foot ulcer[J].Chinese Journal of Comparative Medicine,2021,31(8):48-54.
[27]ZHANG J H,ZHOU H T,CHEN J L,et al.Aloperine protects human retinal pigment epithelial cells against hydrogen peroxide-induced oxidative stress and apoptosis through activation of Nrf2/HO-1 pathway[J].J Recept Signal Transduct Res,2022,42(1):88-94.
[28]LOBODA A,DAMULEWICZ M,PYZA E,et al.Role of Nrf2/HO-1 system in development,oxidative stress response and diseases:an evolutionarily conserved mechanism[J].Cell Mol Life Sci,2016,73(17):3221-3247.
[29]吴军,关涛,田峰,等.瑞香素对脊髓损伤大鼠运动功能改善作用的TRL4/NF-κB信号通路机制研究[J].中国比较医学杂志,2021,31(4):84-90.
WU J,GUAN T,TIAN F,et al.Effects of daphnetin on motor function of spinal cord injury based on the TRL4/NF-κB signaling pathway in rats[J].Chinese Journal of Comparative Medicine,2021,31(4):84-90.
(责任编辑:编辑唐慧)
收稿日期:中文收稿日期2022-07-05
基金项目:辽宁省高等学校创新人才支持计划项目(LR2019028);辽宁省教育厅服务地方项目(JYTFW201915)
作者简介:蔡曾晓瑞(1997—),女,硕士研究生,专业方向为中药药效学研究。
*通信作者:代春美(1977—),女,教授,从事中药药理及安全性评价、中药生物质量控制方面的研究,e-mail:lnmupharmacy@163.com。

